CD8+T 细胞在大鼠慢性支气管炎中表达及意义
2015-05-07刘积锋钟小宁何志义牙蕾蕾覃向林张建全
刘积锋,钟小宁,何志义,牙蕾蕾,覃向林,张建全,陈 罡
0 引 言
慢性阻塞性肺疾病(chronicobstructivepulmonarydiseases,COPD)在机体病理上主要表现为慢性支气管炎和肺气肿,CD8+T 细胞在COPD 中增多,在其稳定期也持续存在,与小气道炎症渗出有关[1-3]。近年来研究表明在神经炎症情况下可启动CD8+T细胞表达从而增加血管通透性[4-6]。研究表明,血管内皮生长因子(vascular endothelial growth factor,VEGF)表达可减轻血管通透性和炎症浸出[7-9]。CD8+T 细胞是否与COPD 的小气道VEGF 表达增加及气道炎症损伤有关尚不清楚。N-乙酰半胱氨酸(acetylcysteine,NAC)抗氧化机制是通过下调核因子-κB(nuclear factor-κB,NF-κB)活性来减轻炎症反应[10-12],NAC 是否通过抑制NF-κB 活性使CD8+T 细胞降低尚不清楚。本实验观察烟草烟雾暴露及脂多糖诱导的慢性支气管炎大鼠的小气道CD8+T 的表达,通过给予NAC 干预来探讨小气道CD8+T 细胞VEGF 及炎症损伤浸出的关系。
1 材料与方法
1.1 材料 SPF 级健康雄性Wistar 大鼠,体重(230±20)g,18 只,实验动物合格证号:SCXK 桂2009-0002,由广西医科大学动物实验中心提供;刘三姐烤烟型香烟(南宁卷烟厂生产)(焦油含量:15 mg,烟碱含量:1.1 mg);自制0.22 m3玻璃箱(1.00 m×0.55 m×0.40 m);AB204-E 分析天平(瑞士梅特勒—托利多公司生产,广西医科大学实验中心提供);YHL-1 智能测氧仪(中国航天科技集团公司第七零三研究所生产);奥林巴斯光学显微镜(日本奥林巴斯公司生产,广西医科大学实验中心提供)及Image-Pro Plus 6.0 软件(美国Media Cybernetics 公司,广西医科大学实验中心提供)。脂多糖(lipopolysaccharide,LPS)和NAC 均购自美国Sigma公司。CD8+、NF-κB、Ⅰ类主要相容性复合体(major histocompatibility complex classI,MHCI)及VEGF 一抗(Santa Cruz 公司生产,美国),CD8+T 细胞二抗(CheIIlicon 公司,美国);MHCI 二抗(Santa Cruz 公司生产,美国),NF-κB、VEGF 二抗、二氨基联苯胺(均购于福州迈新公司)。
1.2 制备实验动物模型 参照钟小宁等[13]的方法,采用2 次气管内注入LPS 及烟熏4 周建立大鼠慢性支气管并肺气肿动物模型。将大鼠按随机数字表法分为3 组:假吸烟组、慢性支气管炎和NAC 组,每组6 只。3 组大鼠均以相同饲料及水喂养(由广西医科大学动物实验中心提供)。假吸烟组大鼠第1、14天经气道内注入等渗盐水0.2 mL,注入前1 d 用双蒸馏水灌胃(1 mL/只),第2-13 天及第15-28 天放入玻璃箱内2 h/d(箱内有一小孔与外界相通,内置无水氯化钙及钠石灰吸收水分和CO2,氧浓度稳定在21%),每天放入箱前用双蒸馏水灌胃(1 mL/只),大鼠可在玻璃箱内自由进食、饮水。慢性支气管炎组大鼠第1、14 天经气道内注入LPS 200 μg(1 μg/μL),注入LPS 溶液前1 d 用双蒸馏水灌胃(1 mL/只),第2-13 天及第15-28 天在与假吸烟组相同条件的玻璃箱内烟熏2 h(每次5 支,30 min/次),烟熏前用双蒸馏水给大鼠灌胃(1 mL/只)。NAC 组大鼠气道内注入LPS 溶液前1 d 用NAC 给大鼠灌胃(200 mg/kg,用双蒸馏水稀释成50 mg/mL 溶液),第2-13 天及第15-28 天烟熏前NAC 给大鼠灌胃(200 mg/kg,用双蒸馏水稀释成50 mg/mL 溶液),烟熏方法与慢性支气管炎组相同。
1.3 肺组织病理学标本制备及切片染色 根据Givi等[14]的方法制备肺病理学标本组织,右下叶距肺门约3 mm 处取材,连续切片行HE 染色。取左下肺用10%中性甲醛固定24 h 后石蜡包埋,在距肺门4 mm 处切片。
1.4 气道炎症病变的观察指标及评分方法 根据Cosio等[15]设计的小气道病变评估方法加以改进观察(由2 名不知分组情况的病理科医师完成),每只大鼠选择5 条直径在700 ~1200 μm 的膜性细支气管,观察小气道炎症7 项指标[15]并评分:无病变者为0 分,轻度、中度、重度炎症病变分别评为1、2、3分。然后累加每一指标得分,取平均值作为该指标病理积分。
1.5 肺组织NF-κB、MHCI、CD8+T 细胞表达及VEGF 免疫组化评价方法 所有切片观察参照文献[15]的方法,由2 名不知分组情况的病理医师完成。参照文献[16]的方法进行评分:阳性细胞数<10%为“-”、10%~24%为“+”、25%~75%为“2+”、>75%为“3+”,分别计分为1、2、3、4 分;显色强度分别以“+/-”、“+”、“2+”表示,分别计分为1、2、3 分,将两者计分相乘取平均值。1 ~4 分为低表达、5 ~8分为中表达、9 ~12分为高表达。
1.6 统计学分析 采用SPSS 11.5 软件进行统计分析,定量资料以中位数(四分位间距)表示,相关分析采用Kendall 等级相关分析,以P≤0.05 为有统计学意义。
2 结 果
2.1 小气道病理学改变 假吸烟组仅见少量纤毛倒伏粘连、无纤毛脱落,上皮细胞无变性坏死和糜烂脱落,无杯状细胞增生,气道黏膜无水肿渗出,管壁仅见少量淋巴细胞,无中性粒细胞和单核细胞浸润。慢性支气管炎组存在纤毛倒伏粘连和脱落、上皮细胞变性坏死糜烂脱落、杯状细胞增生、气道管壁黏膜充血水肿渗出明显、管壁炎症细胞浸润(包括淋巴细胞、中性粒细胞、单核细胞)。NAC 组小气道纤毛倒伏粘连和脱落、上皮细胞变性坏死糜烂脱落、管壁炎症细胞浸润均减轻。见图1。假吸烟组、NAC 组病理积分(1.17±2.40、4.66±2.25)均较慢性支气管炎组(10.83±3.31)降低(P <0.05),而假吸烟组与NAC 组病理积分差异无统计学意义(P >0.05)。
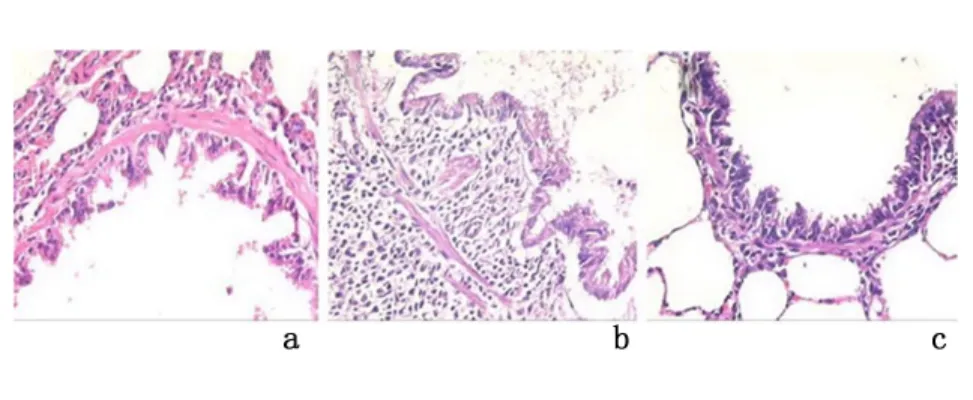
图1 镜下观察大鼠气道病理形态(HE ×400)Figure 1 The pathomorphologicalfeatureof airway in each group(HE ×400)
2.2 NF-κB、MHCI、CD8+T 细胞及VEGF 表达光学显微镜下可见:NF-κB 主要在气道上皮细胞的细胞质和细胞核中表达,MHCI 主要在气道上皮细胞表面表达,CD8+细胞在气道上皮细胞组织中表达。VEGF 在气道上皮细胞组织中及外周组织均有表达。慢性支气管炎组、NAC 组的CD8+T 细胞、VEGF 表达较假吸烟组、NAC 组高(P <0.05),假吸烟组与NAC组的MHCI、CD8+T 细胞、VEGF 表达差异无统计学意义(P >0.05)。见图2-图5,表1。经Spearman's相关分析,NF-κB 与MHCI、CD8+T 细胞呈正相关(r=0.794,P=0.0046;r=0.670,P=0.002),MHCI与CD8+T 细胞呈正相关(r=0.701,P=0.007),CD8+T 细胞与VEGF 细胞呈正相关(r=0.782,P <0.01),VEGF 在膜性支气管壁和外周组织中的表达与小气道炎症积分呈正相关(r=0.689,P=0.002)。
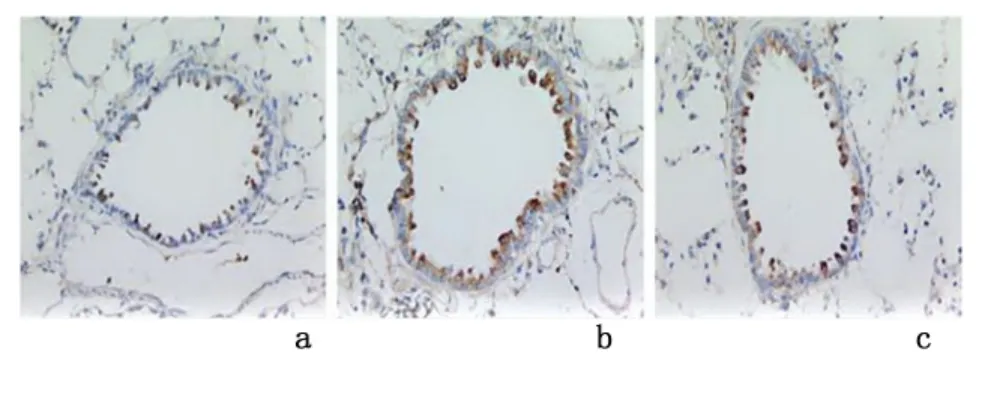
图2 光学显微镜下观察NF-κB 在大鼠气管的表达(SP×400)Figure 2 The expression of NF-κB in airway of each group(immunohistochemisty stained by labeled streptavidin biotin method ×400)
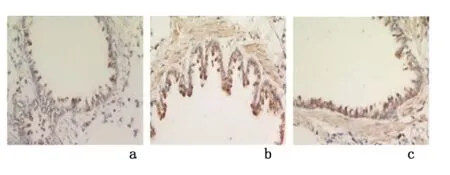
图3 光学显微镜下观察MHCI 在大鼠气道腔上皮细胞的表达(SP ×400)Figure 3 The expression of MHCI in airway of each group(immunohistochemisty stained by labeled streptavidin biotin method ×400)
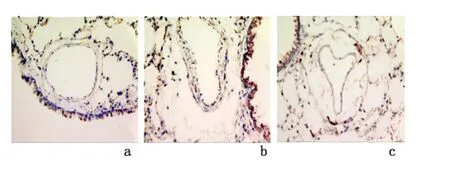
图4 光学显微镜下观察CD8+在大鼠气管的表达(SP×400)Figure 4 The expression of CD8+in airway of each group(immunohistochemisty stained by labeled streptavidin biotin method ×400)
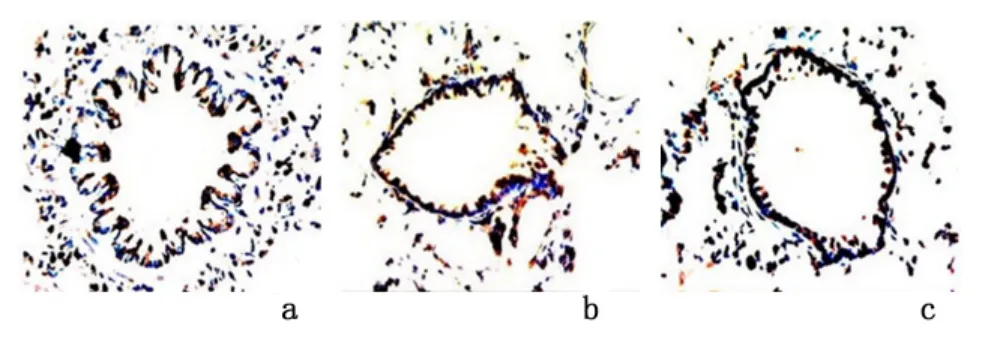
图5 光学显微镜下观察VEGF 在大鼠气管的表达(SP×400)Figure 5 The expression of VEGF in airway of each group(immunohistochemisty stained by labeled streptavidin biotin method ×400)

表1 大鼠NF-κB、MHCI、CD8+T 细胞和VEGF 的表达比较[中位数(P25,P75)]Table 1 The expression of NF-κB,MHCI,CD8+T and VEGF in each group(M[P25,P75])
3 讨 论
本研究表明烟草烟雾暴露和LPS 诱导大鼠慢性支气管炎中NF-κB、MHCI 和CD8+T 细胞主要在气道上皮组织中表达升高,VEGF 在气道上皮组织中和外周组织中表达均升高,同时小气道病理积分增多;NF-κB、MHCI 与CD8+T 细胞呈正相关,CD8+T 细胞与VEGF 升高和小气道病理积分呈正相关;表明气道上皮组织NF-κB 和MHCI 表达增强可能与CD8+T细胞活化浸润有关,CD8+T 细胞活化浸润与VEGF的表达和小气道炎症损伤浸出有关。而给予NAC预防性干预后支气管壁上皮组织的NF-κB、MHCI 表达下调和CD8+T 细胞减少,同时VEGF 表达和小气道病理积分下降。
上皮组织NF-κB 活化后可促进MHCI 表达来激活CD8+T 细胞等炎症细胞[18-20]。而近年来研究表明CD8+T 细胞在神经炎症情况下可启动VEGF 表达促进血管通透性[4-6],VEGF 升高可导致血管内皮细胞的连接增宽引起通透性增加和炎症细胞浸出[6-8]。本研究显示大鼠慢性支气管炎中上皮组织NF-κB 表达升高与CD8+T 细胞增多及与VEGF 在气道上皮细胞中表达升高和小气道损伤炎症细胞浸出有关,表明大鼠支气管上皮细胞受到烟草烟雾刺激后可能激活NF-κB 炎症信号并将抗原通过MHCI提呈给CD8+T 细胞使其细胞活化增多,并诱导VEGF 在气道上皮细胞中表达升高引起气道炎症浸出及损伤反应。近年来研究显示NAC 可通过抑制NF-κB 活性而减轻炎症和组织损伤[10-12,21-22]。在本研究中经NAC 预防性干预后大鼠NF-κB、MHCI表达降低和CD8+T 细胞减少,并使VEGF 在气道上皮细胞中表达下降和减轻小气道损伤浸出,说明NAC 可能抑制烟草烟雾暴露和LPS 诱导大鼠慢性支气管炎中NF-κB、MHCI 表达而抑制CD8+T 细胞和VEGF 活化从而减轻小气道炎症损伤浸出。
[1] Vestbo J,Hurd SS,Agustí AG,et al.Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease:GOLD executive summary[J].Am J Respir Crit Care Med,2013,187(4):347-365.
[2] Löfdahl MJ,Roos-Engstrand E,Pourazar J,et al.Increased intraepithelial T-cells in stable COPD[J].Respir Med,2008,102(12):1812-1818.
[3] 孔令雯,董竞成.氧化应激致组蛋白修饰在慢性阻塞性肺病发生发展中的作用[J].医学研究生学报,2014,27(9):968-972.
[4] Suidan GL,Dickerson JW,Chen Y,et al.CD8 T cell-initiated vascular endothelial growth factor expression promotes central nervous system vascular permeability under neuroinflammatory conditions[J].J Immunol,2010,184(2):1031-1040.
[5] Suidan GL,Dickerson JW,Johnson HL,et al.Preserved vascular integrity and enhanced survival following neuropilin-1 inhibition in a mouse model of CD8 T cell-initiated CNS vascular permeability[J].J Neuroinflammation,2012,18(9):218-224.
[6] Suidan GL,Mcdole JR,Chen Y,et al.Induction of blood brain barrier tight junction protein alterations by CD8 T cells[J].PLoS One,2008,3(8):e3037-3046.
[7] 韩曼丽,章金春.雷公藤多苷对胶原诱导性关节炎大鼠组织中血管内皮生长因子及血管内皮生长因子受体2 mRNA 表达水平的影响[J].医学研究生学报,2013,26(5):478-480.
[8] Azimi-Nezhad M,Stathopoulou MG,Bonnefond A,et al.Associations of vascular endothelial growth factor(VEGF)with adhesion and inflammation molecules in a healthy population[J].Cytokine,2013,61(2):602-607.
[9] Park SJ,Lee KS,Kim SR,et al.AMPK activation reduces vascular permeability and airway inflammation by regulating HIF/VEGFA pathway in a murine model of toluene diisocyanate-induced asthma[J].Inflamm Res,2012,61(10):1069-1083.
[10] 邹小英,何志义,邓家珍,等.N-乙酰半胱氨酸对吸烟所致大鼠肺部炎症的影响[J].中国病理生理杂志,2008,24(10):2013-2015.
[11] 刘小龙,王常田,黄海嵘,等.白藜芦醇减轻大鼠体外循环肺损伤的实验研究[J].医学研究生学报,2013,26(3):244-247.
[12] 吕秋石,郭芮兵,姜永军,等.神经生长因子对颅脑外伤大鼠的抗炎作用机制[J].医学研究生学报,2014,27(10):1020-1022.
[13] 钟小宁,白 晶,施焕中,等.慢性支气管炎与肺气肿大鼠气道炎症与重塑的实验研究[J].中华结核和呼吸杂志,2003,26(12):750-755.
[14] Givi ME,Peck MJ,Boon L,et al.The role of dendritic cells in the pathogenesis of cigarette smoke-induced emphysema in mice[J].Eur J Pharmacol,2013,721(1-3):259-266.
[15] Cosio M,Chezzo H,Hogg JC,et al.The relations between structural changes in small airways and pulmonary function tests[J].N Engl J Med,1978,298(23):1277-1281.
[16] 徐 洪,杨 方,袁 媛,等.免疫组织化学Image Pro Plus图像半定量分析的参数选择[J].解剖学杂志,2012,35(1):37-41.
[17] 刘积锋,钟小宁,张健全,等.血管内皮生长因子与慢性支气管炎并肺气肿大鼠早期肺动脉重塑关系的研究[J].中华结核和呼吸杂志,2006,29(5):353-354.
[18] Wullaert A,Bonnet MC,Pasparakis M.NF-κB in the regulation of epithelial homeostasis and inflammation[J].Cell Res,2011,21(1):146-158.
[19] Sohal SS,Reid D,Soltani A,et al.Evaluation of epithelial mesenchymal transition in patients with chronic obstructive pulmonary disease[J].Respir Res,2011,12(10):130.
[20] Kreisel D,Lai J,Richardson SB,et al.Polarized alloantigen presentation by airway epithelial cells contributes to direct CD8+T cell activation in the airway[J].Am J Respir Cell Mol Biol,2011,44(6):749-754.
[21] Wang HW,Yang W,Lu JY,et al.N-acetylcysteine administration is associated with reduced activation of NF-κB and preserves lung dendritic cells function in a zymosan-induced generalized inflammation model[J].J Clin Immunol,2013,33(3):649-660.
[22] Pires KM,Lanzetti M,Rueff-Barroso CR,et al.Oxidative damage in alveolar macrophages exposed to cigarette smoke extract and participation of nitric oxide in redox balance[J].Toxicol In Vitro,2012,26(6):791-798.
