上皮间质转化在大鼠舌黏膜创口愈合中的作用
2015-05-07孔苗苗孙应明张梦洁张亚军杨聪翀刘来奎
孔苗苗,孙应明,张梦洁,张亚军,杨聪翀,刘来奎
0 引 言
上皮间质转化(epithelial mesenchymal transition,EMT)即上皮细胞在形态学上发生向间充质细胞表型的转变并获得迁徙能力的过程[1]。EMT 是胚胎发育的一个基本过程,同时在创伤愈合、慢性炎症、癌症转移及多种纤维化疾病中发挥了重要作用。大量的证据证明EMT 在多种肿瘤侵袭转移和创伤愈合过程中发挥重要的作用[2]。然而在口腔黏膜创伤愈合过程中是否发生EMT 目前研究报道较少。本实验我们对大鼠舌部黏膜创口愈合过程采用间接免疫荧光的方法同步检测上皮细胞特异性蛋白E-钙黏蛋白(E-cadherin,E-cad)和间质细胞特异性蛋白波形蛋白(Vimentin)及成纤维细胞特异性蛋白1(fibroblast-specificprotein1,FSP1)的表达,以探讨其在舌黏膜创口愈合EMT 过程中的发生及作用。
1 材料与方法
1.1 主要材料 选用健康清洁级8 周龄Wistar 大鼠48 只,体重(250±10)g,由扬州大学实验动物中心提供,动物质量合格证号:SCXK(苏)2012-0004。所有大鼠饲养在南京医科大学口腔研究所动物房,自由摄食、饮水。适应性饲养1 周后进行实验。
水合氯醛、即用型山羊血清封闭剂、3%过氧化氢液、鼠抗人单克隆Vimentin 抗体(Santa sc-32322),兔抗人多克隆 E-cad 抗体(GenTex GTX100443),兔抗人多克隆FSP1 抗体(Proteintech 16105-1-AP),FITC 标记二抗和TRITC 标记荧光二抗(美国santa cruz),DAPI、防荧光淬灭剂、冰冻切片机、激光扫描共聚焦显微镜(型号710)。
1.2 方法
1.2.1 伤口模型及切片制备 以10%的水合氯醛,按照0.3 mL/100 mg 体重行大鼠腹腔注射麻醉后,75%乙醇、碘伏消毒,使用皮肤活检打孔器于大鼠上舌前1/3 与舌中1/3 交界处中央环切一直径3 mm 切口,深达黏膜下层,中间黏膜使用尖锐器械取下,暴露创面,压迫止血[3]。实验开始后,分别于术后0、1、2、3、4 d 及创口完全愈合的第8 天以注射过量麻醉药的方法处死大鼠(每个时间点8 只),取舌部新鲜组织以OCT 包埋剂固定,冰冻切片机做5 μm连续切片,室温下晾干30 min,置冷丙酮中固定30 min,60 ℃烘箱烘片20 min。
1.2.2 组织学观察 HE 染色,光镜观察大鼠舌黏膜组织缺损伤口愈合情况。
1.2.3 间接免疫荧光检测 将上述组织切片置于PBS 摇洗5 min×3 次。置于3%过氧化氢液中,37 ℃孵育10 min,消除组织内源性过氧化物酶活性。PBS 摇洗5 min×3 次,滴加山羊血清封闭1 h,37 ℃。滴加E-cad(1 ∶1000),Vimentin(1 ∶100)和FSP1(1∶500),4 ℃过夜。次日从4 ℃取出,复温1 h,PBS摇洗5 min×3 次,滴加荧光二抗,37 ℃孵育1 h,注意避光。PBS 摇洗5 min×3 次,滴加DAPI(1∶50)室温2 min 衬染,最后滴加防荧光淬灭剂封固,并置于激光共聚焦显微镜观察拍片。
2 结 果
2.1 大体观察 术后0 d 可见舌部创口处形成血痂。术后1 ~4 d 舌黏膜创口上覆盖一层血清纤维素层,边缘变得不规整,并向伤口中心缓慢迁移;术后8 d,创面基本为上皮层覆盖,肉眼观与邻近组织无差异。
2.2 镜下观察 术后0 d,可见刚创建的伤口上皮层断裂;在术后1 d,伤口处可见大量的细胞碎片,组织下方炎性细胞浸润;术后2 ~4 d,成纤维细胞拉拢使创口面积缩小,创口边缘区上皮细胞增殖开始向中央移行;术后8 d,上皮细胞增殖明显,创面基本关闭,新生上皮层上皮钉突形态不显著,角化层未完全形成。见图1。
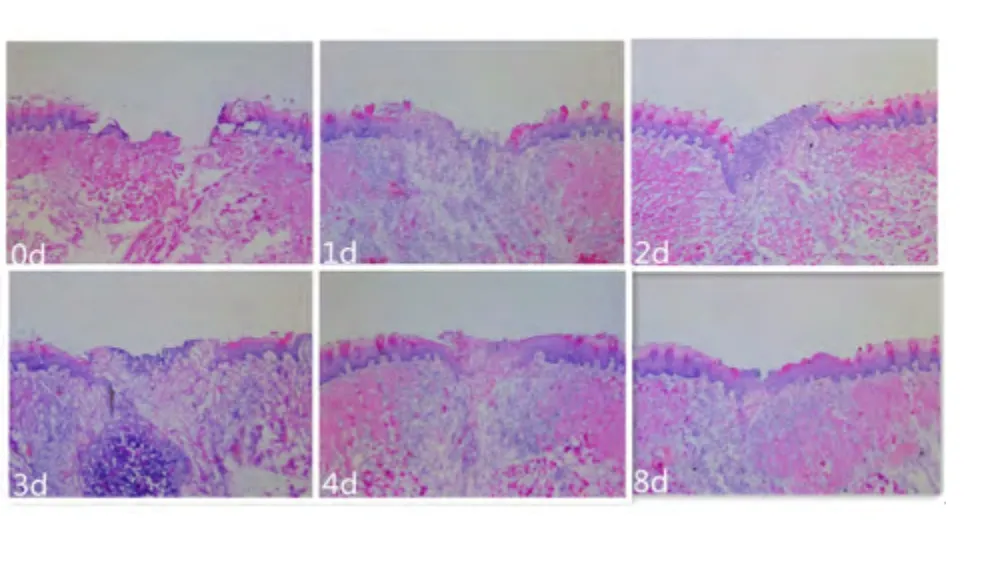
图1 镜下观察大鼠造模后伤口愈合情况(HE ×50)Figure 1 Wound healing in rats under the microscope(HE ×50)
2.3 间接免疫荧光 术后0 d,缺损边缘区舌黏膜上皮可见E-cad 呈网状表达于上皮细胞包膜,Vimentin、FSP1 广泛表达于黏膜下层,上皮钉突长且密,上皮基底层细胞呈栅栏样紧密排列。术后1 d 与0 d 相比E-cad、Vimentin、FSP1 表达未见显著差异,但术后1 d 缺损边缘区上皮钉突变短或稀疏。术后2 ~4 d,可见上皮基底层细胞E-cad 表达减少,Vimentin、FSP1 大量表达于基底层细胞,可观测到个别细胞共同表达E-cad 和Vimentin。术后8 d 大鼠创口基本愈合,上皮基底层可见零星Vimentin 和FSP1 表达。
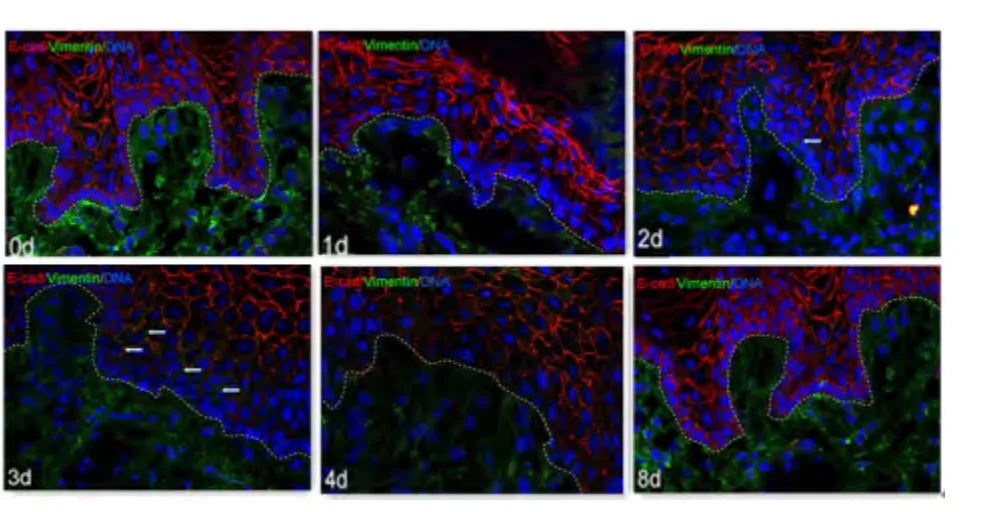
图2 镜下观察大鼠舌黏膜创口边缘区E-cad 和Vimentin的表达(×400)Figure 2 E-cad and Vimentin expressions at the edge of lingual mucosa wound in rats under the microscope(×400)
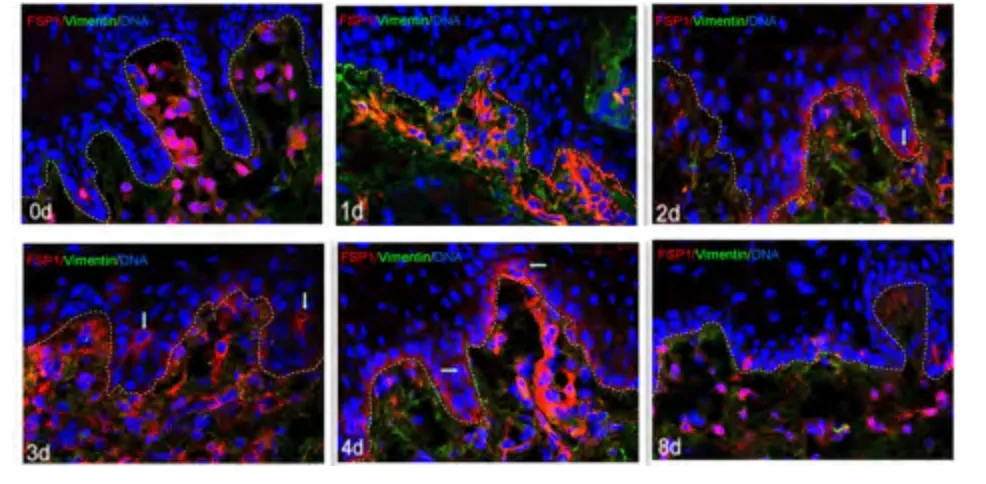
图3 镜下观察大鼠舌黏膜创口边缘区Vimentin 和FSP1的表达(×400)Figure 3 Vimentin and FSP1 expressions at the edge of lingual mucosa wound in rats under the microscope(×400)
3 讨 论
越来越多的研究证明EMT 与癌症转移、组织器官纤维化及皮肤创伤愈合密切相关,但在口腔黏膜创伤愈合放面却依然缺乏足够的佐证。高璐等[4]研究证明分化抑制因子1 通过诱导上皮间质转化促进肝癌细胞的侵袭性。研究证明EMT 在肺部和肾纤维化过程中发挥了重要作用,但无证据证明其是否与皮肤创伤愈合及纤维化相关[5-6]。对肺细支气管粘膜上皮细胞的划痕实验显示划痕区上皮细胞呈现间质细胞表型,并且划痕愈合后间质细胞表型消失[7]。Savagner 等[8]研究发现皮肤外植体在体外培养5 d 后从外植体边缘有角质形成细胞爬出,表明此时角质形成细胞具有了间质细胞的移动性。上述体外实验证明创口愈合过程中确实发生了EMT 现象。另有研究证明在不同部位的皮肤创伤中EMT细胞数目不同,在小鼠耳部皮肤创口中EMT 的数目明显低于小鼠腹部创口[9]。
本实验通过间接免疫荧光法检测EMT 相关蛋白E-cad、Vimentin、FSP1 在大鼠舌黏膜缺损区表达的变化来观察EMT 在创伤愈合过程中的发生和发展。E-cad 是细胞黏附分子钙黏蛋白家族中的一员,表达于上皮细胞胞膜,细胞质少见,它在维持细胞极性、细胞间黏附性和细胞间信息传递方面具有重要作用[10]。E-cad 表达降低是EMT 发生的重要指标[11-12]。Vimentin 是中间丝蛋白家族的重要成员,几乎表达于所有正常的间质细胞中,对维持细胞完整性和抵御外界应急的损伤起重要作用[13]。FSP1是一种钙离子结合蛋白,文献报道其与细胞支架、细胞信号传导、细胞周期调节、细胞生长和分化、细胞黏附及细胞自身运动等密切相关[14-15]。Vimentin和FSP1 如今也是公认的观测 EMT 的标志物[12,16-17]。本实验发现,在舌黏膜创伤愈合初期第1 天组织中E-cad、Vimentin 的表达与实验组0 d 未见明显差异,但在实验2 ~4 d 上皮钉突处基底层组织E-cad 表达减少,Vimentin 表达增加,并在3 d 达到高峰。另一组对FSP1 的观察结果与Vimentin 的表达变化趋势一致。提示EMT 发生于大鼠舌黏膜创口形成1 d 后,并在第3 天达到峰值,最后随着创口愈合时间延长发生EMT 的细胞数量减少直至愈合。但是本研究未能对EMT 的发生机制进行探讨。国外学者研究报道人类皮肤创伤愈合过程与肿瘤坏死因子-α 通过成骨蛋白-2 介导的EMT 相关[18]。Savagner 等[8]通过原位杂交技术分析了Snail2 在伤口愈合过程中的表达,在小鼠体内毗邻创口区皮肤的角化细胞中、在体外培养的从小鼠皮肤组织获取的上皮外植体中及体外培养的小鼠创口边缘区角化细胞中其表达都升高。Snail2 缺陷小鼠的皮肤外植体培养得到上皮细胞明显少于正常鼠。此外,Snail2高表达的角质细胞其细胞扩散和桥粒破坏现象明显,提示其在EMT 和伤口愈合过程中发挥了重要作用[19]。在N-乙酰葡糖胺基转移酶Ⅴ转基因小鼠中其皮肤创口愈合过程中EMT 现象增加,创口愈合速度加快,提示N-乙酰葡糖胺基转移酶Ⅴ与EMT介导的皮肤创口愈合有关[20]。
创伤修复是个复杂的过程,它与表皮细胞、真皮层及免疫系统密切相关[21]。创口愈合过程可分为2个独立的细胞机制:①角化细胞驱动的再上皮化过程,通过减少角化细胞间的胞件连接促进细胞移动到创伤部位。②通过成纤维细胞收缩拉拢缩小创伤面积[22]。EMT 过程与角化细胞驱动再上皮化密切相关。本实验证明在大鼠舌黏膜创口形成1 d 后发生EMT 现象,因此我们认为促进EMT 早期的发生和发展有利于黏膜创伤的愈合。有研究证明Snail2 mRNA表达水平增加可以加快创口愈合速度[23]。目前常用的促溃疡愈合药物主要由外源性生长因子构成,其机制较为单一主要是促进创口区新生血管,加速愈合[24]。于是已经有学者试图通过EMT 过程的研究以寻求采用外源性生长因子以外发的方式来促进或者协同外源性生长因子促进黏膜创伤的修复。
口腔溃疡是口腔科常见疾病,最新流行病学研究调查了1192 名平均年龄55.6 岁的上海居民,其复发性阿弗他溃疡患病率为1.48%,创伤性溃疡患病率高达1.13%[25]。本实验初步尝试通过观察大鼠舌黏膜创口愈合过程中的EMT 现象为寻找促进黏膜溃疡愈合提供新的思路,但实验未对EMT 在创口愈合过程中的发生机制及其影响因素进行研究,这将是我们下一步研究的主要方向。
[1] Kalluri R,Neilson EG.Epithelial-mesenchymal transition and its implications for fibrosis[J].J Clin Invest,2003,112(12):1776-1784.
[2] 黄晓丹,季国忠.上皮-间质转化在肿瘤侵袭转移中作用的研究进展[J].医学研究生学报,2010,23(3):319-322.
[3] 苗明三,徐玉茵,刘会丽.口腔溃疡动物模型研究进展[J].中医药学刊,2006,24(9):1636-1637.
[4] 高 璐,吕 刚,孙 凯,等.分化抑制因子1 通过诱导上皮间质转化促进肝癌HepG2 细胞的侵袭性[J].医学研究生学报,2013,26(12):1254-1257.
[5] Willis BC,Borok Z.TGF-beta-induced EMT:mechanisms and impli-cations for fibrotic lung disease[J].Am J Physiol Lung Cell Mol Physiol,2007,293:L525-L534.
[6] Yang J,Liu Y.Dissection of key events in tubular epithelial to myofi-broblast transition and its implications in renal interstitial fibrosis[J].Am J Pathol,2001,159:1465-1475.
[7] Borthwick LA,McIlroy EI,Gorowiec MR,et al.Inflammation and epithelial to mesenchymal transition in lung transplant recipients:role in dysregulated epithelial wound repair[J].Am J Transplant,2010,10(3):498-509.
[8] Savagner P,Kusewitt DF,Carver EA,et al.Developmental transcription factor slug is required for effective re-epithelialization by adult keratinocytes[J].J Cell Physiol,2005,202(3):858-866.
[9] Yin SY,Peng AP,Huang LT,et al.The phytochemical shikonin stimulates epithelial-mesenchymal transition (EMT)in skin wound healing[J].Evid Based Complement Alternat Med,2013,2013:262796.
[10] Schmaltlofcr O,Brabletz S,Brabletz T.E-cadherin,beta-catenin,and ZEBl in malignant progression ofcancer[J].Cancer Metastasis Rev,2009,28:151-166.
[11] Zavadil J,Bottinger EP.TGF-beta and epithelial-to-mesenchy mal transitions[J].Oncogene,2005,24(37):5764-5774.
[12] Kong W,Li S,Liu C.Epithelial-mesenchymal transition occurs after epidermal development in mouse skin.[J].Exp Cell Res,2006,15,312(19):3959-3968.
[13] Satelli A,Li S.Vimemitin in cancer and its potential as a molecular target for cancer therapy[J].Cell Mol Life Sci,2011,68:3033-3046.
[14] Taylor S,Herdngtoa S,Prim W,et al.S100A4(p9Ka)proteinin coIon carcinoma and liver metastasis:association with carcinoma cells and T-lymphocytes[J].Br J Cancer,2002,86:409-416.
[15] Sherbet GV,Lakshmi MS.S100A4(MTSI)calcium binding protein in cancer growth[J].Inva Metas,1998,18(4A):2415-2421.
[16] Le M,Hir I,Hegyi D,et al.Kaissling,Characte rization of renal interstitial fibroblast-s pecific protein 1/S100A4-positi ve cells in healthy and inflamed rodent kidneys[J].Histochem Cell Biol,2005,123(4-5):335-346.
[17] Iwano M,Plieth D,Danoff TM.Evidence that fibroblasts derive from epithelium during tissue fibrosis[J].J Clin Invest,2002,110(3):341-350.
[18] Yan C,Grimm WA,Garner WL,et al.Epithelial to mesenchymal transition in human skin wound healing is induced by tumor necrosis factor-alpha through bone morphogenic protein-2[J].Am J Pathol,2010,176(5):2247-2258.
[19] Savagner P,Kusewitt DF,Carver EA,et al.Developmental transcription factor Slug is required for effective re-epitheli-alization by adult keratinocytes[J].J Cell Physiol,2005,202:858-866.
[20] Terao M,Ishikawa A,Nakahara S,et al.Enhanced epithelialmesenchymal transition-like phenotype in N-acetylglucosaminyltransferase V transgenic mouse skin promotes wound healing[J].J Biol Chem,2011,286(32):28303-28311.
[21] 柯 俊,戚荣丰,卢光明.创伤后应激障碍脑结构磁共振成像研究进展[J].医学研究生学报,2014,27(11):1219-1222.
[22] Coulombe PA.Wound epithelialization:accelerating the pace of discovery[J].J Invest Dermatol,2003,121(2):219-230.
[23] Arnoux V,Nassour M,L'Helgoualc'h A,et al.Erk5 controls Slug expression and keratinocyte activation during wound healing[J].Mol Biol Cell,2008,19(11):4738-4749.
[24] 屈纪富,郝 利,孙 薇,等.细胞因子在创伤愈合过程中的变化及其意义的研究进展[J].创伤外科杂志,2003,5(1):74-76.
[25] Feng J,Zhou Z,Shen X,et al.Prevalence and distribution of oral mucosal lesions:a cross-sectional study in Shanghai,China[J].J Oral Pathol Med,2014,22:12264.
