不同浓度葡萄糖对脂肪细胞因子mRNA表达的影响*
2015-05-05西安市中心医院内分泌科西安710003
西安市中心医院内分泌科(西安 710003)
王丽萍 刘晓霞 武金娥▲ 周 鑫▲ 刘 萍Δ
不同浓度葡萄糖对脂肪细胞因子mRNA表达的影响*
西安市中心医院内分泌科(西安 710003)
王丽萍 刘晓霞 武金娥▲周 鑫▲刘 萍Δ
目的:研究不同浓度葡萄糖对脂肪细胞因子表达的影响。方法:对体外培养、诱导小鼠3T3-L1细胞,分别给予25mmol/L、40mmol/L及70mmol/L浓度的葡萄糖作用24h,提取细胞RNA,通过反转录实时荧光定量聚合酶链反应(RT-qPCR),检测脂肪细胞因子Vaspin、IL-6及脂联素(Adiponectin,APN)mRNA表达情况。结果:随葡萄糖浓度的增高,Vaspin、IL-6 mRNA的表达增高,APNmRNA的表达减低。结论:培养液中葡萄糖浓度的变化是影响脂肪细胞Vaspin、IL-6及APNmRNA表达的因素。
多种脂肪因子在2型糖尿病的发病机制中所起的作用越来越受到关注。本研究通过对3T3-L1细胞予以不同浓度葡萄糖培养,了解葡萄糖对脂肪细胞因子表达的影响。
材料和方法
1 材 料
1.1 细胞株:3T3-L1脂肪前体细胞由中国医学科学院基础医学研究所北京协和医学院细胞资源中心提供。
1.2 试剂:DMEM培养基(购自GIBCO公司),胎牛血清(购自杭州四季青生物制品公司),3-异丁基-1-甲基黄嘌呤(3-isobutal-1-methylxan-thine,购自Sigma公司),胰岛素(Insulin,购自Sigma公司),Trizol(购自Gibco BRL公司),Prime Script RT reagent Kit(大连宝生物工程),SYBR®Premix Ex TaqTMII(大连宝生物工程)。
1.3 仪器:CO2细胞孵育箱(购自Thermo Scientific),倒置显微镜XD-202(购自江南光学仪器厂),CFX96荧光定量PCR仪(购自美国Biorad公司)。
2 方 法
2.1 细胞培养: 用DMEM高糖培养基(含10%胎牛血清)培养3T3-L1前脂肪细胞,置于37℃、5%二氧化碳(CO2)、饱和湿度孵箱中孵育。待细胞状态良好时按一定密度接种于六孔细胞培养板中。细胞融合2d后,再给予0.5mmol/L 3-异丁基-1-甲基黄嘌呤、1mg/L胰岛素、0.25μmol/L地塞米松及DMEM高糖培养基(含10%胎牛血清)继续培养48h,继而换用含1mg/L Insulin的培养基中再培养48h,随后再用DMEM高糖培养基(含10%胎牛血清)继续培养,培养液每2d换1次。诱导分化8~10d,当3T3-L1细胞90%以上呈现脂肪细胞表型时,给予不同浓度葡萄糖作用24h,Trizol法提取RNA。
2.2 细胞鉴定: 诱导前后使用油红O染色鉴定,证明是成熟脂肪细胞(油红O是一种可以特异地和细胞内三酰甘油结合的红色染料,与未分化细胞和细胞外脂质不结合)。吸弃培养板里的分化培养基;1×PBS冲洗细胞2次或3次;加入10%的甲醛磷酸盐缓冲液4 ml/孔,室温固定1 h;吸弃固定液;加入油红O溶液,室温染色3 h;吸弃染色剂;无菌三蒸水冲洗2次,洗去未着色染料;显微镜下观察,照相。
2.3 反转录实时荧光定量聚合酶链反应(RT-qPCR)通过检测反应液中 SYBR Green I 的荧光强度,达到监控 PCR 产物扩增量的目的。SYBR®Green I与双链DNA结合后发出荧光,所以可以通过检测反应体系中的SYBRTMGreen I荧光强度,达到检测PCR产物扩增量的目的。Vaspin上游引物序列:5'-CTT CCT ATC CCC ACT GAG-3' ,下游引物序列:5'-CTT TGT GTC CTC CGT CTC-3' ;APN上游引物序列:5'-GCA GAG ATG GCA CTC CTG GA -3' ,下游引物序列:5'-CAG GGA AGC CTC TTT CTC CT-3' ;IL-6上游引物序列:5'-AGC CAG AGTCCT TCA GAG -3',下游引物序列5'-GTC CTT AGC CAC TCC TTC-3'; 内参为甘油醛-3-磷酸脱氢酶( glyceraldehyde-3-phosphate dehydrogenase,gapdh )上游序列5'-GCT GAG TAT GTC GTG GAG T -3' ,下游引物序列 5'-GTT CAC ACC CAT CAC AAA C -3' 。
2.4 统计学方法:采用SPSS l6.0统计学软件,计量资料比较采用t检验,数据以Mean±sd表示。P<0.05为差异有统计学意义。
结 果
1 成功诱导分化成熟脂肪细胞(图1)。
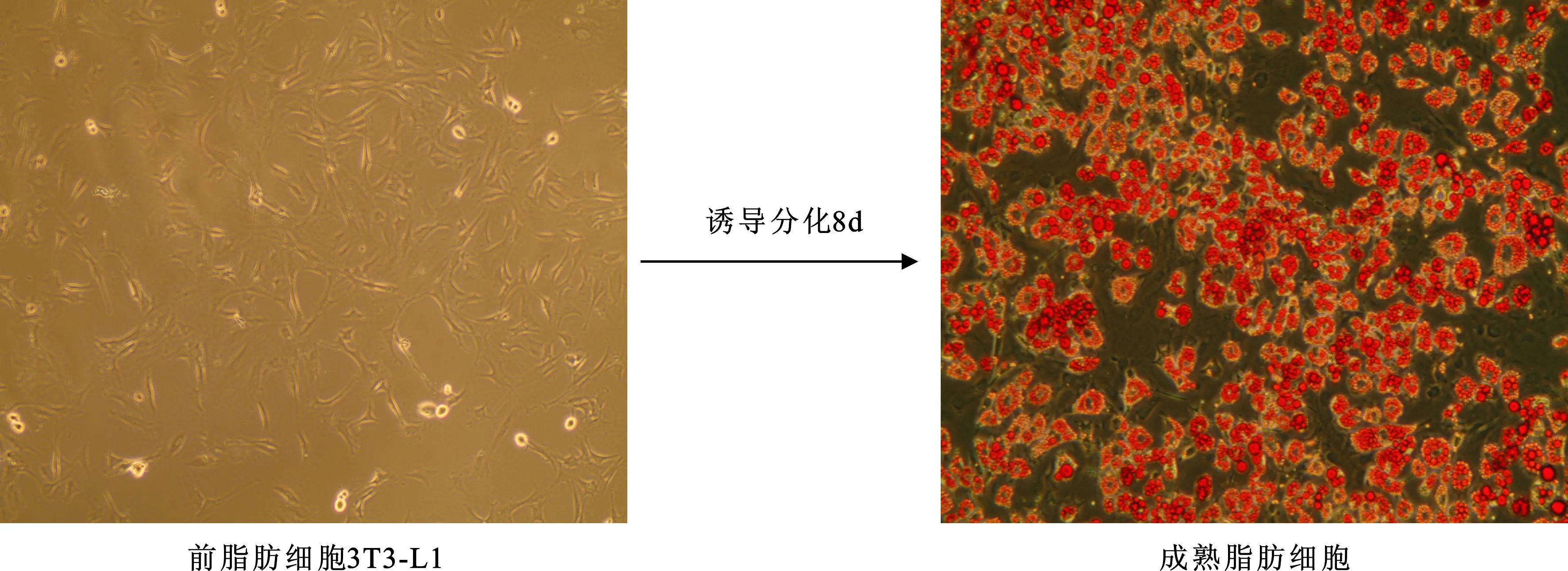
图1 诱导分化3T3-L1细胞
2 各组脂肪因子表达情况: 25mmol/L、40mmol/L、及70mmol/L葡萄糖作用3T3-L1细胞24h,Vaspin/gapdh比值分别为1.27±0.26、2.29±0.16及3.00±0.52,IL-6/gapdh比值分别为1.07±0.06、1.58±0.11及2.27±0.11,APN/gapdh比值分别为1.17±0.16、0.61±0.04及0.42±0.04。随着培养液中的葡萄糖浓度的增加,脂肪细胞Vaspin及IL-6 mRNA的表达升高,APN mRNA的表达减低,除Vaspin/gapdh比值在40mmol/L及70mmol/L组间比较差异无统计学意义外(P>0.05),其余组间均具有统计学差异(P<0.01)(图2)。
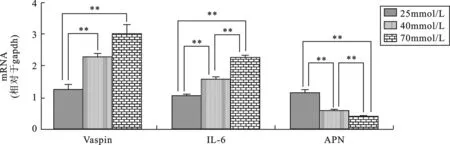
图2 不同浓度葡萄糖对脂肪细胞因子Vaspin、IL-6及APN mRNA表达的影响(**P<0.01) 讨 论
目前认为,脂肪组织除了是脂肪存储和代谢的场所外,还是一个重要的内分泌器官。脂肪组织能释放多种细胞因子,对机体的糖代谢、脂代谢及能量代谢起着重要的调控作用。这些脂肪细胞因子通过多种途径影响胰岛素的生物学效应,参与胰岛素抵抗(IR)。因此,在2型糖尿病、代谢综合征(MS)及肥胖的发生、发展及发病机制中起着重要作用。
脂联素(Adiponectin ,APN)是脂肪组织特异性分泌的脂肪细胞因子。研究显示,血浆APN浓度与高血糖、高胰岛素血症及胰岛素抵抗呈负性相关。多元线性回归模型研究结果显示,与APN相关的众多因素中,腰臀比(WHR)、M-rate(胰岛素刺激葡萄糖摄取率)和空腹胰岛素水平是血浆APN的独立影响因素[1]。因此可以看出,与血糖、体脂含量比较,胰岛素的敏感性及空腹胰岛素浓度与血浆APN的关系则更为密切。俞利红[2]研究显示葡萄糖浓度变化不是影响3T3-L1细胞APN mRNA表达的主要因素。本研究显示随着不同浓度葡萄糖作用3T3-L1细胞24h,APN mRNA的表达呈递减,且各浓度间均有统计学差异。因此,血糖是否直接影响APN仍有待进一步研究。
IL-6是具有多种生物活性的细胞因子,它是由人IL-6基因所编码的一种生物活性的糖蛋白。IL-6主要是由单核-巨噬细胞、T淋巴细胞和纤维母细胞合成,脂肪和肌肉组织能产生少量IL-6。IL-6与内分泌激素、神经递质及某些效应物质等组成重要的网络系统,参与机体的各种病理生理过程,尤其广泛而精细地调节胰岛β细胞的分化、生长和分泌功能[3]。高血糖促进IL-6的生成,且IL-6的浓度与血糖浓度呈正相关。抗氧化剂谷胱甘肽阻止高血糖诱发的血浆细胞因子的升高,说明炎性因子的释放可能与高血糖诱发的氧化应激有关[4]。
Vaspin是一种脂肪细胞因子,由Hida等利用差异筛选基因方法,在腹型肥胖2型糖尿病动物模型OLETF大鼠的内脏脂肪组织中分离到一种新基因OL-64[5],属于丝氨酸蛋白酶抑制剂家族成员,具有胰岛素增敏作用。研究发现Vaspin表达受多种因素的影响,如性别、年龄、饮食、运动,药物及激素等。并与肥胖、2型糖尿病、多囊卵巢综合征、心血管疾病和非酒精性脂肪肝等疾病有密切的关系。Tan等[6]研究发现,人体网膜脂肪组织Vaspin mRNA 表达和血清Vaspin水平均与血糖水平呈显著正相关。Gulcelik NE等[7]发现在糖尿病患者中,血清Vaspin水平与HbA1c正相关,与胰岛素水平负相关。本研究显示Vaspin的表达随葡萄糖浓度的升高而升高,但更高浓度的葡萄糖70mmol/L与40mmol/L间无统计学差异,提示在一定范围内,血糖的升高可以促进Vaspin表达。
[1] Mathias F,Johannes K,Susanne N,etal.Adiponectin gene expresion is inhibited by B-adrenergic stimulation via protein Kinase A in 3T3-L1 adipocyte[J].FEBS Letters,2001,507:142.
[2] 俞利红,谷 卫. 不同葡萄糖浓度对3T3-L1细胞脂联素mRNA表达的影响[J].浙江医学,2005,27(12):901-903.
[3] Miesinger M Y,Serge H,Stefan W,etal. Development of an IL-6 inhibitor based on the functional analysis of murine IL-6 Ra[J].Chem and Biol,2009,16(7):783-794.
[4] Goyal R,Singhai M,Faizy A F. Glutathione peroxidase activity in obese and nonobese diabetic patients and role of hyperglycemia in oxidative stress[J]. Midlife Health,2011,2(2):72-76.
[5] Hida K, Wada J , Zhang H ,etal. Identification of genes specifically expressed in the accumulated visceral adipose tissue of OLETF rats[J]. J Lipid Res , 2000 , 41 : 1615-1622.
[6] Tan BK, Heutling D, Chen J,etal. Metformin decreases the adipokine vaspin in overweight women with polycystic ovary syndrome concomitant with improvement in insulin sensitivity and a decrease in insulin resistance[J]. Diabetes,2008,57: 1501-1507.
[7] Gulcelik NE, Karakaya J, Gedik A,etal. Serum vaspin levels in type 2 diabetic women in relation to microvascular complications[J].Eur J Endocrinol,2009,160:65-70.
(收稿:2014-12-02)
*陕西省自然科学基础研究计划资助项目(2013JM4048)
葡萄糖浓度 3T3-L1细胞 Vaspin IL-1 脂联素
R363.2
A
10.3969/j.issn.1000-7377.2015.03.006
▲西安交通大学医学院第一附属医院心内科
△通讯作者
