白桦脂酸联合沙利度胺诱导U266 细胞凋亡机制研究*
2015-04-28孙嘉,马丹,王萍,方琴
孙 嘉,马 丹,王 萍,方 琴
(1.贵州医科大学,贵州 贵阳 550004;2.贵州医科大学附院 血液科,贵州 贵阳 550004;3.贵州医科大学附属白云医院 药剂科,贵州贵阳 550014)
多发性骨髓瘤(multiple myeloma,MM)是目前一种仍不能治愈的以浆细胞恶性增殖为特征的疾病[1],临床上多采用环磷酰胺、沙利度胺等药物诱导化疗[2-3]。白桦脂酸(betulinic acid,BA)是从白桦树树皮中提取的一种天然化合物,有抑菌、调血脂及抗疟疾等药理活性[4-5]。研究表明,白桦脂酸作用于脑瘤、骨髓瘤等恶性淋巴肿瘤细胞后,对肿瘤细胞具有明显的抑制作用[6]。近年来,开发毒副作用低、能长期性和西药合用治疗MM 中药已成为研究的新热点[7]。本课题主要以MM 为切入点,以MM 的U266 细胞为研究对象,探讨白桦脂酸联合沙利度胺促进U266 细胞凋亡及其机制。
1 材料和方法
1.1 材料
人MMU266 细胞房获赠于湘雅医学院附属第二医院血科。白桦脂酸购自Alexis 公司,沙利度胺购自美国Sigma life secience 公司,RPMI-1640 培养基和胎牛血清均购自Gibco 公司,β-actin、Survivin、Bcl-2、Bax、Cyto-c 单克隆抗体均购自北京博奥森生物技术有限公司,AxyPrep Multisource Genomic RNA Miniprep KIT 购自美国AxyPrep 公司,Prime-ScriptTMRT reagent KIT 购自日本TaKaRa 公司,SYBR Premix Ex TapTM实时荧光定量PCR 试剂购自日本TaKaRa 公司)。
1.2 方法
1.2.1 细胞培养 U266 细胞接种于含15%的RPMI-1640 培养基中,于5%CO2,37 ℃的培养箱中培养,隔天换液,取对数生长期细胞进行相关实验。
1.2.2 试剂溶液的配制 用电子天平精密分别称取白桦脂酸和沙利度胺,分别溶解于二甲基亚砜(DMSO)中配制成5 g/L 原液,分装备用,4 ℃保存。实验时分别用含血清RPMI-1640 培养基逐级稀释即得各给药浓度。
1.2.3 U266 细胞增殖抑制率 U266 细胞株按5×103个/孔接种于96/板,在37 ℃,5%CO2条件下培养,用白桦脂酸(20、40、60 和80 mg/L)、沙利度胺(10、50 和100 mg/L)及白桦脂酸(40 mg/L)联合沙利度胺(10、50 和100 mg/L)分别处理,分别为白桦脂酸组、沙利度胺组和联合组,每种浓度设5个复孔,同时设对照组(不做任何处理),置37 ℃、CO2体积分数为5%的饱和湿度培养箱分别培养适宜时间(白桦脂酸组24、48 和72 h,沙利度胺组和联合组48 h),然后每孔加入MTT 溶液(5 g/L)10 μL,继续温育4 h,终止培养,弃孔内上清液,每孔加入DMSO150 μL,震荡10 min,使结晶充分溶解,并用酶联免疫检测仪在490 nm 波长处检测各孔的吸光度(A)值,计算细胞增殖抑制率。细胞增殖抑制率(%)=(对照组A 值-实验组A 值)/对照组A 值×100%。根据增殖抑制率和浓度计算出IC50值,IC50=lg-1[Xm-i(ΣP-0.5)],求得最适浓度。
1.2.4 流式细胞术法检测细胞凋亡率 取对数生长期U266 细胞4×104/mL,接种于6 孔板,每孔接种量2.5 mL,分别用沙利度胺(10 mg/L、50 mg/L、100 mg/L)或与白桦脂酸联合处理48 h,用PBS 洗涤细胞1 次,1 500 r/min 离心5min,调整细胞浓度为1×106,制备的单细胞悬液用70%乙醇固定,4 ℃保存;染色前用PBS 洗去固定液,加RNase A100 μL 于37 ℃水浴30 min。加入PI 染色液400 μL 混匀,4 ℃避光30 min,上流式细胞仪检测U266 细胞凋亡情况。
1.2.5 U266 中Survivin、Cyto-C、Bcl-2、Bax mRNA检测 分别取对照组、白桦脂酸(40 mg/L)、沙利度胺(50 mg/L)以及联合组(40 mg/L 白桦脂酸联合50mg/L 沙利度胺)U266 细胞,用AxyPrep Multisource Genomic RNA Miniprep KIT 试剂盒提取细胞总RNA;按PrimeScriptTMRT reagent KIT 和SYBR Premix Ex TapTM实时荧光定量PCR 试剂盒说明书分别进行cDNA 的合成和RT-PCR 反应。Survivin上游引物5'-TTGGCAGGTGCCTGTTGAAT-3',下游引物5'-AGCCACTCCCCCACAGC A-3'。Bcl-2 上游引物5'-TGTGCCTGTAAACATAGATTGGC-3,下游引物5'-CTTCCAGACATCGCACACCA-3'。Bax 上游引物5'-CCAAGAAGAAGCTGAGCGAGTCTC-3',下游引物5'-TGAGGACTCCAGCCACAAAGA-3'。Cyto-C 上游引物5'-GCCCGGAACGAATTAAAAAT-3',下游引物5'-TGCCTCCCTTTTCCACAGT-3'。β-actin 上游引物5'-GACAAGGGCTCCGGCATGTG-3,下游引物5'-TGAGGATGCCTCTCTTGCTC-3'。
1.2.6 Survivin、Cyto-C、Bcl-2、Bax 蛋白检测 分别取对照组、白桦脂酸(40 mg/L)组、沙利度胺(50 mg/L)及联合组(40 mg/L 白桦脂酸联合50 mg/L沙利度胺)U266 细胞,加入细胞裂解液的样本冰上孵育30 min,超声粉碎仪进行超声粉碎。4 ℃12 000 r/min 离心20 min,取少量以Bradford法测定蛋白浓度。取25 μg 蛋白经12%SDS-聚丙烯酰胺凝胶电泳分离,电转移至PVDF 膜上,PVDF 膜经封闭液室温封阻1 h,加入一抗4 ℃摇床过夜,用辣根过氧化物酶标记的二抗检测蛋白表达。β-actin 作为内参,Western blotting 检测Survivin、Cyto-C、Bcl-2、Bax 蛋白的表达。
1.3 统计学方法
所得数据采用SPSS 17.0 统计软件处理,组间比较采用单因素方差分析,P <0.05 为差异具有统计学意义。
2 结果
2.1 不同浓度白桦脂酸对U266 细胞的增殖抑制率的影响
U266 细胞经白桦脂酸处理24、48 和72 h 后,在相同时间下,随着作用浓度的增加,白桦脂酸U266 细胞增殖抑制率增加,差异有统计学意义(P <0.05);白桦脂酸对U266 细胞的IC50值24、48、72 h 分别为((76.27±1.83)mg/L、(42.81±2.18)mg/L、(29.64±2.53)mg/L。根据IC50得出,白桦脂酸作用于多发性骨髓瘤U266 细胞最适浓度为40 mg/L。见图1。
2.2 沙利度胺组与联合组对U266 细胞增殖抑制率的影响
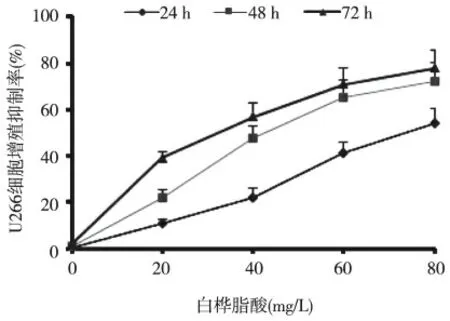
图1 不同浓度白桦脂酸对U266 细胞增殖抑制率的影响(MTT)Fig.1 The effect of BA at different concentrations on proliferation inhibition rate of U266 cells
与沙利度胺组相比,联合组U266 细胞的增殖抑制率明显升高(P <0.05);随着沙利度胺浓度增加,两组U266 细胞的增殖抑制率均明显升高(P <0.05);沙利度胺组和联合组的IC50值分别为(52.02±2.34)mg/L、(26.19±3.21)mg/L,联合白桦脂酸用药可以明显抑制U266 细胞的增殖(P <0.05)。根据IC50值得出,沙利度胺作用U266细胞最适浓度为50 mg/L。见图2。
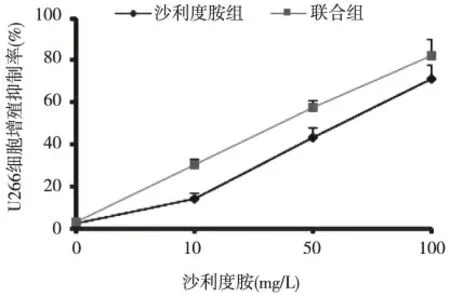
图2 沙利度胺组与联合组中U266 细胞增殖抑制率(MTT)Fig.2 The effects of halidomide single or combined with betulinic acid on proliferation inhibition rate of U266 cells
2.3 沙利度胺组与联合组对U266 细胞凋亡的影响
用沙利度胺、沙利度胺联合白桦脂酸分别处理U266 细胞48 h,与沙利度胺组比较,联合组U266细胞的凋亡率更高,差异具有统计学意义(P <0.05)。见表1。
2.4 Survivin、Cyto-C、Bcl-2、Bax mRNA 的表达
与沙利度胺组或白桦脂酸组相比,联合组U266 细胞中Survivin、Bcl-2 mRNA 的表达明显降低,Cyto-C 和Bax mRNA 表达明显升高,差异具有统计学意义(P <0.05)。见图3。

表1 沙利度胺组与联合组U266 细胞的凋亡率(%)Tab.1 The apoptosis rate of U266 cells in thalidomide group and combination group
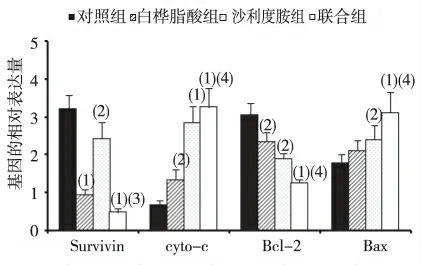
图3 4 组U266 细胞中Survivin、Cyto-C、Bcl-2、Bax mRNA 的表达Fig.3 Expression levels of Survivin,Cyto-C,Bcl-2,Bax mRNA of U266 cells in the 4 groups
2.5 Survivin、Cyto-C、Bcl-2、Bax 蛋白质水平
与沙利度胺、白桦脂酸组相比,联合组U266细胞中Survivin、Bcl-2 蛋白表达明显降低,Cyto-C和Bax 蛋白表达明显升高,差异具有统计学意义(P <0.05)。见图4。
3 讨论
多发性骨髓瘤是骨髓浆细胞恶性疾病,主要以骨髓中浆细胞恶性增殖并引起相关器官或组织损害为表现[8]。多发性骨髓瘤患者一般常常伴有高钙血症,贫血,肾功能严重损伤等多种并发症,由于多发性骨髓瘤能抑制人体正常免疫球蛋白的增殖而导致各种细菌性感染频发[9]。临床研究表明,临床治疗多发性骨髓瘤得化疗方案多以硼替佐米或来那度胺联合马法兰等药物治疗[10-13],但化疗存在药物耐受性差、不良反应多等缺点而不能达到很好的治疗效果。目前,多发性骨髓瘤仍难治、易复发[14-17]。
本实验探讨白桦脂酸联合沙利度胺是否可以促进多发性骨髓瘤U266 细胞凋亡,采用不同浓度的白桦脂酸处理多发性骨髓瘤U266 细胞,白桦脂酸可以抑制U266 细胞的增殖,并随着白桦脂酸浓度的升高,增殖抑制率升高,说明白桦脂酸在多发性骨髓瘤细胞中发挥了重要作用,白桦脂酸可以促进U266 细胞凋亡,进而使多发性骨髓瘤疾病有所改善。本实验还将白桦脂酸联合沙利度胺共同作用于多发性骨髓瘤U266 细胞,观察细胞增殖抑制率及凋亡率,与单独用药相比,联合用药可明显抑制U266 细胞增殖,并促进其凋亡,提示白桦脂酸与沙利度胺联合用药可用于治疗多发性骨髓瘤可以起到一定效果,可以成为今后临床研究的一个新靶点。
凋亡的调控是细胞生理死亡和肿瘤发生的重要的发生机制,一些凋亡调控因子在多发性骨髓瘤疾病中发挥了重要作用。本研究检测U266 细胞中凋亡家族相关基因和蛋白,发现如果白桦脂酸联合沙利度胺共同处理多发性骨髓瘤U266 细胞之后,Survivin、Bcl-2 的表达与单独用白桦脂酸或沙利度胺显著降低,白桦脂酸联合沙利度胺可明显下调Survivin、Bcl-2 表达,而激活Cyto-c、Bax 表达,从而促进肿瘤细胞凋亡,为多发性骨髓瘤的临床研究提供了新的实验依据。
综上所述,本研究结果显示,白桦脂酸联合沙利度胺用药可以抑制骨髓瘤U266 细胞的生长,并促进其凋亡,联合用药可能成为临床治疗多发性骨髓瘤的信策略。然而,在未来的研究中,我们将需要更多的体内实验以探讨联合应用白桦脂酸的有效性和对多发性骨髓瘤治疗的作用机制。
[1]Jasielec JK,Jakubowiak AJ.Current approaches to the initial treatment of symptomatic multiple myeloma[J].Int J Hematol Oncol,2013(1):133-139.
[2]Durie BG.Role of new treatment approaches in defining treatment goals in multiple myeloma the ultimate goal is extended survival[J].Cancer Treat Rev,2010(36):18-23.
[3]Berenson JR,Yellin O,Bessudo A,et al.Phase I/II trial assessing bendamustine bortezomib combination therapy for the treat.ment of patients with relapsed or refractory multiple myeloma[J].Br J Haematol,2013(3):321-330.
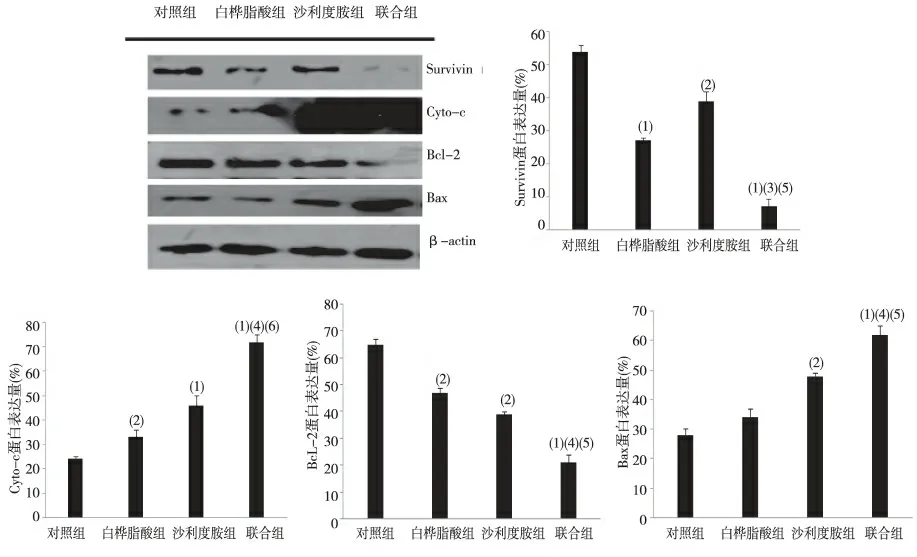
图4 4 组U266 细胞中Survivin、Cyto-C、Bcl-2、Bax 蛋白的表达Fig.4 Expression levels of Survivin,Cyto-C,Bcl-2,Bax mRNA of U266 cells in the 4 groups
[4]Mukherjee R,Kumar V,Srivastava SK,et al.Betulinic add derivatives as anticancer agents:structure activity relationship[J].Anticancer Agents Med Chem,2006(6):271-279.
[5]Yogeeswari P,Sriram D.Betulinic acid and its derivatives:a review on their biological properties[J].Curr Med Chem,2005(6):657-666.
[6]Kikuchi T,Akazawa H,Tabata K,et al.3-O-(E)-p-coumaroyl tormentic acid from eriobotrya japonica leaves induces caspase-dependent apoptotic cell death in human leukemia cell line[J].Chem Pharm Bull,2011(3):378-381.
[7]Morgan GL,Davies FE,Gregory wM,et al.Firstline treatment with zoledronie acid as compared with clodronic acid in multiple myeloma(MRC Myeloma IX):a randomised controHed trial[J].Lancet,2010(9757):744-751.
[8]Durie BG,Harousseau JL,Miguel JS,et al.International uniform response criteria for multiple myeloma[J].Leukemia,2006(9):1467-1473.
[9]Koren J,Spicka I,Straub J,et al.Retrospective analysis of there sults of high-dose chemotherapy with the support of autologous blood stem eeus in patients with multiple myeloma.The expe-Hence of a single centre[J].PragueMedRep,2010(3):207-218.
[10]杨励,蔡真.多发性骨髓瘤的维持治疗[J].中华血液学杂志,2013(4):295-297.
[11]Merchionne F,Perosa F,Dammacco F.New therapies in multiplemyeloma[J].Chn Exp Med,2007(7):83-97.
[12]王岩,黄仲夏.硼替佐米基础化疗方案治疗初治合并肾功能不全的多发性骨髓瘤患者的进展[J].国际输血及血液学杂志,2011(34):335-337.
[13]Chanan K,Kaufan JL,Mehta J,et al.Activity and safety of bortezomib in multiple myeloma patients with advanced renal failure:A multicenter retrospective study[J].Blood,2007(109):2604-2606.
[14]王丽娟,宋娟.复发性与难治性多发性骨髓瘤的治疗进展[J].国际输血及血液学杂志,2011(34):517-522.
[15]王小山,陈钰.多发性骨髓瘤治疗进展[J].国际输血及血液学杂志,2011(34):349-531.
[16]陈协群.多发性骨髓瘤生物学研究与新药靶向治疗[J].中华血液学杂志,2013(4):288-289.
[17]Morgan G.Future drug developments in multiple myeloma:anoverview of novel lenalidomide-based combination therapies[J].Blood Rev,2010(1):27-32.
