宁夏特色苦豆子生物碱提取及质量控制方法探讨
2015-04-26张喻娟唐宜轩王鹏飞邹文铨
张喻娟,韩 丽*,唐宜轩,王鹏飞,王 鑫,邹文铨
(1.成都中医药大学 药学院 中药材标准化教育部重点实验室 四川省中药资源系统研究与开发利用重点实验室-省部共建国家重点实验室培育基地,四川 成都 611137; 2.四川大学,四川 成都 610064)
宁夏特色苦豆子生物碱提取及质量控制方法探讨
张喻娟1,韩 丽1*,唐宜轩1,王鹏飞1,王 鑫1,邹文铨2
(1.成都中医药大学 药学院 中药材标准化教育部重点实验室 四川省中药资源系统研究与开发利用重点实验室-省部共建国家重点实验室培育基地,四川 成都 611137; 2.四川大学,四川 成都 610064)
目的:综述宁夏苦豆子的化学成分、提取技术及质量控制等方面最新的研究成果。方法:查阅国内相关文献,对苦豆子生物碱类的提取技术和质量控制方法进行分析和归纳。结果与结论:阐述总结新型提取技术如超声、微波、酶法等在苦豆子生物碱提取上的应用和以气相色谱法、毛细管电泳法为主的质量控制方法;为宁夏苦豆子研究、药材质量评价、资源的可持续利用提供了方向和思路。
苦豆子;宁夏;生物碱提取;质量控制
苦豆子(SophoraalopecuroidesL.)为豆科槐属草本植物苦豆子的种子,其性味苦、寒、有毒,入心、肺二经;具有清热燥湿、杀虫止痛之功效,用于治疗疮疖、痢疾、湿疹等病症[1]。苦豆子凭借显著的药效在临床应用广泛,且在农业、食品及生态领域亦有极高的应用价值。作为颇具西北特色的中药,宁夏苦豆子主要用于加工生产苦参碱类原料。大量研究证实提取方法是工艺的关键,而质量控制方法是评价制备工艺合理性的标准。苦豆子的药材标准目前只收载于《宁夏中药材标准》[2],内容缺乏整体代表性与科学性;同时作为多个中成药与提取物的重要原料,如妇炎栓、克泻灵片、苦参素注射液、苦参总碱及槐果碱,需要进行研究。本文在系统的文献调研基础上,对苦豆子的资源概况、化学成分、提取方法及质量控制现状进行了归纳总结,以期为苦豆子确定科学的质量控制及评价方法提供理论依据。
1 资源概况
苦豆子种植资源集中分布在宁夏盐池、灵武、陶乐县(市),也分布于红寺堡、同心、中宁、中卫县,该分布地区的地貌特征为黄土丘陵向鄂尔多斯台地的过渡地带;这一地带干旱、阳光充足,半荒漠到荒漠地带,半固定沙丘或固定沙丘的潮湿环境极适宜苦豆子的生长[3]。且苦豆子为多年生的草本植物,根系发达,适宜生长于砂质土壤全盐量小于0.2%的土壤中,具有耐沙埋、轻盐碱独特的生物学特性,资源开发利用比较难得[4]。综上所述,充分结合苦豆子的资源分布和生物学特性,可更好地利用宁夏苦豆子资源。
2 化学成分
苦豆子化学成分研究较为成熟,主要包括生物碱类和黄酮类。近年来,发现生物碱类为其重要的活性成分,也是大多数学者的研究方向。据报道[5]苦豆子植株及种子富含多种生物碱,现已分离出24种单碱,总碱含量为苦参的两倍:包括苦参碱(Matrine)、槐啶碱(Sophoridine)、莱曼碱(Lehrmannine)、槐果碱(Sophocarpire)、异槐果碱、槐胺碱、苦参碱-N-氧化物、槐果碱-N-氧化物、槐定碱-N-氧化物、3-d-羟醛槐定碱、13,14-脱氢槐定碱、N-羟定槐定碱、苦豆碱、N-甲级苦豆碱、烯丙基苦豆碱、金雀花碱、异槐胺碱和新槐胺碱;野啶碱和N-甲基野啶碱、5,6-二氢羽扇旺碱等。其结构基本属于喹诺里西啶类,由三价氮原子形成稠合的两个哌啶环[6]。结构决定性质,因此以上大多数呈弱碱性,遇酸成盐。性质决定存在形式,研究发现其在植物体内存在形式较多,弱碱性的生物碱以游离态存在,碱性较强的则是以有机盐的形式存在,亦有少量的无机盐、生物碱苷等其他存在形式。
3 提取技术
高效提取有效成分生物碱是开发苦豆子的重点,为此,提取技术无疑成为重中之重。针对苦豆子生物碱的特点选用提取方法大体分为两类,实际生产中较为常用的一类传统提取技术包括浸提、渗漉、回流等。另一类是建立在科学技术快速发展的基础上,一些新型技术应用于中药生物碱的提取有超临界流体萃取法、微波提取技术、酶法等。
3.1 传统提取技术
传统的提取方法基于生物碱遇酸成盐及溶于有机溶剂的原理,改变生物碱的存在形式,从而达到生物碱从植物组织脱离,有效地提取生物碱。一般采用酸水或有机溶剂如乙醇、氯仿、甲醇等,使用浸提、渗漉法或回流法等提取技术从中药中提取生物碱。邱天尧等[7]将苦豆子粗粉用0.5%~1%的酸水(有机酸如柠檬酸、乙酸,无机酸如盐酸)渗漉或冷浸,结果证实生物碱的提取率虽高,但提取液的杂质较多,造成后续纯化浓缩困难。以上方法操作虽简单易行,但需耗损大量的溶剂,提取时间长、效率低。
3.2 现代新型提取技术
3.2.1 超临界流体萃取法 超临界流体萃取(supercritical fluid extraction,SFE)技术应用于中药生物碱提取的报道很多[8],具备萃取和分离的双重作用,物料无相变过程,节能而高效,无有机溶剂残留,能与多种分析仪器联用实现自动化,易于控制,简便快捷,效率高。许馨燕等[9]采用正交设计超临界提取CO2和酸水提取苦豆子生物碱相比较,超临界提取CO2较传统酸水提取收率低,但有效成分含量高。
3.2.2 微波提取技术 微波提取技术是在传统提取技术基础上发展的一类新技术,依据微波与介质的离子和偶极子分子的相互作用,促使介质转动能力跃迁,加剧热运动,使细胞壁破裂,溶剂进入细胞内,加速有效成分的溶出[10];有耗时少、能耗低、选择性高、设备投入低等优点。李永春等[11]采用微波辅助法提取苦豆子生物碱的最佳条件为微波时间为30s、功率为360W、料液比为1∶15;相比于常规提取,该法提取生物碱不仅时间短,且提取效率提高50%。但微波辅助提取技术应用于生产尚不多见,有待于进一步研究与发展。
3.2.3 酶提取法 该方法利用生物酶的催化技术,将植物细胞壁的纤维成分水解或降解,加快植物纤维成分包裹的活性成分溶出速度,从而提高目标产物的提取率、节省提取时间、加快提取速度。李军等[12]以苦豆草生物碱的提取率为指标,比较传统提取技术和酶法提取苦豆草生物碱,提取率由原来1.46%达到2.17%;在实验室酶法提取的基础上,进一步优化苦豆草生物碱酶提取方法小试生产条件,结果显示苦豆草生物碱的提取率由原来1.76%升至2.24%。酶法提取应用在工业生产中只需要在原有工艺上进行改进,而不需要更换和新增设备,在提高生物碱提取率基础上节约了大量成本。
3.2.4 超声提取技术 李军等[13]以总生物碱为指标,采用单因素和正交试验优化苦豆子总生物碱的超声提取工艺,考察超声温度、乙醇浓度、提取时间、提取次数等工艺参数,确定最佳提取工艺,证实超声工艺稳定可行。余永婷[14]比较超声波法和传统回流提取法提取苦豆子生物碱的效果,分析影响超声波提取率的多个因素,并进行均匀试验优化,指出超声提取苦豆子生物碱效果较好,可作为新技术逐步应用于苦豆子生物碱的提取。虽然超声提取法避免高温提取,但有文献报道同一药材超声提取工艺参数变化大,影响提取过程的因素较多,致使指标成分的有效性有待于进一步研究验证。
4 质量控制方法
4.1 酸碱滴定法
药典中生物碱的测定根据各个具体种类的不同会采用液相色谱或滴定法,其中,液相色谱法精度高,但是实际工业生产中,特别将生物碱作为大生产中间体时,液相色谱法需时过久,并不适合,这种情况下,酸碱滴定法兼具快速、准确,适合大生产中实际应用。陈依群等[15]采用阴离子表面活性剂双相滴定法,酸性条件下滴定,溶剂为三氯甲烷,滴定液为磺酸钠基丁二酸二辛酯溶液,指示液为二甲基黄-亚甲蓝混合液,测定苦参碱葡萄糖注射液中苦参碱含量,与国家标准中用液相色谱法进行比较,无显著性差异。
4.2 酸性染料比色法
麝香草酚蓝比色法和溴甲酚绿显色法测定苦豆子总碱应用较为普遍。根据生物碱与溴甲酚绿结合后可形成有色化合物,在适当波长下和一定浓度范围内,该有色化合物的吸光度值与总碱浓度呈线性关系,从而可比色测定总碱含量。曹亚军等[16]采用比色法测定复方苦豆子颗粒中总生物碱含量,结果表明该方法简便易行、重复性好,为苦豆子中总碱的含量测定提供一个新的、准确性好的方法。
4.3 高效液相色谱法
HPLC凭借其稳定、可靠、高效、高度的专属性和高灵敏度等特点在中药分析中应用广泛,成为中药材及复方制剂有效成分的含量测定、指纹图谱、质量标准研究中重要的研究手段。本法在苦豆子生物碱及其制剂测定中发挥重要的作用和价值,见表1[17-23]。
4.4 气相色谱法
张为民等[24]建立了气相色谱法检测苦豆子提取物中苦参碱的方法,测定4mL·L-1盐酸冷浸提取法所得生物碱中苦参碱的质量分数最高为8.46%,该结果证实气相色谱用于质量分析的可靠性。
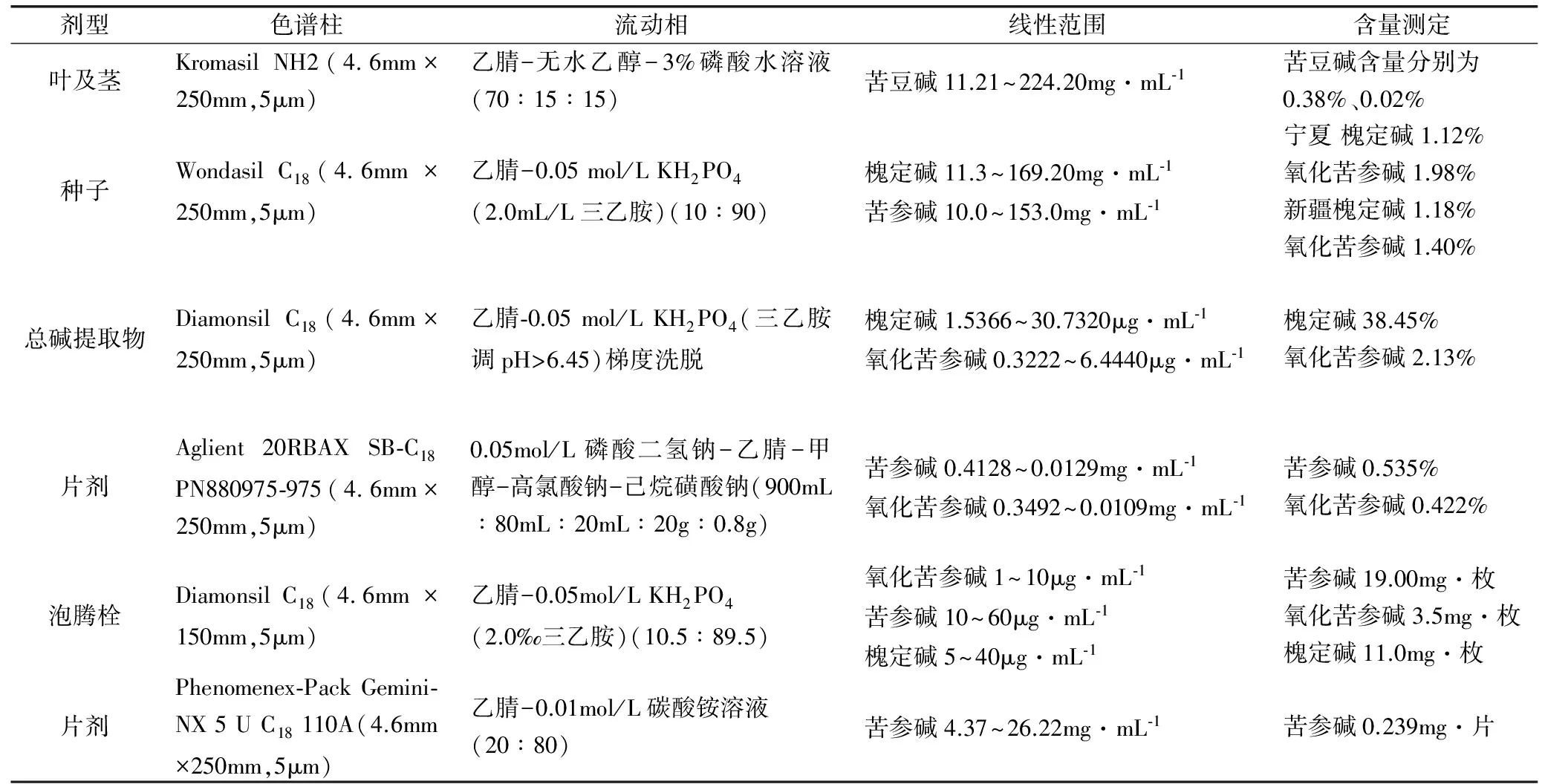
表1 文献方法对比
4.5 毛细管电泳法
该方法仅需要少量样品及溶剂,既可实现中药有效成分的测定,亦具有其他分析技术分离效率及灵敏度高、分析速度快等优点。且与高效液相色谱法相比,毛细管柱的费用远低于高效液相的分析柱,具有抗污染能力强、应用范围广等独特之处,因此毛细管电泳法将是中药质量控制重要的方法之一。如罗兴平等[25]应用高效毛细管电泳法测定苦豆子总碱注射液中苦参碱、氧化苦参碱、槐定碱的含量。Yu Yunqiu等[26]用毛细管电泳法在15min内将7种苦豆子中生物碱成分(金雀花碱、槐根碱、苦参碱、拉马宁碱、莱曼宁、槐花醇、氧化苦参碱和氧化槐果碱)分离测定出来。
4.6 质谱联用
联用技术已渗透在中药质量控制中,是一种高效的分析技术。目前该技术普遍以高效液相色谱或气相色谱为分离手段,以质谱为鉴定手段,可在直接对样品简单的处理或衍生化的情况下进行分析。万传星等[27]采用732强酸性阳离子交换树脂法、Hydromatrix为基质的固相萃取法和有机溶剂萃取法制备新疆苦豆子总碱,并用GC-MS法分析检测总碱中生物碱的组分及相对含量;结果表明:GC-MS法共检测出13种生物碱,该分析方法可行性强、精密度高、重现性好、精确且操作简便,是分析天然药物中复杂成分、控制中药其内在质量的优选方法。
5 现状分析
苦豆子生物碱复杂且种类较多,目前较多是对苦参碱或氧化苦参碱加以分析和药效学研究,而中药的研究方向较多关注有效成分的“还原-整合”,注重多个成分之间的协同作用,消除或减少某些成分的毒副作用,反映中药特色和优势。采用微量热法[28]测定中药生物活性,可体现中药整体效应。针对苦豆子较强的抗菌生物活性,采用生物热力学方法检测苦豆子的抑菌活性,可得一系列生长速率常数、最大产热功率等热活性参数,该法应用可为苦豆子的品质评价提供新思路。
6 结语
综上所述,多个指标评价能够改进质量分析方法。但适宜的提取方法是前提,因此依据生物碱性质,寻找提取技术显得尤为重要。有关苦豆子生物碱的分离提取、定性定量分析等方面的研究已达到一定的高度,但仍存在一些亟待解决的问题。新型的提取技术只应用于实验室如微波法,实际生产工艺方面却有所限制,即提取环节非常薄弱和滞后,致使蕴藏于苦豆子的潜在价值并未得到合理的开发利用。
[1] 南京中医药大学.中药大辞典[M].上海:上海科学技术出版社,2010.
[2] 邢世瑞.宁夏中药材标准[M].银川:宁夏人民出版社,1993.
[3] 张清云,杨朝霞,赵晓莉,等.宁夏苦豆子资源的保护及其开发利用[J].资源与环境,2011,27(10):897-910.
[4] 高晓原,贝盏临,雷茜,等.宁夏苦豆子资源基本情况及综合开发现状[J].中国野生植物资源,2009,28(2):17-20.
[5] 张兰珍.苦豆子种子生物碱成分研究[J].中国中药杂志,1997,22(12):740-743.
[6] 杨巧丽,顾政一,黄华.中药苦豆子的研究进展[J].西北药学杂志,2011,26(3):232-235.
[7] 邱天尧.苦豆子提取工艺的比较研究[J].黑龙江医药,2007,20(4):338-339.
[8] 张龙,张曜武,杨浩.生物碱的超临界CO2萃取研究进展[J].天津化工,2012,26(1):1-3.
[9] 许馨燕,仲婕,顾政一.超临界CO2法与酸水法提取苦豆子的比较研究[J].国外医学·中医药分册,2005,27(5):297-299.
[10] 张德华,黄仁术,左露,等.生物碱的提取方法研究进展[J].中国野生植物资源,2010,29(5):15-20.
[11] 李永春,叶新红,舒翔.微波法提取苦豆子生物碱的研究[J].中国食品添加剂,2008(5),73-76.
[12] 李军,郝彩琴,陈海燕,等.酶法提取苦豆草生物碱研究[J].西北药学杂志,2014, 29(4):347-349.
[13] 李军,郝彩琴,马小兰,等.正交试验法优化苦豆子总生物碱的超声提取工艺[J].中国民族民间医药,2014,(8):24-26.
[14] 余永婷.超声波法提取苦豆子生物碱的工艺研究[J].中国食品添加剂,2008(3):69-72.
[15] 陈依群,林婉红,李开诚.阴离子表面活性剂双相滴定法测定苦参碱葡萄糖注射液含量[J].现代食品与药品杂志,2006,16(3):55-57.
[16] 曹亚军,陈虹,马建慧,等.复方苦豆子颗粒中总黄酮成分的含量测定[J].时珍国医国药,2011,18(4):787-788.
[17] 魏蕾初,邓虹珠,张丽,等. HPLC测定苦豆子不同部位中苦豆碱的含量[J].中国实验方剂学杂志,2013,19(4):140-142.
[18] 陈海燕,郭鸿淹,冷晓红.HPLC法测定西北地区不同产地苦豆子药材中生物碱的含量[J].北方药学,2013,10(5):10-11.
[19] 杨新玲.HPLC法测定苦豆子片含量的方法验证[J].新疆中医药,2013,31(6):54-55.
[20] 刘振龙,张丽,魏蕾初,等.HPLC法同时测定苦豆子总碱中8种生物碱含量[J].中国实验方剂学杂志,2013,19(8):142-144.
[21] 王婷,乔华,梁莉,等.苦豆子总碱泡腾栓的制备及质量标准研究[J].中国药房,2007,18(18):1376-1378.
[22] 毛艳,贺金华,黄华.苦豆子片定性定量方法研究[J].中国实验方剂学杂志,2012,18(20):81-83.
[23] 赵文昌,宋丽君,邓虹珠,等.RP-HPLC测定苦豆子总碱中莱曼碱的含量[J].药物分析杂志,2009(9):18-20.
[24] 张为民,蒲鹏,张德刚,等.从苦豆子种子中提取生物碱的方法研究[J].中国农学通报,2005,21(2):7-9.
[25] 罗兴平,聂凌云,翟宗德,等.高效毛细管电泳法同时测定苦豆子总碱注射液中3中生物碱的含量[J].解放军药学学报,2005,21(6):458.
[26] YU YUNQIU,DING PEILAN,CHEN DAOFENG.Determination of quinolizidine alkaloids in Sophora medicinal plants by capillary electrophoresis[J].Anal Chim Acta,2004(1):15-20.
[27] 万传星,刘明月,孙红专,等.GC-MS分析苦豆子总碱中的13种生物碱[J].华西药学杂志,2009,24(6):587-590.
[28] 胡艳军,蒋风雷,欧阳宇,等.微量热法在药物活性评价中的应用[J].中国科学,2010,40(9):1276-1285.
[30] 梅明,伍振峰,韩丽,等.苦参常压提取与减压提取的工艺效果比较[J].中国实验方剂学杂志,2014,20(22):16-19.
(责任编辑:魏 晓)
Discussion of Ningxia Characteristics of Alkaloids fromSophoraalopecuroidsExtract and Quality Control Method
ZhangYujuan1,Han Li1*,Tang yixuan1,Wangpengfei1,Wangxin1,Zhou Wenquan2
(1.College of Pharmacy,Chengdu University of Traditional Chinese Medicine;The Ministry of Education Key Laboratory of Standardization of Chinese Herbal Medicine;Key Laboratory of Systematic Research, Development and Utilization of Chinese Medicine Resources in Sichuan Province-Key Laboratory Breeding Base of Co-founded by Sichuan Province and MOST,Chengdu 611137,China; 2.Sichuan University, Chengdu 610064, China)
Objective:To Summary chemical compositions and extract technology and quality control research of Ningxia theSophoraalopecuroides.Methods:Refer to the domestic related literature, Extraction technology of alkaloids fromSophoraalopecuroidesclass and quality control method are analyzed and summarized.Results and Conclusion:Quality control method in this article summed up the new extraction techniques such as ultrasound, microwave, enzymes and so on in the application of Sophora alopecuroides alkaloids extraction and gas chromatography, capillary electrophoresis based; It provides the direction and thinking for sustainable utilization of Ningxia studies,Sophoraalopecuroidesmedicinal quality, resources evaluation.
Sophoraalopecuroides; Ningxia ; Alkaloids; Quality Control
2015-07-08
张喻娟(1991-),女,成都中医药大学硕士研究生,研究方向为中药新技术、新工艺、新制剂。
韩丽(1965-),女,成都中医药大学教授,硕士生导师,研究方向为中药新新技术、新工艺、新制剂。E-mail:hanliyx@163.com。
R284.1
A
1673-2197(2015)23-0039-03
10.11954/ytctyy.201523015
