TRPM7参与诱发心肌纤维化作用及药物干预
2015-04-26刘勇慧王欣伟汤依群
周 阳,雷 荃,郭 巧,刘勇慧,王欣伟,汤依群
(中国药科大学 临床药学教研室,江苏 南京 210009)
TRPM7参与诱发心肌纤维化作用及药物干预
周 阳,雷 荃,郭 巧,刘勇慧,王欣伟,汤依群*
(中国药科大学 临床药学教研室,江苏 南京 210009)
目的:研究脂多糖(LPS)引起的成纤维细胞上TRPM7通道的上调和细胞增殖间的关系,并利用黄芪甲苷进行干预。方法:分离大鼠乳鼠心脏成纤维细胞,分成7组,正常组、模型组(LPS 0.1μg·mL-1、1μg·mL-1)、TRPM7通道阻断剂组(carvacrol 500μmoL·L-1、2-APB 100μmoL·L-1)、黄芪甲苷(ASG Ⅳ)组(1μmoL·L-1、10μmoL·L-1),后4组在加入 1μg· mL-1LPS的同时,分别给予500μmoL·L-1carvacrol、100μmoL·L-12-APB、1μmoL·L-1ASG Ⅳ、10μmoL·L-1ASG Ⅳ,孵育72h,通过全细胞膜片钳技术检测TRPM7电流的变化,利用RT-PCR和Western Blot方法分别测定TRPM7通道的基因和蛋白的表达,利用MTT方法测定成纤维细胞的增殖能力。结果:与正常组相比,LPS两个组的TRPM7电流大小及基因、蛋白表达明显升高(P<0.01);与模型组相比,carvacrol、2-APB通道阻断剂组的电流大小、基因和蛋白表达显著降低(P<0.01);此外,ASG Ⅳ 对电流、基因和蛋白表达也有不同程度的抑制作用(P<0.05)。模型组的成纤维细胞增殖能力明显强于其他组(P<0.01),通道阻断剂组及黄芪甲苷组均能不同程度抑制细胞的异常增殖(P<0.01)。结论:脂多糖(LPS)能够使成纤维细胞上TRPM7电流大小及通道表达上调,且该上调能增强细胞增殖能力,而ASG Ⅳ能通过下调TRPM7表达抑制成纤维细胞的增殖。
LPS;成纤维细胞;TRPM7;黄芪甲苷
心肌成纤维细胞(cardiac fibroblasts)的异常增殖是心肌纤维化的重要病理基础。成纤维细胞(cardiac fibroblasts)是心脏中数量最多的细胞类型,生理状态下主要起心脏结构支撑的作用;以往的研究忽视了其在病理状态下的作用,事实上,在氧化应激、炎症刺激、细胞因子、机械牵拉等多种病理状态的刺激下,成纤维细胞会转化成具有更强增殖、分泌、迁移功能的肌成纤维细胞(cardiac myofibroblasts),该细胞是纤维化病理过程的重要参与者。TRPM7是瞬时受体电位通道(transient receptor potential channel TRP)家族的成员之一,其具有调节细胞增殖、凋亡等作用[1]。文献报道称,炎症性心肌病发生时常伴随着心肌纤维化,而由TRPM7通道介导,炎性介质影响细胞增殖的现象多见于其他组织和细胞类型[2-4],影响心肌成纤维细胞增殖的相关报道较少。黄芪甲苷(Lipopolysaccharide LPS)是具有调节免疫功能、抗细胞凋亡、抗炎、抗氧化、保护心肌细胞、抑制细胞异常增殖等多重作用的中药活性成分[5-6]。有研究显示,黄芪甲苷可抑制心肌纤维化的进程[7],从而起到预防和治疗心肌肥厚、心力衰竭等心脏疾病的作用,但其抑制纤维化的内在机制仍不清楚。
脂多糖是致炎因子,常见于诱导炎症病理模型。本实验通过脂多糖对成纤维细胞进行体外诱导,想进一步证明脂多糖是否能够引起心脏成纤维细胞的异常增生,同时探讨该异常增生是否由TRPM7的通道上调所引起,以及黄芪甲苷对该过程的抑制作用。
1 材料与试剂
1.1 药品
脂多糖(美国Sigma公司);黄芪甲苷(南京泽琅公司);2-APB(美国Sigma 公司);Carvacrol(美国Sigma 公司);TRPM7蛋白一抗(美国ABCAM公司);兔抗GAPDH一抗(Bioworld公司);HRP标记羊抗兔二抗(美国Santa Cruz公司);荧光定量PCR扩增试剂盒(Thermo Scientific公司),其余试剂为市售分析纯。
1.2 溶液配置
细胞外液:葡萄糖10mmoL·L-1;NaCl 140mmoL·L-1;CsCl 5mmoL·L-1;HEPES 10mmoL·L-1;CaCl21.8mmoL·L-1;MgCl21 mmoL·L-1,调节pH到7.3~7.4。
电极内液:Cs-SO3CH3115mmoL·L-1;NaCl 8mmoL·L-1;HEPES 10mmoL·L-1;EGTA-Cs 10mmoL·L-1;用CsOH调节pH至7.2左右。
1.3 仪器
二氧化碳细胞培养箱(美国Thermo Scientifica公司); EPC-10型膜片钳放大器(德国Heka公司);实时荧光定量PCR仪(德国eppendorf公司);分子酶标仪(美国Thermo Fisher公司);DYCP-40C电泳槽( 北京市六一仪器厂)。
1.4 实验动物
出生时间为1~3天的SD大鼠乳鼠10只,雌雄不限,由上海杰思捷实验动物有限公司提供,动物合格证号:SCXK(沪)2013-0006。
2 方法
2.1 乳鼠成纤维细胞的分离与培养
乳鼠处死后浸入75%乙醇溶液中消毒,取心脏,放入预冷的 D-Hanks 液冲洗掉多余的血,换至0.08%的胰酶中,剪成0.5~1.0mm3大小的碎块,加新的胰酶在37℃中反复消化,收集每次的消化液,离心重悬后过200目不锈钢网筛,将该细胞悬液加入培养瓶,放入培养箱差速贴壁培养90 min,贴壁的细胞即为成纤维细胞,待细胞长满传代时,再次利用差速贴壁法,得到纯度为95%以上的成纤维细胞,用第二代成纤维细胞进行实验。
2.2 细胞分组及给药
将第二代的成纤维细胞分为7组:正常组、LPS 0.1μg·mL-1组、LPS 1μg·mL-1组、LPS 1μg·mL-1+carvacrol 500μmoL·L-1组、LPS 1μg·mL-1+2-APB 100μmoL·L-1组、LPS 1μg·mL-1+黄芪甲苷(ASG Ⅳ)1μmoL·L-1组、LPS 1μg·mL-1+黄芪甲苷(ASG Ⅳ)10μmoL·L-1组,后4组在加入 1μg·mL-1LPS的同时,分别给予500μmoL·L-1carvacrol、100μmoL·L-12-APB、1μmoL·L-1ASG Ⅳ、10μmoL·L-1ASG Ⅳ,孵育72h后进行各项实验。
2.3 膜片钳实验
玻璃电极两步拉制法拉制,抛光后灌充以电极内液,用入水后电阻值为2~5MΩ的电极进行实验。封接和破膜后,补偿慢电容和串联电阻,消除电容瞬迹,进行全细胞模式的纪录。Pulse软件进行数据的采集。所有实验均在室温(23~25℃)下进行。
2.4 Western Blot实验
用蛋白裂解液分别提取每组细胞的总蛋白,测定浓度并分装,取总蛋白40g与5×SDS上样缓冲液混合,经8% SDS-PAGE分离胶电泳,随后电转至PVDF膜上,用含5% 脱脂奶粉的封闭液室温封闭2h,用TRPM7一抗(1∶500)4℃孵育过夜,用HRP标记的羊抗兔二抗(1∶1 500)室温孵2h,ECL法显影,GAPDH作为内参。Image J 软件进行分析,以目的蛋白与GAPDH蛋白灰度值的比值计算目的蛋白的表达水平,重复3次。
2.5 实时荧光定量PCR基因检测
各组细胞用PBS洗两遍后,加入Trizol试剂,按照试剂盒说明书提取RNA,通过在260nm处的吸光度值来确定RNA纯度,2μg总RNA按照第一链cDNA合成试剂盒(first Strand cDNA Synthesis Kit,AMV)说明书用于逆转录,取1μL的cDNA产物用于每个PCR反应,用扩增试剂盒(Maxima SYBR Green Qpcr MM,ROX),按照说明书进行实时荧光定量PCR检测。选GAPDH基因作内参基因。通过2^-ΔΔCt方法处理,基因序列由上海生工有限公司设计合成。

表1 用于实时荧光定量PCR的引物寡核苷酸序列
2.6 MTT测细胞增殖实验
用含10%胎小牛血清得培养液配成单个细胞悬液,以每孔越10 000个细胞接种到96孔板,每孔体积200μL。根据实验分组,换不同的培养基培养72h。每孔加MTT溶液(5mg·mL-1用PBS配制,pH=7.4)20μL,继续孵育4h,终止培养,吸弃上清,每孔加150μL DMSO,摇床振荡10min,使结晶物充分融解。选择570nm波长,在酶标仪上测定吸光度值,记录结果。
2.7 数据处理
全细胞膜片钳所有数据均使用Pulse软件进行纪录,采用Graphypad prism 5.0和sigmaplot10.0来分析数据和曲线拟合。实验所得数据用mean±SD表示,组间均数比较采用双侧t检验,P<0.05表示差异具有统计学意义。
3 结果
3.1 脂多糖促细胞增殖及药物干预作用
低剂量(0.1μg·mL-1、1μg·mL-1)的LPS能增强成纤维细胞的增殖能力 (P<0.01),给予TRPM7通道阻断剂的两组细胞增殖能力有明显下调(P<0.05),结果显示黄芪甲苷也有不错的抑制异常增殖的能力(P<0.01),且高浓度(10μmoL·L-1)的黄芪甲苷具有更好的抑制作用(见表1)。

表1 各组成纤维细胞增殖能力比较 (n=3)
注:与正常组比较,#P<0.05,##P<0.01;与LPS 1μg·mL-1组比较,*P<0.05,**P<0.01。
3.2 成纤维细胞的TRPM7基因和蛋白表达量的变化
RT-PCR结果和western blot的结果均显示,与正常组相比,脂多糖(LPS)两个组(0.1μg· mL-1、1.0μg· mL-1)的TRPM7 mRNA量有显著升高,且高浓度组(1μg· mL-1)上调更明显(P<0.01)。而LPS+carvacrol组和 LPS+2-APB组的TRPM7基因和蛋白表达量低于模型组(P<0.01),略高于正常组。黄芪甲苷的两组(1μmoL·L-1、10μmoL·L-1)对TRPM7的表达均有抑制作用(P<0.01),且具有一定程度的浓度依赖性(见图1)。
3.3 成纤维细胞的TRPM7通道电流变化
在0mV的钳制电压下给予从-100mV至+120mV的阶跃为20mV的一系列去极化刺激,经分析处理得到电流密度图(n=7),与正常组相比,LPS组的TRPM7电流密度曲线随电压绝对值的增大有显著升高(图2-A)。而与模型组相比,LPS+carvacrol组和LPS+2-APB组的电流密度曲线随着电压绝对值的增加有明显减小(图2-B)。黄芪甲苷组对电流也有明显抑制作用,且高浓度组更显著(图2-C)。
4 讨论
纤维化的主要表征是细胞外胶原的过度沉积和细胞外基质(ECM)的增多,而成纤维细胞转化为肌成纤维细胞后,其分泌胶原和细胞外基质的能力增强,该过程是纤维化病理过程中的重要一环。在心脏纤维化过程中有多重因素的参与,如炎症、氧化应激、高压等,脂多糖是常用的炎症诱导因子,能引起炎症反应和氧化应激反应,许多实验结果显示,脂多糖能在肺部、肝部、肾部引起成纤维细胞的异常增殖,但不同组织的成纤维细胞反应及机制不同[8-10]。
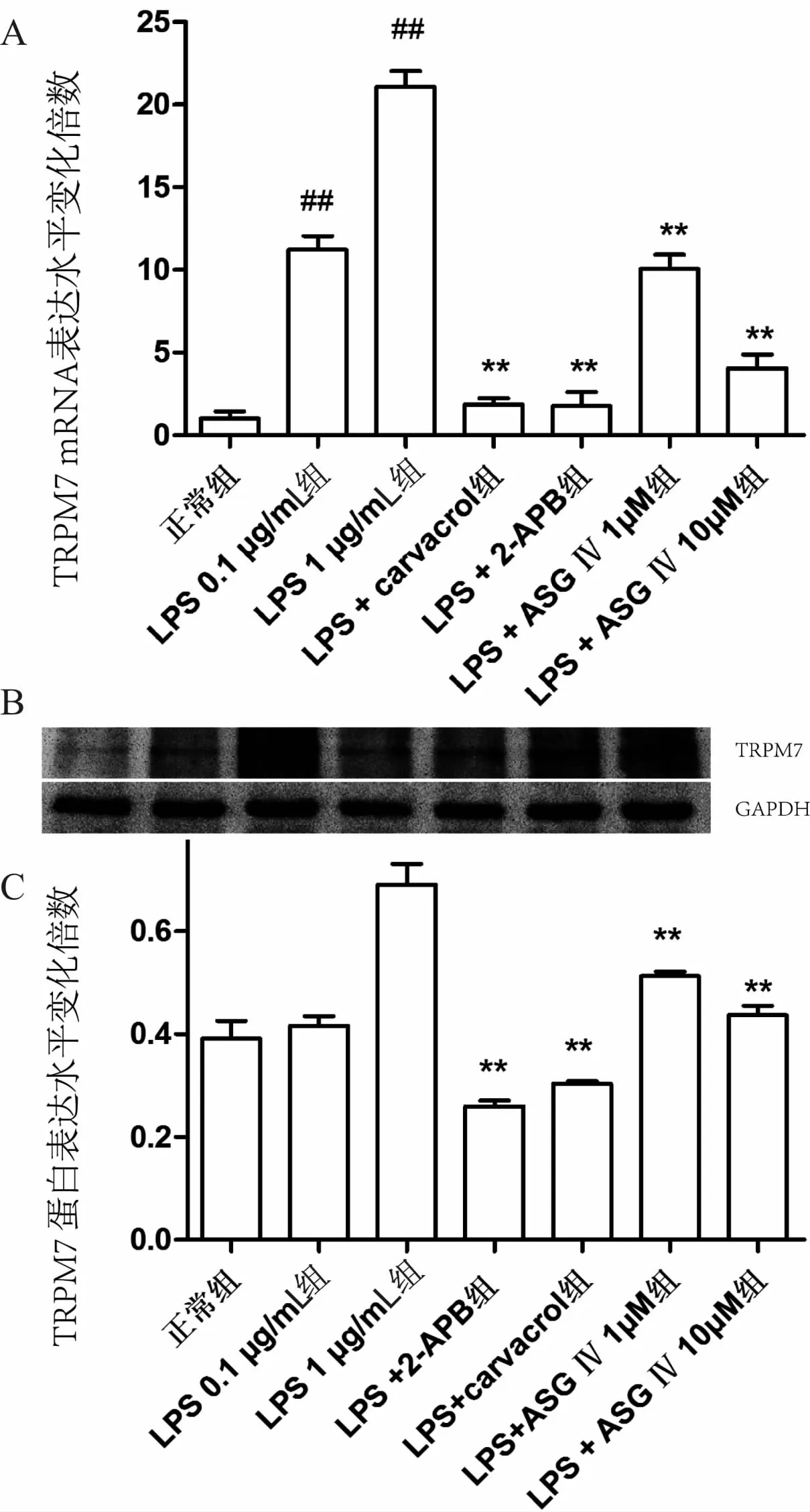
图1 不同组TRPM7的mRNA和蛋白表达量的变化(n=3)
注:与正常组比较,#P<0.05,##P<0.01;与LPS 1μg·mL-1组比较,*P<0.05,**P<0.01。

图2 不同组TRPM7电流变化的电流密度曲线(n=7)
注:与正常组比较,#P<0.05,##P<0.01;与LPS 1μg·mL-1组比较,*P<0.05,**P<0.01。
本文通过脂多糖炎症模型,研究炎症对成纤维细胞增殖的影响,且通过TRPM7通道的相关研究,进一步说明TRPM7通道参与调控成纤维细胞的增殖作用。TRPM7是一个分布广泛且对多种阳离子具有通透性的非电压依赖性离子通道。该通道的活性受多种因素调节。目前研究发现,TRPM7参与多种生理活动和疾病的发生发展,如胚胎细胞的发育与增殖、肿瘤的增殖与迁移、神经细胞的凋亡与损伤、平滑肌细胞和成纤维细胞的增殖等。因此,心脏纤维化的发生发展也可能与TRPM7通道的表达功能的调控相关。
本实验结果显示,心脏的成纤维细胞在低浓度脂多糖(0.1 μg·mL-1、1μg·mL-1)的诱导下有明显的异常增殖现象,给予TRPM7通道阻断剂2-APB和carvacrol,均能使该增殖受到明显抑制,同时我们发现脂多糖模型组的TRPM7基因和蛋白表达量、电流大小均有不同程度显著升高,且高浓度的上调变化更明显(1μg·mL-1),这种同向变化的现象说明,脂多糖引起的成纤维细胞异常增殖可能与TRPM7的表达上调相关。
黄芪甲苷是常见的抗炎中药提取物,本实验采用高低两个剂量,发现与脂多糖组(1μg·mL-1)相比黄芪甲苷确能在一定程度上抑制成纤维细胞的异常增殖,且具有浓度依赖性;同时,根据PCR和蛋白电泳结果,黄芪甲苷对TRPM7基因和蛋白的表达量均有不同程度的下调作用,膜片钳实验结果也显示黄芪甲苷能抑制TRPM7电流的增大,此外,黄芪甲苷对脂多糖诱导的成纤维细胞的异常增殖也有显著的抑制作用。综上实验结果可以说明,黄芪甲苷对脂多糖引起的成纤维细胞增殖具有抑制作用,该作用可能与下调TRPM7有关。
黄芪甲苷[11]是常见中药活性成分,近年来研究发现黄芪甲苷具有多种药理活性,其中抗炎、抗氧化应激、抗病毒等作用明显,有相关研究显示,黄芪甲苷能抑制成纤维细胞的异常增殖,在其他组织和器官的抑制纤维化作用也十分明显[12-13],但其抑制心肌成纤维细胞增殖的作用报道较少见。本实验结果初步证明了黄芪甲苷能抑制心肌成纤维细胞的异常增殖,且该增殖是由TRPM7通道调控的。其中的机制可能与黄芪甲苷抑制自由基生成和抑制炎性因子作用相关,通过调节TRPM7通道的上游调控因子,影响TRPM7通道的表达及功能,进而参与成纤维细胞的分化、增殖的调控,但具体药理机制需要后续的实验来深入探讨。
由于心脏纤维化发病机制的复杂性,导致很多药物的治疗效果欠佳。而中药提取物具有多环节、多靶点发挥作用的特点,在治疗心血管疾病方面具有更大优势。本实验选择黄芪甲苷作为治疗药物,是由于其在抑制纤维化的同时具有保护心肌细胞[14]、抑制心肌凋亡、抗心肌肥厚[15]的作用,在临床上具有更全面的治疗心脏纤维化发展的作用。黄芪甲苷抑制由TRPM7介导的成纤维细胞增殖的作用会为将来黄芪甲苷的抗纤维化药理作用机制及临床治疗心脏纤维化提供新的思路和理论依据。但由于本实验为体外实验,未来还需要体内实验对TRPM7参与纤维化的作用做进一步研究。
近年来关于TRPM7通道的研究越来越多,其调节细胞周期、镁平衡等重要生理功能也逐渐被认识,相信未来关于TRPM7通道的研究势必会成为热点,为多种疾病的临床治疗提供更多的帮助和启示。
[1] CLAPHAM D E,RUNNELS L W.The TRP ion channel family[J].Nat Rev Neurosci ,2001(2):387-396.
[2] CESAR ECHEVERRIA,IGNACIO MONTORFANOL.Tamara Hermosilla.Endotoxin Induces fibrosis in vascular endothelial cells through a mechanism dependent on transient receptor rprotein melastatin 7 activity[J].Plos one,2014,9 (4):94146.
[3] ECHEVERRIA C,MONTORFANO I,SARMIENTO D,et al.Lipopolysaccharide induces a fibrotic-like phenotype in endothelial cells[J].Cell Mol Med ,2013,17(6):800-814.
[4] 杨勇,肖尚志,葛亚坤,等.黄芪甲苷Ⅳ对大鼠主动脉平滑肌细胞增殖的抑制作用[J].航天医学与医学工程,2011,24(2):79-84.
[5] DANIELA SARMIENTOA,IGNACIO.Montorfanoa,Monica Caceres,Endotoxin-induced vascular endothelial cell migration is dependent on TLR4/NF-β pathway NADPH oxidase activaton and transient receptor potential melastatin 7 calcium channel activity[J].Int J Biochem Cell Biol,2014(55):11-23.
[6] MINGZHE YU,CHENG HUANG.Inhibition of TRPM7 channels prevents proliferation and differentiation of human lung fibroblasts[J].Inflamm.Res,2013(62):961-970.
[7] 张海啸,史载祥.中西医结合防治心肌纤维化的研究进展[J].中国中西医结合杂志,2006,9(26):860-863.
[8] ZHENGYU HE,YUAN GAO,YUXIAO DENG.Lipopolysaccharide induces lung fibroblast proliferation through Toll-like receptor 4 signaling and the phosphoinositide3-kinase-Akt pathway[J].Plos one,2012,7(4):35926.
[9] XIAO-JUN C,MIN F,LIANG C,et al.Expression and role of adiponectin receptor 1 in lipopolysaccharide-induced proliferation of cultured rat adventitial fibroblasts[J].Cell Biol,2010,34(2):163-169.
[10] GUTIERREZVENEGAS G,KAWASAKICARDENAS P,ARROYOCRUZ SR.Luteolin inhibits lipopolysaccharide actions on human gingival fibroblasts[J].Eur J Pharmacol,2006,541(12):95-105.
[11] 段立军,孙博航.黄芪甲苷的研究进展[J].沈阳药科大学学报,2011,128(15):411-414.
[12] 陈晶,张博华.黄芪大黄的抗肾纤维化作用研究进展[J].中医药学报,2011,39(6):101-104.
[13] 王永生,徐小雅,杨波.黄芪甲苷对博莱霉素诱导的大鼠肺纤维化的治疗作用研究[J].现代预防医学,2012,39(12):3090-3092.
[14] 汪明辉,李双杰.黄芪甲苷抗氧化机制对病毒性心肌炎保护作用的研究[J].临床儿科杂志,2007,25(10):825-827.
[15] 许晓乐,季晖,谷舒怡,等.黄芪甲苷对异丙肾上腺素所致小鼠心肌肥厚的保护作用[J].中国药科大学学报,2007,28(5):451-455.
(责任编辑:余 婷)
Effects of TRPM7 on Cardiac Fibrosis and Drug Intervention
Zhou Yang,Lei Quan,Guo Qiao,Liu Yonghui,Wang Xinwei,Tang Yiqun*
(Department of Clinical Pharmacy,China Pharmaceutical University,Nanjing 210009,China)
Objective:To investigate the effects of Lipopolysaccharide(LPS) and the inhibitory effects of astragaloside Ⅳ(ASG Ⅳ) on the proliferation of cardiac fibroblasts through TRPM7 channel.Methods:Cardiac fibroblasts obtained from neonatal SD rats were cultured in vitro divided into 7 groups,control group,model groups(LPS 0.1μg·mL-1,1μg·mL-1),TRPM7 channel blocker groups(carvacrol 500 μmoL·L-1,2-APB 100 μmoL·L-1),ASG Ⅳ treatment groups(1μmoL·L-1,10μmoL·L-1).The treatment groups were administered with 1 μg·mL-1LPS and treated respectively with 500μmoL·L-1carvacrol,100μmoL·L-12-APB,1μmoL·L-1ASG Ⅳ,10μmoL·L-1ASG Ⅳ.Each group was incubated for 72 hours.The changes of gene and protein expression,channel current,cell proliferation before and after administration were measured respectively by RT-PCR,western blot,whole cell patch clamp and MTT.Results:RT-PCR and western blot results showed that LPS had significantly upregulated the gene and protein expression of TRPM7(P<0.01) and carvacrol,2-APB,ASG Ⅳ inhibited the increase on different levels.Patch clamp data revealed that there was a decrease of TRPM7 current in LPS +carvacrol group,LPS+2-APB group and LPS+ASG Ⅳgroup compared with model group.Furthermore,ASG Ⅳ markly prevented the proliferation of cardiac fibroblasts induced by LPS(P<0.01).Conclusion:We demonstrate that TRPM7 channels contributed to LPS induced cardiac fibroblasts proliferation and suggest that this contribution may be suppressed by ASG Ⅳ through inbibition of TRPM7 channel.
LPS ;Cardiac Fibroblasts;TRPM7;ASG Ⅳ
2015-08-05
国家重大新药创制科技重大专项课题(2011ZX09401-021)
周阳(1990-),女,中国药科大学硕士研究生,研究方向为心血管药理。
汤依群(1967-),女,中国药科大学副教授,研究方向为心血管药理。
R285
A
1673-2197(2015)23-0001-04
10.11954/ytctyy.201523001
