鸡传染性贫血病毒VP1、VP2基因的表达及免疫原性研究
2015-04-26李启红李俊平杨承槐李慧姣
徐 微,李启红,李 岭,孙 淼,李俊平,杨承槐,李慧姣
(中国兽医药品监察所,北京100081)
鸡传染性贫血病毒VP1、VP2基因的表达及免疫原性研究
徐 微,李启红,李 岭,孙 淼,李俊平,杨承槐∗,李慧姣∗
(中国兽医药品监察所,北京100081)
为探索鸡传染性贫血重组蛋白亚单位疫苗的可行性,将鸡传染性贫血病毒基因分别克隆到转移载体pFastBacHTA中,再将其分别转化DH10Bac感受态细胞得到相应的重组表达载体,转染昆虫细胞Sf21获得含有VP1、VP2基因的重组杆状病毒vBac-VP1、vBac-VP2,应用悬浮培养的Sf21细胞表达重组蛋白。SDS-PAGE及Western blotting结果证明,VP1、VP2基因在昆虫细胞中得到了表达,动物试验进一步证实,重组蛋白免疫SPF鸡可产生ELISA抗体,提示杆状病毒表达的VP1、VP2具有良好的免疫原性。
鸡传染性贫血病毒;杆状病毒表达;VP1;VP2;免疫原性
鸡传染性贫血(chicken infectious anemia,CIA)又称蓝翅病,是由圆环病毒科鸡传染性贫血病毒(CIAV)引起的以雏鸡再生障碍性贫血和全身性淋巴组织萎缩为主要特征的免疫抑制病[1]。CIAV于1979年由Yuasa等人首次发现并分离[2],其后迅速传至世界各地,给养禽业带来了巨大损失,被列为世界重要禽病研究行列。
CIAV的基因组是一环形、单股、负链DNA,大小约为2.3 kb。全基因组包括部分重叠或完全重叠的三个开放读码框架(open reading frame,ORFs),分别由1347、648、363 nt组成,编码着VP1(52 kD)、VP2(24 kD)和 VP3(14 kD)蛋白[3]。VP1蛋白是CAV的唯一衣壳蛋白和主要免疫原蛋白,而VP2是VP1的辅助蛋白,能帮助VP1形成正确的构象,二者相互协调才能诱导机体产生免疫保护作用[4]。据国内外学者报道,单独表达的 VP1蛋白抗体反应较弱[5],共同表达的VP1、VP2蛋白具有确实的免疫原性[6],如利用杆状病毒在贴壁培养的 Sf9中表达 CIAV M9905株的 VP1、VP2蛋白[7],但目前尚无将VP1、VP2重组蛋白与实际疫苗生产实践相结合的报道。故本实验旨在通过利用基因工程技术,将鸡传染性贫血病毒cux-1株的VP1、VP2的基因分别单独连接到载体中,采用重组杆状病毒表达系统在悬浮培养的昆虫细胞Sf21中表达目的蛋白,将获得目的蛋白进行纯化和功能鉴定后,按照生物制品标准规程制备油乳剂灭活疫苗用于免疫动物并分析免疫效果,借以研究重组蛋白的免疫原性和分析用作亚单位疫苗的可行性。
1 材料与方法
1.1 材料
1.1.1 载体、菌种和实验动物 转移载体质粒pFastBacHTA(pFBH)由本室保存,pFBH-VP1、pFBH-VP2插入基因分别为CIAV cux-1株的VP1、VP2基因;TOP10感受态细胞,购自北京天根生化科技有限公司,DH10Bac大肠杆菌感受态细胞由北京畜牧兽医研究所李刚教授惠赠;SPF鸡购自梅里亚维通实验动物技术有限公司。
1.1.2 主要试剂 限制性内切酶EcoR I、SpeI、XhoI、KpnI,T4连接酶购自NEB公司,Ex Taq试剂盒购自大连 TaKaRa生物工程公司,转染试剂LipofectaminTM2000购自 Invitrogen公司,昆虫细胞培养基Sf900 II SFM、Grace’s购自GIBCO BRL公司,胎牛血清购自Hyclone公司
1.1.3 试剂盒 高纯度质粒小提中量试剂盒、琼脂糖凝胶DNA回收试剂盒购自天根生化科技有限公司,Wizard Genomic DNA Purification Kit购自Promega公司,CIAV抗体检测试剂盒购自北京天之泰生物科技有限公司。
1.1.4 CIAV及其阳性血清 CIAV cux-1株由本室保存,其多克隆阳性血清购自Charles river laboratories。
1.2 方法
1.2.1 引物设计与合成 根据已发表的基因组序列,设计扩增鸡传染性贫血病毒cux-1株的VP1及VP2基因引物,由上海生工生物工程有限公司合成。VP1-F:5’-CCGGAATTCGCCACCATGGCAAGACGAGCTCGCAGAC-3’,VP1-R:5’-CTA⁃GACTAGTCCTTAGGGCTGCGTCCCCCAG-TACATG-3’,VP2-F:5’-CCGCTCGAGGATGCACGGGAACG⁃GCGCACAAC-3’,VP2-R:5’-GGGG-TACCCCT⁃TACACTATACGTACCGGGG-3’,其中VP1上下游分别引入EcoR I、SpeI酶切位点,VP2上下游分别引入XhoI、KpnI酶切位点。
1.2.2 DNA模板提取 采用Wizard Genomic DNA Purification Kit进行。
1.2.3 VP1基因的克隆 PCR反应体系:CIAV DNA 2 μL,dNTPs 2 μL,10×Ex Taq buffer 2.5 μL,引物VP1-F和VP1-R各1 μL,Ex Taq DNA聚合酶0.125 μL,ddH2O 16.375 μL,总体积25 μL。反应条件:94℃预变性3 min,94℃变性40 s,62.8℃退火40 s,72℃延伸1 min 30 s,30个循环后,72℃延伸10 min。
1.2.4 VP2基因的克隆 PCR反应体系:CIAV DNA 2 μL,dNTPs 2 μL,10×Ex Taq buffer 2.5 μL,引物VP2-F和VP2-R各1 μL,Ex Taq DNA聚合酶0.125 μL,ddH2O 16.375 μL,总体积25 μL。反应条件:94℃预变性3 min,94℃变性40 s,62.8℃退火40 s,72℃延伸30 s,30个循环后,72℃延伸10 min。
1.2.5 基因测序及序列分析 PCR产物用胶回收试剂盒回收后,分别连接到pMD18-T载体,转化TOP10感受态细胞,获得重组质粒pMD18T-VP1,pMD18T-VP2。将酶切及PCR鉴定正确的重组质粒送Invitrogen公司测序,并用序列分析软件对测序结果进行分析。
1.2.6 重组转移载体构建 pMD18T-VP1、pMD18T-VP2经测序正确后,使用限制性内切酶EcoR I、SpeI分别双酶切pMD18T-VP1及转移载体质粒 pFastBacHTA后连接,获得重组转移载体pFBH-VP1;使用限制性内切酶XhoI、KpnI分别双酶切pMD18T-VP2及转移载体质粒pFastBacHTA后连接,获得重组转移载体pFBH-VP2。以上重组载体均用双酶切及PCR鉴定。
1.2.7 重组表达载体构建 重组转移载体鉴定正确后,将 pFBH-VP1、pFBH-VP2分别转化DH10Bac大肠杆菌感受态细胞,经蓝白斑和庆大霉素、卡那霉素、四环素三抗筛选之后,获得重组表达载体Bacmid DNA,使用M13通用引物与VP1、VP2基因特异引物进行PCR鉴定。
1.2.8 重组杆状病毒产生 经鉴定载体重组正确后,按照LipofectaminTM2000操作说明,将Bacmid-VP1、Bacmid-VP2分别转染Sf21昆虫细胞,混合孵育5 h后弃去转染混合物,加入Sf900 II SFM培养基,28℃培养至细胞出现明显的细胞病变时,收集培养液,1500 r/min离心10 min后收集上清,加入2%~4%的胎牛血清,4℃避光保存,即为 P1代毒。按MOI=0.1将P1代毒接种处于对数生长期(密度为1×106~2×106细胞/mL)的Sf21细胞,28℃培养72 h收获P2代毒,同样方法接P2代毒,收获P3代毒,用于重组蛋白表达。
1.2.9 重组杆状病毒鉴定 提取病毒液中的病毒DNA,用M13通用引物与VP1、VP2基因特异引物进行PCR鉴定。
1.2.10 重组蛋白表达及鉴定 将悬浮培养的Sf21细胞调整至对数生长期后,按MOI=5接种P3代毒,将重组杆状病毒vBac-VP1、vBac-VP2共同感染细胞,于28℃ 125 r/min摇床中培养,24、48、72、96、120和144 h分别收获细胞及上清,裂解后用10%的分离胶进行SDS-PAGE蛋白电泳,分别考马斯亮蓝染色及Western blotting观察结果。
1.2.11 重组蛋白免疫原性研究 按照生物制品标准规程将vBac-VP1、vBac-VP2共感染表达产物制成油乳剂灭活疫苗。经胸部肌肉接种5周龄SPF鸡三只,同时设等量对照。于免疫后21 d采血并分离血清,利用ELISA试剂盒检测抗体效价。
2 结果
2.1 VP1、VP2基因的PCR扩增 分别使用VP1、VP2特异性引物对病毒DNA模板进行扩增,扩增产物经0.8%琼脂糖凝胶电泳分析,可见分别出现1350 bp及651 bp片段,与预期片段大小相符(图1和图2)。

图1 VP1基因的PCR扩增结果
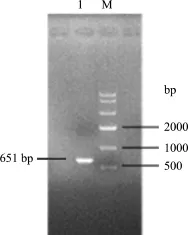
图2 VP2基因的PCR扩增结果
2.2 基因测序及序列分析 使用序列分析软件对重组质粒pMD18T-VP1、pMD18T-VP2测序结果进行分析,得到二者与目的基因同源性均达到99%。
2.3 重组转移载体鉴定 利用各载体特异性的限制性内切酶酶切鉴定及 PCR鉴定结果均表明,CIAV的VP1、VP2基因正确插入各重组质粒的多克隆位点,且方向正确。
2.4 重组表达载体鉴定 重组转移载体转化DH10Bac细胞经蓝白斑筛选后,提取杆粒,利用用M13通用引物与VP1、VP2基因特异引物进行PCR鉴定,Bacmid-VP1经M13-F/VP1-R为引物扩增后出现 3100 bp片段,与理论值相符(图 3);Bacmid-VP2经M13-F/VP2-R为引物扩增后出现2478 bp片段,与理论值相符(图4),证明重组表达载体正确构建。
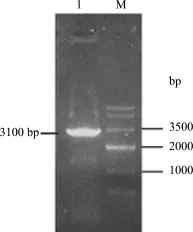
图3 Bacmid-VP1的PCR鉴定结果

图4 Bacmid-VP2的PCR鉴定结果
2.5 重组杆状病毒构建 对收获的细胞培养上清提取病毒DNA,利用M13通用引物与VP1、VP2基因特异引物进行PCR鉴定。
2.6 重组蛋白的鉴定 分别于感染后24、48、72、96、120和144 h收获三种不同表达载体感染Sf21细胞所得产物,SDS-PAGE电泳分析表明,重组杆状病毒vBac-VP1、vBac-VP2共同感染细胞后72 h开始表达目的蛋白VP1、VP2,大小分别为60 kD和29 kD左右,直至140 h仍有表达(图5),经Western blotting分析,均出现与预期大小相符的条带。
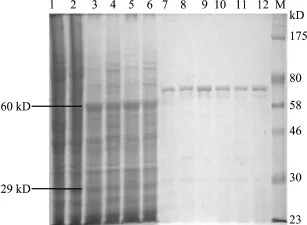
图5 重组杆状病毒vBac-VP1、vBac-VP2共同感染表达产物
2.7 重组蛋白的免疫原性 经ELISA试剂盒检测,对照组全部为阴性,免疫组全部为阳性,平均抗体效价9966。
3 讨论
CIAV感染雏鸡可引起严重贫血,渗出性皮炎和死亡,特别是导致全身性淋巴组织萎缩引起免疫抑制而继发感染或二重感染,降低其它疫苗的免疫效果。野生型CIAV虽然能在MDCC-MSB1细胞或鸡胚上增殖,但通过MSB1细胞连续传代降低其毒力后对于雏鸡来讲致病性仍然较强,比如国外生产的Cux-1株弱毒苗,接种雏鸡仍然可以导致CIA的发生[8];另一方面,CIAV在MSB1细胞中病毒滴度较低,而通过鸡胚传代获得的病毒量也不高,使CIA灭活疫苗的生产成本很高,难以在养鸡业大量推广应用,同时CIAV对各种理化因子具有很强抵抗性而很难将其全部灭括,在其他常规鸡胚苗的生产过程中,往往有活的CAV存在,引起严重的二次感染,因此,给常规疫苗的研制带来了很大困难。故近年来,基因工程疫苗研制已成为CIAV研究的重点领域之一,如哺乳动物细胞表达[9]以及在家蚕中的表达[8]。
本研究所使用的杆状病毒表达系统(baculovirus expression vector system,BEVS)是一个利用杆状病毒作为载体,在昆虫培养细胞或虫体中表达外源蛋白的真核表达系统。具有安全性高、真核修饰环境、容量大、表达量高等特点,自 Smith GE等于1983年利用AcNPV成功表达外源蛋白以来,经过30年的发展,杆状病毒表达系统已经成为当今基因工程四大表达系统(杆状病毒、大肠杆菌、酵母、哺乳动物细胞表达系统)之一。
本研究利用Bac-to-Bac杆状病毒表达系统,成功构建单独表达CIAV VP1、VP2基因的重组杆状病毒 vBac-VP1、vBac-VP2。利用 vBac-VP1、vBac-VP2共同感染细胞后收获表达产物,经SDSPAGE蛋白电泳分析表明重组表达蛋白VP1、VP2大小分别为 60 kD和 29 kD左右,经 Western blotting分析证明,重组VP1、VP2蛋白能与CIAV阳性血清发生特异性免疫反应,具有良好的抗原性。将重组表达产物制备为油乳剂灭活疫苗免疫SPF鸡,21 d后ELISA检测抗体转阳,这说明杆状病毒表达的CIAV VP1、VP2蛋白具有良好的免疫原性,可诱导机体产生体液免疫应答。本研究初步证明采用Bac-to-Bac杆状病毒表达系统表达的CIAV cux-1株VP1和VP2蛋白具有较好的免疫原性,且通过按照标准规程制备油乳剂灭活苗,进一步将重组蛋白表达与生产实际相联系,具有较好的应用前景。故该重组蛋白可以用于中和抗体检测,检测群体的免疫水平,也为进一步开展亚单位疫苗生产奠定了基础。
[1]李文涛,王宏伟,韩少杰.传染性贫血病[J].养禽与禽病防治,2005,10:36-37.
[2]Yuasa N,Taniguchi T,Yoshida I.Isolation and some properties of an agent inducing anemia in chicks[J].Avian Disease,1979,23:366-385.
[3]翟新验,卢胜明.鸡贫血病毒[C]//中国畜牧兽医学会禽病学分会第十一次学术研讨会论文集,2002:336-338.
[4]Koch G,van Roozelaar D,Verschueren C,et al.Immunogenic and protective properties of chicken anaemia virus proteins expressed by baculovirus[J].Vaccine,1995,13:763-770.
[5]Guan-Hua Lai,Ming-Kuem Lin,Yi-Yang Lien,et al.Expression and characterization of highly antigenic domains of chicken anemia virus viral VP2 and VP3 subunit proteins in a recombinant E.coli for sero-diagnostic applications[J].BMC Veterinary Research,2013,9:161.
[6]Mathieu H,Claudia A,Guus K,et al.Simultaneous expression of recombinantbaculovirusencoded chicken anaemia virus proteins VP1 and VP2 is required for formation of the CAV-specific neutralizing epitope[J].Journal of General Virology,1998,79:3073-3077.
[7]鄢明华,赵晓岩,刘长军,等.鸡传染性贫血病毒VP1、VP2基因在杆状病毒表达系统中的表达[J].中国预防兽医学报,2003,25(6):426-429.
[8]黄建芳,张知良,赵宝华,等.鸡贫血病毒VP1和VP2蛋白在家蚕中的联合表达[J].动物医学进展,2002,2(3):53-56.
[9]陈降华,李文平,周庆丰,等.鸡传染性贫血病毒VP1和VP2基因共表达载体的构建[J].动物医学进展,2009,30(11):68-71.
(编 辑:李文平)
Expression of VP1 and VP2 Genes of Chicken Anemia Virus and Immunogenicity Research
XU Wei1,LI Qi-hong,LI Ling,SUN Miao,LI Jun-ping,YANG Cheng-huai∗,LI Hui-jiao∗
(China Institute of Veterinary Drug Control,Beijing100081,China)
The VP1 and VP2 genes of chicken anemia virus were cloned into pFastBacHTA vectors separately,then transformed into competent cells ofE.coliDH10Bac.The recombinant baculoviruses vBac-VP1 and vBac-VP2were generated by transfection of recombinant bacmid into Sf21 insect cells.Finally,recombinant proteins were expressed in suspension culture Sf21 cells.SDS-PAGE and Western blotting showed that VP1 and VP2 have been expressed in Sf21 cells.Immunized the SPF chicken with recombinant protein,their serum were inspected by ELISA and showed good immunogenicity.
chicken anemia virus;baculovirus expression;VP1;VP2;immunogenicity
2014-10-10
A
1002-1280(2015)04-0007-05
S852.65
科技部科技基础性工作专项“重大动物疫病病原及相关制品标准物质研究(2008FY130100)”
徐 微,硕士研究生,从事禽病研究。
杨承槐,E-mail:ychenghuai@163.com;李慧姣,E-mail:lihuijiao@ivdc.org.cn
