呋喃妥因代谢物化学发光酶联免疫检测方法的研究
2015-04-26吕月霞黄登宇王云贵
王 瑞,吕月霞,黄登宇∗,王云贵,李 涛
(1.山西大学生命科学学院,太原030006;2.深圳易瑞生物技术有限公司,深圳518101;3.山西先锋科技开发有限公司,太原030006)
呋喃妥因代谢物化学发光酶联免疫检测方法的研究
王 瑞1,吕月霞1,黄登宇1∗,王云贵2,李 涛3
(1.山西大学生命科学学院,太原030006;2.深圳易瑞生物技术有限公司,深圳518101;3.山西先锋科技开发有限公司,太原030006)
对呋喃妥因代谢物1-氨基乙内酰脲(AHD)进行半抗原改造,采用活化酯法将半抗原与卵清蛋白(OVA)偶联为包被原,与标准品竞争AHD单克隆抗体的抗原结合位点,加入辣根过氧化物酶标记羊抗鼠二抗,建立了AHD间接竞争化学发光酶联免疫(CLEIA)检测法,并对化学发光液、包被原与抗体最优稀释度、包被条件、封闭液和竞争时间五项参数进行优化。结果表明:该方法具有良好的特异性,IC50为0.753 ng/mL,在鸡肉组织中的检测限为0.028 μg/kg,添加回收率在80.54%~102.64%之间,变异系数均小于10%。与国标中液相色谱-串联质谱法(LC-MS/MS)和我国出入境行业标准中酶联免疫检测法(ELISA)相比,不仅降低了检测限,而且操作简便,为动物源性食品中呋喃妥因代谢物的残留提供了准确、便捷的分析检测手段。
呋喃妥因代谢物;包被原;化学发光酶联免疫检测
近年来,动物源性食品中兽药残留问题给人体带来的毒性、致癌致畸性、耐药性和过敏反应等危害,已引起社会各界的广泛关注[1]。硝基呋喃类药物对绝大多数革兰氏菌均有抑菌杀菌作用,被广泛应用于治疗水产、畜禽等动物传染病和胃肠道感染。但是,毒理学评价发现,硝基呋喃类药物代谢物具有强毒性和致癌性作用[2]。因此,对硝基呋喃类药物代谢物的分析和检测具有重要意义。呋喃妥因是硝基呋喃类药物之一,目前对呋喃妥因代谢物1-氨基乙内酰脲(AHD)的检测主要是仪器分析法[3],也有少数采用酶联免疫(ELISA)检测法[4-5]。化学发光酶联免疫检测法(CLEIA)将化学发光检测的高灵敏度与ELISA的高特异性相结合[6],在灵敏度和最低检测限方面有所突破,且与仪器分析法相比,不需要昂贵的设备、操作简单、用时短,适用于大量样本快速筛查,对严把食品安全质量关有重要意义。本实验建立了AHD CLEIA法,并对该方法进行了优化和评估。
1 材料与方法
1.1 试剂与仪器 AHD单克隆抗体、辣根过氧化物酶标记羊抗鼠二抗(HRP-IgG)(北京艾旗斯德科技有限公司提供);1-氨基乙内酰脲(AHD)、二甲基甲酰胺(DMF)、N-羟基琥珀酰亚胺(NHS)、N,N-二环己基碳二亚胺(DCC)、卵清蛋白(OVA)、鲁米诺、对甲苯酚、1-(2-硝基苯亚甲基)-氨基乙内酰脲(NPAHD)、牛血清白蛋白(BSA)、二甲基亚砜(DMSO)、四甲基硅烷(TMS)(Sigma公司);对碘苯酚、过氧化氢脲、三(羟甲基)氨基甲烷(Tris)、对醛基苯甲酸(4-CBA)、30%双氧水(30%H2O2)、甲醇(CH3OH)、乙醇(C2H5OH)(国药集团化学试剂有限公司);透析袋(Solarbio公司);96孔化学发光板(Thermo Fisher Sicentific公司);其他有关化学试剂均为分析纯。
BSA224S电子天平(精度0.1 mg)(德国Sartorius公司);单道微量移液器0.5~10 μL、10~100 μL(美国Thermo公司);8通道移液器30~300 μL(德国Eppendorf公司);1000~5000 μL移液器(大龙兴创实验仪器有限公司);UPT-I-10T超纯水机(四川优普超纯科技有限公司);VORTEX GENIUS3混匀仪、RH BASIC1加热磁力搅拌器(德国IKA公司);BSD-100振荡培养箱(上海博迅实业有限公司);SC-3610低速离心机(安徽中科中佳科学仪器有限公司);UV-1600PC紫外可见分光光度计(上海美谱达仪器有限公司);INFINITE 200PRO酶标仪(瑞士Tecan公司);AVANCE 600MHZ超导核磁共振波谱仪(德国Bruker公司)。
1.2 方法
1.2.1 合成半抗原1-(4-羧基苯亚甲基)-氨基乙内酰脲(CPAHD) 76.0 mg AHD溶于8.0 mL CH3OH,滴加到10.0 mL溶有75.0 mg 4-CBA的CH3OH溶液中,65℃搅拌18 h,4500 r/min离心5 min,弃上清,C2H5OH洗涤,旋转蒸发后吹干,得白色粉末状固体[7]。核磁共振氢谱(1HNMR)验证CPAHD合成是否成功。
1.2.2 制备包被原CPAHD-OVA 5.0 mg CPAHD溶于 250 μL DMF,加入3.6 mg NHS和 6.8 mg DCC,室温下反应14 h,得活化反应产物A液;取5.4 mg OVA溶于 1.3 mL磷酸盐缓冲液(PBS,0.01 mol/L,pH 7.4),得B液;将A液缓慢加入B液,室温反应2 h,4℃搅拌过夜(12 h)。PBS透析96 h,4500 r/min离心5 min,弃沉淀,上清液冷冻干燥,得白色固体[7-8]。
1.2.3 AHD化学发光酶联免疫检测法操作步骤包被原 CPAHD-OVA用碳酸盐缓冲液(CBS,0.05 mol/L,pH 9.6)稀释后加入到96孔化学发光板,100 μL/well,包被一定时间;200 μL/well磷酸盐洗涤液(PBST,0.01 mol/L,0.05%吐温-20,pH 7.4)洗板甩干,加入200 μL/well封闭液,37℃封闭2 h,洗板;每孔加入标准品NPAHD溶液或样品溶液50 μL和50 μL抗体,竞争反应一定时间,洗板;加稀释4000倍的HRP-IgG,100 μL/well,37℃孵育1.5 h,洗板;加化学发光液100 μL/well,室温下避光反应数分钟,置于酶标仪中检测化学发光强度RLU[9]。
1.2.4 优化CLEIA参数 影响CLEIA高灵敏度的参数很多,每个参数的改变都可能直接影响检测结果,导致灵敏度和重复性下降。本实验对影响较大的五项参数包括化学发光液、包被原与抗体最优稀释度、包被条件、封闭液和竞争时间进行优化。
1.2.4.1 优化化学发光液 取44.3 mg鲁米诺溶于1.0 mL DMF,配成0.25 mol/L原液;取33.0 mg对碘苯酚溶于15.0 mL DMF,配成0.01 mol/L原液;取10.8 mg对甲苯酚溶于 10.0 mL DMF,配成0.01 mol/L原液;取28.2 mg过氧化氢脲溶于1.0 mL超纯水,配成0.30 mol/L原液;将30%H2O2临用前用PBS稀释成0.10 mol/L原液;配制1.00 mol/L, pH 8.8的Tris-HCl缓冲液作为化学发光底物缓冲液。分别配制8组不同的化学发光液组合,如表1所示。

表1 化学发光液组合
将50 μL稀释度为1∶30000的HRP-IgG加入到化学发光板中,再加100 μL化学发光液(现用现配),每组设 5个平行,室温下避光反应,每隔3 min测定一次RLU值,测10组,选取RLU值高且发光稳定的组别为最优化学发光液组合[10]。
1.2.4.2 优化包被原与抗体稀释度 采用棋盘法确定包被原和抗体的最优稀释度。将包被原按1∶1250,1∶2500,1∶5000,1∶10000,1∶20000,1∶40000的稀释度作纵向包被,AHD单克隆抗体按1∶10000,1 ∶20000,1 ∶40000,1 ∶80000,1∶160000,1∶320000,1∶640000,1∶1280000的稀释度作横向包被,HRP-IgG浓度为1∶4000,竞争抑制药物NPAHD浓度为100 ng/mL,测定化学发光强度RLU,确定最优结果。
1.2.4.3 优化包被条件 以最佳包被原稀释浓度包被,100 μL/well,分别设置4℃包被过夜(1组)、37℃包被2 h再4℃包被过夜(2组)和37℃包被2 h(3组)3种包被条件,确定最优,每组设 3个平行。
1.2.4.4 优化封闭液 以上述最优包被原、抗体稀释度和包被时间为基础,分别设置1%脱脂乳粉(1组)、1%明胶(2组)和1%BSA(3组)3种不同封闭液,确定最优,每组设3个平行。
1.2.4.5 优化竞争时间 分别设置40 min、1 h、2 h、2.5 h 4组竞争时间,确定最优,每组设3个平行。
1.2.5 CLEIA方法学评估
1.2.5.1 建立CLEIA标准曲线 将标准品NPAHD配制成100、20、4、0.8、0.16、0.032 ng/mL系列浓度梯度溶液,每个浓度3个平行,按照1.2.3项步骤及上述优化后最佳实验条件进行操作,测定RLU值。以B/B0(B为各浓度NPAHD抑制时RLU值,B0为无NPAHD抑制时RLU值)为纵坐标,NPAHD浓度的对数值为横坐标,绘制CLEIA标准曲线,得出线性方程及该方法灵敏度IC50,其中IC50为NPAHD 50%抑制浓度。
1.2.5.2 测定特异性 CLEIA方法特异性通过交叉反应率CR来反映。将NPAHD结构类似物呋喃妥因、呋喃唑酮、呋喃它酮、呋喃西林、AHD、呋喃唑酮代谢物(AOZ)、呋喃它酮代谢物(AMOZ)、呋喃西林代谢物(SEM)及其对应的代谢物衍生物NPAOZ、NPAMOZ、NPSEM和衍生试剂4-CBA、邻硝基苯甲醛分别配制成 100、20、4、0.8、0.16、0.032 ng/mL系列浓度,按照1.2.3项所述步骤检测,计算其各自 IC50。交叉反应率 CR(%)=IC50(NPAHD)/IC50(类似物)×100%。
1.2.5.3 测定准确性和精密度 CLEIA方法的准确性以回收率表示,精密度以变异系数表示。本实验对空白鸡肉样品进行AHD标准品添加回收实验,添加浓度分别为1、5、15 ng/g,每个浓度设5个平行,并分批进行5次实验,计算回收率、批内变异系数及批间变异系数。
取1.0 g鸡肉组织,加入4.0 mL超纯水,匀浆,再加入1.00 mol/L HCl 0.5 mL和0.01 mol/L邻硝基苯甲醛100 μL,充分混匀,置于37℃振荡反应16 h。反应结束后,加入0.10 mol/L K2HPO45.0 mL,1.00 mol/L NaOH 0.4 mL和5.0 mL乙酸乙酯,室温下振荡1 min,4500 r/min离心10 min。取上清液于10 mL离心管中,45℃吹干,然后用1.5 mL正己烷溶解干燥物,再加入0.5 mL PBS溶液,室温4500 r/min离心10 min,取底部水相用CLEIA方法测定。回收率(%)=加标后实际测定值/已知加标量×100%。
1.2.5.4 测定最低检测限 取空白鸡肉样品20份进行检测,通过标准曲线计算对应的样品浓度。以20份空白样品浓度平均值()加3倍标准差(s)作为样品检测的最低检测限(LOD)。
2 结果与分析
2.1 半抗原CPAHD的鉴定 对CPAHD进行1HNMR扫描,分析图谱可知,CPAHD,1HNMR(DMSO,20℃,δvs.TMS)4.381(s,2H,CH2),7.803-7.817(m,2H,C6H),7.862(s,1H,CH=),8.003-8.017(m,2H,C6H),11.303-11.336(m,1H,NH),13.086(s,1H,COOH)。其中7.862(s,1H,CH=)证明CPAHD已合成。
2.2 包被原CPAHD-OVA的紫外鉴定 参考文献[11]对包被原CPAHD-OVA进行紫外吸收图谱扫描,分析图谱可知,CPAHD在299 nm处有吸收峰,OVA在 279 nm处有吸收峰,CPAHD-OVA在303 nm处有吸收峰。说明CPAHD与OVA偶联后,吸收峰发生了明显偏移,初步判断包被原偶联成功。
2.3 优化CLEIA参数
2.3.1 优化化学发光液 8组化学发光液测得RLU值如图1,随着时间延长,对甲苯酚作化学发光增强剂时,RLU值较对碘苯酚稳定,但RLU值却比对碘苯酚小1个数量级左右。第2组,对碘苯酚作发光增强剂,过氧化氢脲作氧化剂,6 min内,RLU值稳定在1900000左右,满足RLU值高且稳定的要求,故选择第2组作为化学发光液组合,检测时间选择4 min。

图1 不同化学发光液组合对应的RLU值
2.3.2 优化包被原与抗体稀释度 竞争酶联免疫反应中,通过考察不同反应条件下B/B0的比值,优选包被原与抗体的最适稀释度。B/B0越小,灵敏度越高;适当增大包被原或抗体稀释度,可提高反应灵敏度[12]。棋盘测定结果如表2,综合考虑,选择包被原稀释度为 1∶10000,抗体稀释度为1∶160000。此外,B/B0值的差异说明加入竞争抑制物NPAHD后,包被原与抗体结合反应发生了不同程度抑制,进一步证明包被原偶联成功。

表2 不同包被原和抗体稀释度下B/B0值
2.3.3 优化包被条件 将不同包被条件下测得结果,分别绘制标准曲线,计算IC50和RLUmax/IC50,RLUmax为最大化学发光强度。结果如图2。第2组37℃包被2 h再4℃包被过夜的包被条件下,RLUmax/IC50最大,说明此条件下,灵敏度最高[8]。表明先在37℃条件下包被,温度较高有助于包被原在酶标板上快速吸附,再4℃包被过夜,较长时间可使包被原包被均匀,提高灵敏度。

图2 包被条件优化
2.3.4 优化封闭液 不同封闭液所得 IC50和RLUmax/IC50结果如图3,脱脂乳粉和BSA的IC50接近,均低于明胶IC50,但是脱脂乳粉的RLU值偏低,以至于其RLUmax/IC50偏小,BSA RLUmax/IC50最大。说明BSA封闭时,灵敏度最高。BSA作为一种蛋白类封闭物,其降低非特异性吸附的性能优于脱脂乳粉和明胶。
2.3.5 优化竞争时间 不同竞争时间所得IC50和RLUmax/IC50结果如图4,竞争反应1 h,RLUmax/IC50值最大,灵敏度最高,此后IC50趋于稳定,变化不明显,RLUmax/IC50值有所降低。表明抑制物与抗体竞争性与包被原结合反应1 h后,反应基本达到稳定状态。

图3 封闭液优化

图4 竞争时间优化
2.4 CLEIA方法学评估
2.4.1 建立CLEIA标准曲线 IC50是评价CLEIA方法灵敏度的重要指标,其值越小,说明此方法灵敏度越高。以优化后各参数为实验条件,进行CLEIA系列标品浓度竞争实验,即包被原稀释度1∶10000,先37℃包被2 h再4℃包被过夜;以1% BSA为封闭液;抗体稀释度1∶160000;竞争反应时间1 h;化学发光液以对碘苯酚为发光增强剂,过氧化氢脲为氧化剂,其中鲁米诺、对碘苯酚和过氧化氢脲的摩尔比为5∶7∶3,加入化学发光液后避光反应4 min,测定RLU值。得标准曲线如图5。在0.042~15.521 ng/mL范围内,呈线性关系,可进行精确检测,线性方程为Y=-23.911X+118.78,R2=0.9917,得出IC50为0.753 ng/mL,说明本实验建立的AHD CLEIA检测法灵敏度较高。

图5 AHD CLEIA标准曲线图
2.4.2 测定特异性 CLEIA法特异性测定结果如表3,抗体除对呋喃妥因原药存在24.80%的交叉反应外,与其他结构类似物及衍生试剂的交叉反应率均小于0.01%。由于呋喃妥因原药在进入动物体内后,迅速代谢分解,故在实际样本检测中,其内并不含呋喃妥因原药与抗体竞争性结合。说明本方法所用的AHD单克隆抗体具有良好的特异性,用于样品检测时,可准确测定样品中是否有呋喃妥因代谢物。

表3 特异性测定结果表
2.4.3 测定准确性和精密度 本实验向空白鸡肉样品组织中添加了3组不同浓度水平的AHD,通过邻硝基苯甲醛衍生化,成为抗体识别物。CLEIA法测定各浓度水平添加回收率,每个浓度设5个平行,并分批进行5次实验,结果如表 4,回收率在80.54%~102.64%之间,批内和批间变异系数均小于10%。说明建立的CLEIA法准确性和精密度良好,可以满足实际样品检测的需求。
2.4.4 测定最低检测限 对20份空白鸡肉样品进行检测,通过标准曲线计算对应的样品浓度,如表5。20份空白样品浓度平均值为0.013 μg/kg,标准差为0.005,最低检测限(LOD)为0.028 μg/kg。
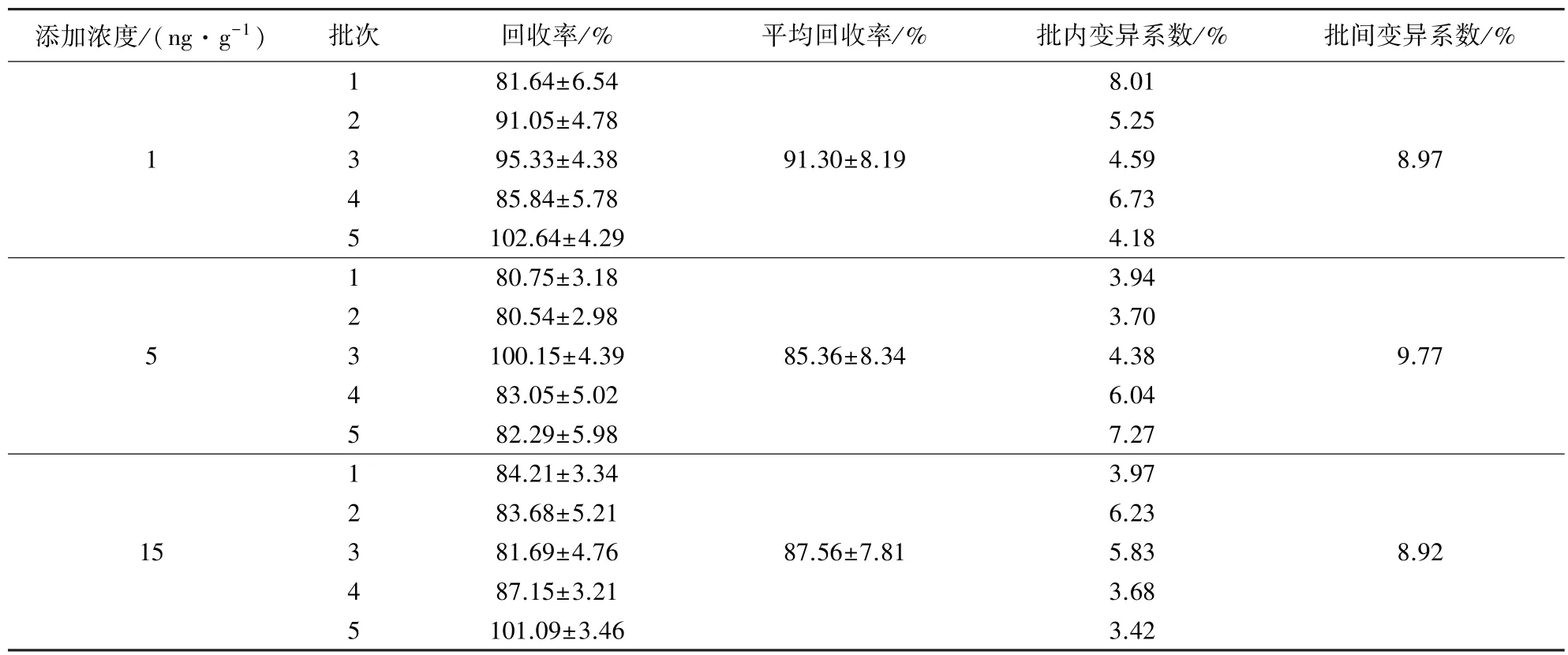
表4 准确性和精密度测定结果表

表5 最低检测限测定结果表
3 小结
本实验建立了呋喃妥因代谢物AHD化学发光酶联免疫检测方法,并对化学发光液、包被原与抗体最优稀释度、包被条件、封闭液和竞争时间五项参数进行了优化,该方法灵敏度IC50为0.753 ng/mL,最低检测限达0.028 μg/kg。其最低检测限远低于国标[13]中液相色谱-串联质谱法(LC-MS/MS)检测限0.5 μg/kg和我国出入境行业标准[14]中ELISA法检测限0.1 μg/kg,因而更加符合动物源性食品中AHD不得检出的高灵敏度检测要求[15],对于严格监控AHD残留、严把食品安全质量关、保障食品安全具有重要参考价值。此方法精密度、准确性和特异性良好,是下一步研制AHD化学发光酶联免疫快速检测试剂盒的基础,以满足大批量样本快速筛查的需求,为基层食品安全监管人员检测AHD残留量提供一种准确、可靠、便捷的方法,有利于迅速控制食品安全风险,保障人民群众饮食健康安全。
[1]林 中.兽药中非法添加违禁药物的原因分析及监管对策[J].中国兽药杂志,2014,48(5):63-65.
[2]Pimpitak U,Putong S,Komolpis K,et al.Development of a monoclonal antibody-based enzyme-linked immunosorbent assay for detection of the furaltadone metabolite,AMOZ,in fortified shrimp samples[J].Food Chemistry,2009,116(3):785-791.
[3]徐建飞.LC-MS/MS在硝基呋喃类兽药残留检测中的应用[J].中国兽药杂志,2012,46(10):46-49.
[4]徐一平,金征宇,胥传来.ELISA方法检测呋喃妥因代谢物1-氨基乙内酰脲[J].食品工业科技,2008,29(8):272-275.
[5]Li J,Liu J X,Wang J P.Multidetermination of Four Nitrofurans in Animal Feeds by a Sensitive and Simple Enzyme-Linked Immunosorbent Assay[J].Journal of Agricultural and Food Chemistry,2009,57(6):2181-2185.
[6]Lee J H,R.Rho J E,D.Rho T H,et al.Advent of Innovative Chemiluminescent Enzyme Immunoassay[J].Biosensors and Bioelectronics,2010,26(8):377-382.
[7]郑丽丽.呋喃它酮和呋喃妥因酶联免疫检测方法的研究[D].天津:天津科技大学,2013.
[8]蒋文晓.动物组织中呋喃妥因和呋喃它酮代谢物残留的酶联免疫检测方法研究[D].北京:中国农业大学,2011.
[9]邓 浩,孔德彬,杨金易,等.对硫磷化学发光酶联免疫吸附分析方法的建立和评价[J].分析化学,2013,(2):247-252.
[10]钟寒燕.抗氯霉素单克隆抗体的制备及化学发光酶免疫分析方法的建立[D].南昌:南昌大学,2010.
[11]贾慧勤,丁焕中.呋喃唑酮代谢物人工抗原的合成及抗体的制备[J].中国兽药杂志,2013,47(6):20~23.
[12]杨武英,董洁娴,沈玉栋,等.虾肉中呋喃它酮代谢物化学发光酶免疫分析方法的建立[J].分析化学,2012,40(12):1816-1821.
[13]中国国家标准化管理委员会.GB/T 20752-2006猪肉、牛肉、鸡肉、猪肝和水产品中硝基呋喃类代谢物残留量的测定 液相色谱-串联质谱法[S].
[14]国家质量监督检验总局SN/T 3380-2012.出口动物源食品中硝基呋喃代谢物残留量的测定 酶联免疫吸附法[S].
[15]中华人民共和国农业部公告第235号.动物性食品中兽药最高残留限量[Z].
(编 辑:侯向辉)
Study of Chemiluminescent Enzyme Immunoassay Method for Nitrofurantoin Metabolite
WANG Rui1,LV Yue-xia1,HUANG Deng-yu1∗,WANG Yun-gui2,LI Tao3
(1.School of Life Science,Shanxi University,Taiyuan030006,China;2.Shenzhen Bioeasy Technology Inc.,Shenzhen518101,China;3.Shanxi Vanguard Technology Co Ltd.,Taiyuan030006,China)
The haptene of nitrofurantoin metabolite(AHD)was modified by hapten,then made it conjugate with ovalbmin(OVA) by using N-hyduoxysuccinimide ester method to synthesize envelope antigen.Then the compound was coupled to AHD monoclonal antibody competitively with standard reference.After the HRP labeled goat-anti-mouse secondary antibody coupled to the monoclonal antibody which conjugated with envelope antigen,an indirect competitive chemiluminescent enzyme immunoassay(CLEIA)for AHD was established.Then five test parameters,such as chemiluminescent solution,envelope antigen concentration and antibody concentration,enveloped condition,sealed liquid and competitive reaction time were optimized.The results indicated that the AHD CLEIA had good specificity for AHD.We obtained an IC50value of 0.753 ng/mL.We also obtained the limit of detection of 0.028 μg/kg and recoveries rates of AHD ranged from 80.54%to 102.64%in spiked chicken samples.The coefficient of variation was less than 10%.Compared with LC-MS/MS in national standards and ELISA in industry standard for CIQ,this method not only improved the detection limit,but also operated easily.It could provide a convenient and accurate way for detection of AHD,which will have great value for the evaluation of food safety.
nitrofurantoin metabolite;envelope antigen;CLEIA
2015-02-10
A
1002-1280(2015)04-0035-07
S859.79
王 瑞,硕士研究生,从事食品质量安全检测研究。
黄登宇。E-mail:Huangdy110@126.com
