成骨不全症儿童下肢骨折保守治疗的远期并发症
2015-04-25任秀智陈梅房凤岭刘军龙窦丛辉
任秀智 陈梅 房凤岭 刘军龙 窦丛辉
成骨不全 ( osteogenesis imperfecta,OI ) 又称脆骨病,是一类遗传性结缔组织疾病,临床上常以骨质疏松和骨的脆性增加,易于骨折作为诊断依据之一。其临床表现严重程度不等,可以从轻微、无症状难以被临床发现到严重骨骼畸形、甚至围产期死亡。部分成骨不全患者还会有身材矮小、蓝巩膜、鸡胸、牙本质发育不全、早熟性耳硬化、脊柱后凸或侧凸、关节及韧带松弛以及肌肉薄弱等症状。经典的成骨不全主要以常染色体显性遗传方式为主,85%~90% 为 I 型胶原蛋白结构基因 COL1A1 或COL1A2 突变所致。非经典的常染色体隐性遗传其致病基因种类多,但患者数量较少。
1979 年,Sillence 根据患者临床体征和影像学等特性将成骨不全分为 I~IV 型。其中,I 型最为轻微,无肢体变形;II 型为围产期致死型;III 型存在严重长骨畸形;IV 型介于 I 与 III 型之间,中等严重程度。I~IV 型均是由于 I 型胶原蛋白结构基因 COL1A1 或 COL1A2 发生突变所致。IV 型成骨不全患者临床表型差异很大,2000 年至 2002 年,加拿大 Glorieux 医生将 V~VII 型先后从 IV 型中分离出来[1]。目前对于成骨不全症的治疗适用于多学科综合性治疗,主要包括手术、物理康复加药物治疗[2]。对于传统的夹板、石膏、牵引等保守治疗,仅仅是减轻疼痛的暂时性措施。关于保守治疗对成骨不全患者的危害性,目前临床工作者仍然认识不足。2001 年 9 月至 2014 年 7 月,我科收治 1100 例成骨不全症患者。回顾性分析成骨不全症儿童下肢骨折经保守治疗后的远期结果及其并发症,探讨保守治疗导致成骨不全症儿童远期疗效不满意的原因,从而避免治疗失误。
资料与方法
一、一般资料
本组 1100 例,其中 Sillence 分型 I 型 376 例,III 型 320 例,VI 型 404 例;其中就诊时已经出现骨骺闭合者 437 例,其中既往反复下肢骨折均采用保守治疗 ( 牵引、夹板或者石膏固定 ) 且 X 线片资料完整者 45 例,男 30 例,女 15 例,Sillence 分型 I 型2 例,III 型 20 例,IV 型 23 例。就诊时平均年龄 17( 13~34 ) 岁。患者平均骨折 23 ( 12~43 ) 次。45 例中,股骨干骨折 627 次,胫骨骨折 534 次。
二、分析方法
分析患者的骨折次数、每次骨折的肢体固定时间,记录最终随访时的下肢功能、下肢骨骼的形态变化以及最终随访时的 X 线片表现。
结 果
45 例每次骨折均采用保守治疗,骨折后肢体固定时间平均 50 ( 30~90 ) 天,多数骨折可愈合,但30 例假关节形成 (图 1),骨骺过早闭合者 27 例。其中 30 例需要轮椅辅助活动,15 例可以拄拐辅助下短距离行走。患者临床表现为四肢畸形,下肢弯曲畸形角度为 45° ( 10~100 ) °。畸形呈渐进性发展,随着骨折次数增加,长骨弯曲畸形逐渐加重,骨骼多平面弯曲畸形。其中 15 例拄拐患者中,13 例为 IV 型,2 例为 I 型。
在 1100 例中,40% ( 440 例 ) 出现骺板提前闭合或者骺板生长紊乱导致肢体不等长,30% ( 330 例 )出现假关节。对比 X 线片,反复骨折需要长时间牵引或者石膏固定,患肢制动、不负重超过 6 个月以上者,X 线片显示骨质疏松异常加重。X 线片总体表现骨骼纤细、髓腔封闭、关节膨大,皮质变薄,骨骼多平面弯曲畸形。最终随访时,5% ( 55 例 )的患者完全卧床,30% ( 330 例 ) 需要轮椅、35%( 385 例 ) 可以拐杖辅助下短距离行走,30% ( 330 例 )可自行行走,部分伴有步态异常。30% ( 330 例 ) 因为矫形和内固定困难已无法进行任何骨科治疗。
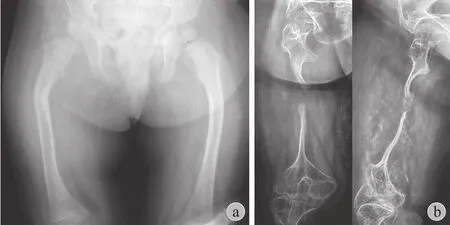
图1 患者,女 a:至 2 岁时右股骨干骨折 3 次,均保守治疗,尚能维持基本骨骼形态;b:患儿此后多次骨折均保守治疗,至16 岁时股骨纤细,髓腔消失,假关节形成Fig.1 Female a: The girl’s right femur had been broken 3 times until she was 2 years old. All the fractures were treated by conservative method. Except the curvature, the femur was almost normal. b: From then on, the girl had received fractures several times and all were treated conservatively as well. When she was 16 years old, the femur was slim, the medullary canal disappeared and pseudarthrosis was formed
讨 论
一、保守治疗的危害性
成骨不全症是以骨脆弱和骨畸形为临床特征的常染色体显性或隐性遗传缺陷的结缔组织病,成骨不全临床严重程度变化较大,既有严重的 II 型,在围产期即可出现患儿死亡,也有严重肢体畸形身材矮小的 III~VII 型,更有无明显畸形,仅表现为骨质脆弱、骨量减少的 I 型。患儿第一次骨折年龄越小,此后成长过程中出现的骨折次数越多,成骨不全的类型更严重,并且骨折多发生于下肢[2]。这与笔者的观察结果相符合,完全卧床者及需要轮椅者均为 III~IV 型。
患儿骨质脆弱很容易骨折,而一旦发生骨折,因为肌肉收缩作用导致畸形部位骨折加重,就产生骨折-畸形愈合-再骨折-再畸形愈合这样逐渐加重的恶性循环。因为下肢的严重弯曲易骨折,在应该学习站立的阶段无法站立,限制了神经肌肉的发育[3-4]。本组中 2 例 I 型成骨不全患者最终发展为需要拄拐辅助行走,主要原因是一侧肢体反复发生骨折,始终采取石膏保守治疗,同一部位多次骨折,造成长骨弯曲严重,下肢长度相差较大。对于 I 型成骨不全患者往往很少形成严重畸形,而当肢体在同一部位发生多次骨折后才会形成严重畸形,而此时髓内钉手术治疗是必需的[3]。本组 45 例完整资料中可以看到,患者整体表现为四肢畸形,骨骼多平面畸形,并且肢体畸形呈渐进式发展。因为采取保守治疗的错误方法,骨折次数越多,畸形越严重。
在 1100 例成骨不全症患者中,40% 出现骺板提前闭合或者骺板生长紊乱导致肢体不等长,约 30%出现假关节。骺板提前闭合或者骺板生长紊乱以股骨远端多见,其次为胫骨近端。骺板生长紊乱在X 线片表现为爆米花样改变,是骨骺即将闭合的标志[5]。对于爆米花样改变是因为长期患肢制动、不负重造成,还是只是严重的 III~IV 型成骨不全的放射学固有表现,目前还没有定论。但根据笔者的观察,长时间牵引或者石膏固定,制动、不负重超过6 个月以上者,出现爆米花样改变较多。
成骨不全患者的骨折愈合时间同健康人群相比无明显不同,多数骨折可愈合,但假关节出现占有一定几率。假关节在成骨不全比较普遍,有报道约占 20%[6-7],而笔者的统计约 30%。假关节的形成往往因为骨骼自身脆弱纤细导致多次骨折,并且采用不适当的固定方式,导致骨折延迟愈合或不愈合。肢体畸形及假关节形成严重限制肢体功能活动,加重骨质流失,因此形成骨折-制动-骨质疏松-再骨折这样的恶性循环,最终导致随访时 5% 的患者完全卧床,30% 需要轮椅,35% 可以拐杖辅助下短距离行走,30% 可自行行走,部分伴有步态异常。30% 因为矫形和内固定困难已无法进行任何骨科治疗。
二、成骨不全患者的治疗建议
目前对于成骨不全症的治疗适用于多学科综合性治疗,主要包括手术、物理康复加药物治疗,可以最大限度地提高功能活动独立性,达到最佳预后效果[2]。对于成骨不全骨折患者,强烈建议应用髓内钉固定,除非年龄很小[8]。尽管可延长髓内钉手术治疗有较高的并发症,但仍然被证明为成骨不全的最佳治疗方法,可以预防骨折、矫正畸形,即使对于最严重病例也能够改善行走能力[9-11]。对于传统的夹板、石膏、牵引等保守治疗,仅仅是减轻疼痛的暂时性措施,不能作为成骨不全治疗的最终方法。
二膦酸盐类药物用于治疗成骨不全已被广泛接受,主要作用为增加骨量,减少骨折几率,缓解骨痛,增加肌肉力量及提高活动能力,改善患者生活质量[12-18]。康复的目的是最大限度提高粗大运动能力,尤其在儿童时期非常重要[19]。康复应该个体化,针对不同的患儿,康复护理计划是不同的,绝对不能操之过急,要循序渐进,尤其要避免继发性骨折的出现。
[1] Rauc F, Glorieux FH. Osteogenesis imperfecta. Lancet, 2004,363(9418):1377-1385.
[2] Brizola E, Staub AL, Félix TM. Muscle strength, joint range of motion, and gait in children and adolescents with osteogenesis imperfecta. Pediatr Phys Ther, 2014, 26(2):245-252.
[3] Monti E, Mottes M, Fraschini P, et al. Current and emerging treatments for the management of osteogenesis imperfecta.Ther Clin Risk Manag, 2010, 6:367-381.
[4] Esposito P, Plotkin H. Surgical treatment of osteogenesis imperfecta: current concepts. Curr Opin Pediatr, 2008, 20(1):52-57.
[5] Renaud A, Aucourt J, Weill J, et al. Radiographic features of osteogenesis imperfecta. Insights Imaging, 2013, 4(4):417-429.
[6] Agarwal V, Joseph B. Non-union in osteogenesis imperfecta.J Pediatr Orthop B, 2005, 14(6):451-455.
[7] Gamble JG, Rinsky LA, Strudwick J, et al. Non-union of fractures in children who have osteogenesis imperfecta. J Bone Joint Surg Am, 1988, 70(3):439-443.
[8] Wolf H, Sarahrudi K, Vécsei V. Intramedullary osteosynthesis for fracture associated with osteogenesis imperfecta. Injury,2009, 40(3):315-320.
[9] Nicholas RW, James P. Telescoping intramedullary stabilization of the lower extremities for severe osteogenesis imperfecta.J Pediatr Orthop, 1990, 10(2):219-223.
[10] Luhmann SJ, Sheridan JJ, Capelli AM, et al. Management of lower-extremity deformities in osteogenesis imperfecta with extensible intramedullary rod technique: a 20-year experience.J Pediatr Orthop, 1998, 18(1):88-94.
[11] El-Adl G, Khalil MA, Enan A, et al. Telescoping versus nontelescoping rods in the treatment of osteogenesis imperfecta.Acta Orthop Belg, 2009, 75(2):200-208.
[12] Gatti D, Antoniazzi F, Prizzi R, et al. Intravenous neridronate in children with osteogenesis imperfecta:a randomized controlled study. J Bone Miner Res, 2005, 20(5):758-763.
[13] Letocha AD, Cintas HL, Troendle JF, et al. Controlled trial of pamidronate in children with types III and IV osteogenesis imperfecta confirms vertebral gains but not short-term functional improvement. J Bone Miner Res, 2005, 20(6):977-986.
[14] Vallo A, Rodriguez-Leyva F, Rodríguez Soriano J. Osteogenesis imperfecta: anthropometric, skeletal and mineral metabolic effects of long-term intravenous pamidronate therapy. Acta Paediatr, 2006, (3):332-339.
[15] Alharbi M, Pinto G, Finidori G, et al. Pamidronate treatment of children with moderate-to-severe osteogenesis imperfecta: a note of caution. Horm Res, 2009, 71(1):38-44.
[16] Phillipi CA, Remmington T, Steiner RD. Bisphosphonate therapy for osteogenesis imperfecta. Cochrane Database Syst Rev, 2008, (4):CD005088.
[17] Bishop N, Harrison R, Ahmed F, et al. A randomized, controlled dose-ranging study of risedronate in children with moderate and severe osteogenesis imperfecta. J Bone Miner Res, 2010,25(1):32-40.
[18] De Graaff F, Verra W, Pruijs JE, et al. Decrease in outpatient department visits and operative interventions due to bisphosphonates in children with osteogenesis imperfecta.J Child Orthop, 2011, 5(2):121-125.
[19] Forlino A, Cabral WA, Barnes AM, et al. New perspectives on osteogenesis imperfecta. Nat Rev Endocrinol, 2011, 7(9):540-557.
