一锅法合成含氨基葡萄糖分子片段的2-硫代喹唑啉二酮衍生物
2015-04-23刘玮炜程峰昌李曲祥霍云峰
刘玮炜,张 强,程峰昌,李曲祥,霍云峰
(1.淮海工学院 a.化学工程学院;b.江苏省海洋资源开发研究院,江苏连云港 222005;2.中国矿业大学化工学院,江苏徐州 221116)
喹唑啉酮类化合物具有良好的生物和生理活性,在医药和农药领域已被广泛应用。2-硫代喹唑啉二酮类化合物是喹唑啉酮类化合物中较为特殊的一类,其在多方面显示出优异的生物活性,如
抗肿瘤[1]、抗病毒[2]、抗惊厥[3]、抗癌[4-6]、调节细胞及酶的活性[7]以及杀虫和抗菌活性[8-9]等等。对2-硫代喹唑啉二酮类化合物进行化学修饰[10-11],可能会增强或改变其原有的生物活性。
D-氨基葡萄糖[12]及其衍生物不仅对治疗骨关节炎有独特的疗效,而且具有抗肿瘤、增强免疫力和抵抗力、杀菌消炎等生理活性[13-14]。鉴于此,借助于糖类药物的修饰或用糖类化合物改造其他活性物质思路,将具有多种活性的糖分子结构与2-硫代喹唑啉二酮结构进行骈合,有望扩展此类化合物的应用范围,进而开发出具有更高价值的喹唑啉酮衍生物。
本文以 1,3,4,6-四-O-苄基-β-D-氨基葡萄糖盐酸盐(1),2-硫代喹唑啉二酮(2a~2g)和固体光气为原料,采用一锅法合成了7个含氨基葡萄糖分子片段的2-硫代喹唑啉二酮衍生物(3a~3g,Scheme 1),其结构经1H NMR,FT-IR和HRESI-MS确证。在最佳反应条件[1,2-二氯乙烷为溶剂,三乙胺为碱,1 3 mmol,n(2b)∶n(1)=1.1 ∶1.0,回流反应8 h]下,3b 收率82%。
1 实验部分
1.1 仪器与试剂
1[15]和 2a ~ 2g[16]按文献方法合成;固体光气,国药集团化学试剂有限公司;其余所用试剂均为化学纯。
WRS-1B型数字熔点仪(温度未校正);Bruker ACF-300 Hz型核磁共振仪(DMSO-d6为溶剂,TMS为内标);FT-IR-Tensor-27型红外光谱仪(KBr压片);Agilent 6540 Q-TOF型质谱仪。
1.2 3a~3g的合成通法
在反应瓶中依次加入1,2-二氯乙烷10 mL,饱和碳酸氢钠溶液15 mL和1 1.72 g(3 mmol),搅拌使其溶解;冰水浴冷却,加入固体光气0.32 g(1.1 mmol),反应至终点(TLC检测)。分液,有机层用饱和食盐水洗涤,无水硫酸镁干燥。缓慢滴加2 3.3 mmol的 1,2-二氯乙烷(5 mL)溶液,滴毕,反应至终点(TLC检测)。旋蒸除溶后用乙醚(3×20 mL)洗涤{或乙醇-水溶液重结晶,或经硅胶柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=2 ∶1]纯化},真空干燥得3a~3g。
3a:黄色固体,收率79%,m.p.205℃ ~207℃;1H NMR δ:7.98(d,J=7.5 Hz,1H,CH),7.76(m,1H,CH),7.54(s,1H,CH),7.43 ~7.08(m,24H,PhH),6.35(d,J=8.0 Hz,1H,NH),5.65(m,2H,CH2),4.70~4.62(m,3H,1-H,CH2),4.59 ~4.41(m,6H,CH2),3.83 ~3.47(m,6H,2 ~6,6'-H);IR ν:3 362(NH),2 974,2 898(CH2,CH),1 657(C=O),1 536(Ph),1 260(C=S),1 050(C -O -C)cm-1;HR-ESIMS m/z:Calcd for C48H45N3O8SNa{[M+Na]+}846.282 0,found 846.282 5。
3b:白色固体,收率82%,m.p.236℃ ~237℃;1H NMR δ:8.16(d,J=7.9 Hz,1H,PhH),7.88(m,1H,PhH),7.67(d,J=8.1 Hz,1H,PhH),7.55(m,1H,PhH),7.41~7.12(m,21H,PhH),7.22 ~7.12(m,4H,PhH),6.34(d,J=7.8 Hz,1H,NH),5.32(m,2H,CH2),4.83 ~4.59(m,3H,1-H,CH2),4.58 ~4.42(m,6H,CH2),3.82 ~ 3.45(m,6H,2 ~ 6,6'-H);IR ν:3 442(NH),3 027,2 922,2 865(CH2),1 663(C=O),1 553(Ph),1 261(C=S),1 066(C -O -C)cm-1;HR-ESI-MS m/z:Calcd for C50H47N3O7SNa{[M+Na]+}856.302 7,found 856.302 5。
3c:淡黄色固体,收率64%,m.p.245℃ ~247℃;1H NMR δ:8.16 ~8.04(m,2H,PhH),8.33 ~8.04(m,1H,PhH),8.03 ~7.86(m,1H,PhH),7.85~7.72(m,1H,PhH),7.66(m,2H,PhH),7.60 ~6.95(m,22H,PhH),6.34(d,J=8.1 Hz,1H,NH),4.86~4.53(m,3H,1-H,CH2),4.51~4.43(m,6H,CH2),3.65 ~3.45(m,6H,2 ~6,6'-H);IR ν:3 443(NH),2 962,2 853(CH2),1 660(C=O),1 548(Ph),1 261(C=S),1 063(C-O-C)cm-1;HR-ESI-MS m/z:Calcd for C49H44ON37SNa{[M+Na]+}876.248 1,found 876.248 5。
3d:淡黄色固体,收率62%,m.p.256℃ ~257 ℃;1H NMR δ:8.18 ~8.11(m,2H,PhH),8.13~8.03(m,2H,PhH),7.95(m,1H,PhH),7.86(m,2H,PhH),7.80~7.01(m,21H,PhH),6.35(d,J=8.0 Hz,1H,NH),4.96 ~4.53(m,3H,1-H,CH2),4.50~4.44(m,6H,CH2),3.66~3.45(m,6H,2 ~6,6'-H);IR ν:3 450(NH),2 967,2 859(CH2),1 662(C=O),1 555(Ph),1 263(C=S),1060(C-O-C)cm-1;HR-ESI-MS m/z:Calcd for C49H44N3O7SNa{[M+Na]+}876.248 1,found 876.248 6。
3e:白色固体,收率62%,m.p.223℃ ~225℃;1H NMR δ:7.95(m,1H,PhH),7.79(s,1H,PhH),7.47 ~6.93(m,26H,PhH),6.33(d,J=8.1 Hz,1H,NH),4.85 ~ 4.56(m,3H,1-H,CH2),4.52~4.41(m,6H,CH2),3.85(m,3H,OCH3),3.70 ~3.46(m,6H,2 ~6,6'-H);IR ν:3 451(NH),3 029,2 922,2 867(CH3,CH2),1 670(C=O),1 537(Ph),1 261(C=S),1 067(C-O-C)cm-1;HR-ESI-MS m/z:Calcd for C50H47N3O8SNa{[M+Na]+}872.297 6,found 872.297 1。
3f:白色固体,收率79%,m.p.225℃ ~226℃;1H NMR δ:8.05(m,2H,PhH),7.82(m,2H,PhH),7.57 ~6.95(m,24H,PhH),6.33(d,J=8.7 Hz,1H,NH),4.95 ~ 4.61(m,3H,1-H,CH2),4.58~4.45(m,6H,CH2),3.84(m,3H,OCH3),3.75 ~3.45(m,6H,2 ~6,6'-H);IR ν:3 455(NH),3 030,2 923(CH3,CH2),1 668(C=O),1 533(Ph),1 263(C=S),1 057(C-O -C)cm-1;HR-ESI-MS m/z:Calcd for C50H47N3O8SNa{[M+Na]+}872.297 6,found 872.297 2。
3g:白色固体,收率71%,m.p.210℃ ~212℃;1H NMR δ:8.11(d,J=7.3 Hz,1H,PhH),7.86(d,J=8.0 Hz,1H,PhH),7.68(d,J=8.4 Hz,1H,PhH),7.54(d,J=7.1 Hz,1H,PhH),7.23(m,24H,PhH),6.35(d,J=8.2 Hz,1H,NH),4.86 ~4.58(m,3H,1-H,CH2),4.56 ~4.47(m,6H,CH2),4.11(d,J=6.9 Hz,2H,CH2),3.70 ~3.51(m,6H,2 ~6,6'-H),1.37(s,3H,CH3);IR ν:3 443(NH),3 029,2 923,2 854(CH3,CH2),1 635(C=O),1 533(Ph),1 261(C=S),1 066(C -O -C)cm-1;HR-ESI-MS m/z:Calcd for C51H49N3O8SNa{[M+Na]+}886.313 3,found 886.313 6。
2 结果与讨论
2.1 实验方法选择
以1与2b反应合成3b为模型反应,对实验方法(即分步法和一锅法)进行比较。
(1)分步法
1和固体光气反应,经硅胶柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=3∶1]纯化得2-脱氧-2-异氰酸酯-1,3,4,6-四-O-苄基-β-D-吡喃葡萄糖(4);4再与2b反应合成3b,收率63%。
(2)“一锅法”
1和固体光气反应,不分离4,直接与2b反应合成3b,收率82%。
从收率看,一锅法优于分步法;且一锅法简化了处理步骤,缩短了反应时间。
2.2 反应条件优化
以一锅法合成3b为模型反应,考察原料配比r[n(2b)∶n(1)],反应温度和时间,碱类型以及反应溶剂对反应的影响,寻找最佳反应条件。
(1)r
1 3 mmol,其余反应条件同1.2,考察 r对3b收率的影响,结果见表1。从表1可见,r对收率影响较大;当 r=1.1时,收率最佳(82%);r<1.1时,TLC和碘蒸汽检测发现出现少量副产物,推断为中间体自身聚合所致,为产物提纯带来困难;当r>1.1时,收率没有明显变化。最佳r=1.1。

表1 r对3b产率的影响*Table 1 Effect of r on the yield of 3b
(2)反应温度
r=1.1,其余反应条件同 2.2(1),考察反应温度对3b收率的影响,结果见表2。

表2 反应温度对3b产率的影响*Table 2 Effect of reaction temperature on the yield of 3b
从表2可见,温度对该反应影响也较大;随着温度升高,收率增加,在回流温度时,收率最高(82%)。回流温度为该反应的最佳反应温度。
(3)反应时间
r=1.1,回流反应,其余反应条件同 2.2(1),考察反应时间对3b收率的影响,结果见表3。从表3可见,反应时间对该反应影响较小。时间8 h后收率没有明显提高,TLC和碘蒸汽检测初步显示1基本反应完全。最佳的反应时间为8 h。
(4)碱
r=1.1,回流反应 8 h,其余反应条件同 2.2(1),考察碱对3b收率的影响,结果见表4。从表4可见,不加碱时,其收率比加入碱时低得多,推断原因为碱性环境利于亲核反应的进行。从表4还可见,无机碱较有机碱更有利于反应的进行;最佳碱为三乙胺。
(5)溶剂
考虑1和光气在溶剂中溶解性及溶剂本身沸点对反应的影响,综合多方面因素选用1,2-二氯乙烷为反应溶剂。
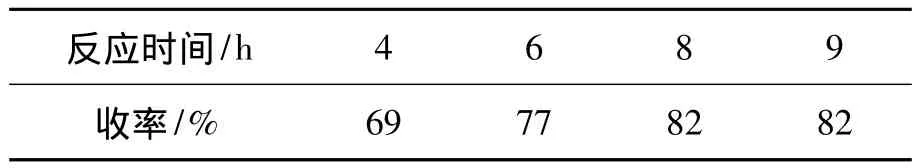
表3 反应时间对3b产率的影响*Table 3 Effect of reaction time on the yield of 3b

表4 碱类型对3b产率的影响*Table 4 Effect of different alkaline on the yield of 3b
综上所述,合成3b的最佳反应条件为:1,2-二氯乙烷为溶剂,三乙胺为碱,1 3 mmol,n(2b)∶n(1)=1.1 ∶1.0,回流反应8 h,收率82%。
3 结论
以 1,3,4,6-四-O-苄基-β-D-氨基葡萄糖盐酸盐、固体光气、2-硫代喹唑啉酮化合物为原料,采用“一锅法”合成了7种2-硫代喹唑啉二酮衍生物。“一锅法”不仅比分步法产率高,而且还避免了分离和提纯不稳定的中间产物,并且缩短了反应时间,省去了提纯中间产物的步骤和时间,简化了处理步骤。
该方法对于合成多种具有代表性的目标化合物具有较强的适应性,为合成该类化合物的方法和工艺条件提供参考。
[1]Mhaske S B,Argade N P.The chemistry of recently isolated naturally occurring quinazolinone alkaloids[J].Tetrahedron,2006,62(42):9787 -9826.
[2]Wissner A,Overbeek E,Reich M F,et al.Synthesis and structure-activity relationships of 6,7-disubstituted 4-anilinoquinoline-3-carbonitriles.The design of a n orally active,irreversible inhibitor of the tyrosine kinase activity of the epidermal growth factor receptor(EGFR)and the human epidermal growth factor receptor-2(HER-2)[J].Journal of Medicinal Chemistry,2003,46(1):49-63.
[3]Jatav V,Mishra P,Kashaw S,et al.Synthesis and CNS depressant activity of some novel 3-(5-substituted 1,3,4-thiadiazole-2-yl)-2-styryl quinazoline-4-(3H)-ones[J].European Journal of Medicinal Chemistry,2008,43(1):135 -141.
[4]Liu L T,Yuan T T,Liu H H,et al.Synthesis and biological evaluation of substituted 6-alkynyl-4-anilinoquinazoline derivatives as potent EGFR inhibitors[J].Bioorganic & Medicinal Mhemistry Letters,2007,17(22):6373-6377.
[5]Liu G,Hu D Y,Jin L H,et al.Synthesis and bioactivities of 6,7,8-trimethoxy-N-aryl-4-aminoquinazoline derivatives[J].Bioorganic & Medicinal Chemistry,2007,15(20):6608 -6617.
[6]Marsham P R,Hughes L R,Jackman A L,et al.Quinazoline antifolate thymidylate synthase inhibitors:Heterocyclic benzoyl ring modifications[J].Journal of Medicinal Chemistry,1991,34(5):1594 -1605.
[7]Xu G F,Song B A,Bhadury P S,et al.Synthesis and antifungal activity of novel s-substituted 6-fluoro-4-alkyl(aryl)thioquinazoline derivatives[J].Bioorganic &Medicinal Chemistry,2007,15(11):3768 -3774.
[8]高兴文,蔡学建,严凯,等.4(3H)-喹唑啉酮类Schiff碱的合成与抗烟草花叶病毒活性[J].有机化学,2008,28(10):1785 -1791.
[9]丁明武,杨尚君,陈云峰.2-烷氧基-3H-喹唑啉-4-酮的合成与杀菌活性[J].有机化学,2004,24(8):923 -926.
[10]陈舒忆,吕同杰,严和平,等.喹唑啉类衍生物的合成及其抗肿瘤活性[J].合成化学,2013,21(1):92-95.
[11]鲍小平,刘军虎,张峰,等.含1,2,4-三唑硫醚单元的新型喹唑啉酮类衍生物的合成及其抗菌活性[J].合成化学,2013,21(2):200 -203.
[12]Ghosh S,Blumenthal H J,Davidson E,et al.Glucosamine metabolism V.Enzymatic synthesis of glucosamine 6-phosphate[J].JournalofBiological Chemistry,1960,235(5):1265 -1273.
[13]Quastel J H.Inhibition of tumour growth by D-glucosamine[J].Nature,1953,171:252 -254.
[14]Nagaoka I,Igarashi M,Hua J,et al.Recent aspects of the anti-inflammatory actions of glucosamine[J].Carbohydrate Polymers,2011,84(2):825 -830.
[15]Aly M R E,Schmidt R R.New diacylamino protecting groups for glucosamine[J].European Journal of Organic Chemistry,2005,20:4382 -4392.
[16]刘玮炜,张强,霍云峰,等.微波一锅法合成2-硫代喹唑啉二酮衍生物[J].化学试剂,2014,36(4):367-369.
