新型N-(取代芳氧乙酰胺基)-N'-(1-甲基环己基酰基)硫脲及其环合产物的合成及其杀虫活性
2015-04-23穆金霞贡云芸孙召慧刘幸海谭成侠
蓝 健,穆金霞,贡云芸,孙召慧,刘幸海,谭成侠
(1.浙江工业大学化学工程学院,浙江杭州 310032;2.中国计量学院 环境工程系,浙江杭州 310018)
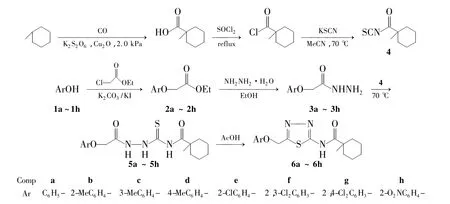
Scheme 1
芳氧乙酸类化合物具有较强的植物生理活性,被广泛应用于除草剂和植物生长调节剂。优良的内吸性除草剂 2,4-D(2,4-二氯苯氧乙酸)和新一代APP类(芳氧苯氧丙酸酯类)除草剂禾草灵是其中的代表产品。芳氧苯氧丙酸酯类化合物是一类高效防除禾本科杂草的除草剂,具有高效、低毒和低残留的特点,也是一类发展较迅速、不断开发出新品种的除草剂类型,比如氰氟草酯、高效氟吡甲禾灵等。出于环境与生态的考虑及科技的进步,对农药安全性和有效性的追求,未来世界农药的发展方向必将为低毒、低残留、高生物活性和高选择性,芳氧苯氧丙酸酯类除草剂等光学活性农药具有广泛的应用前景[1-4]。
1,3,4-噻二唑作为一类重要的生理活性基团,具有广谱的生物活性,如杀虫、杀菌、抗病毒、调节植物生长及抗癌等[5-7];酰基硫脲类化合物同样具有广泛的生物活性,如除草、杀菌、植物生长调节等[8-15]。为了寻找较高活性的农药先导化合物,本文采用亚结构拼接法,将苯氧乙酸类结构引入到酰基硫脲中,设计并合成了8个新型的硫脲类化合物——N-(取代苯氧乙酰胺基)-N'-(1-甲基环己基酰基)硫脲(5a~5h);5a~5h在酸性条件下关环形成8个新型的含1,3,4-噻二唑的酰胺类化合物——1-甲基-N-(5-取代基-1,3,4-噻二唑-2-基)环氧甲酰胺(6a~6h)(Scheme 1),其结构经1H NMR和ESI-MS表征。并初步测定了5a~5h对朱砂叶螨、蚕豆蚜、粘虫和稻飞虱的抑制活性。
1 实验部分
1.1 仪器与试剂
X-4型数字显示熔点仪(温度未校正);Bruker AvanceⅢ500 MHz型全数字化傅立叶超导核磁共振仪(CDCl3为溶剂,TMS为内标);LCQ-Advantage型质谱仪。
1-甲基环己基羧酸参考文献方法[16]合成[收率 66.2%,m.p.38 ℃ ~ 39 ℃[16];1H NMR δ:12.01(s,1H,CO2H),2.06 ~ 1.99(m,2H,CH2),1.57 ~1.24(m,8H,CH2),1.21(s,3H,CH3)];1a~1h,阿拉丁;朱砂叶螨、蚕豆蚜、粘虫和稻飞虱,国家南方农药创制中心浙江化工研究院生测中心自养;其余所用试剂均为分析纯。
1.2 合成
(1)1-甲基环己基酰基异硫氰酸酯(4)的合成
在单口烧瓶中加入1-甲基环己基羧酸7.1 g(50 mmol)和 SOCl211.9 g(100 mmol),搅拌下于室温反应1 h;回流反应2 h。蒸除未反应的SOCl2得淡黄色透明液体1-甲基环己基甲酰氯,密封保存备用。
在三口烧瓶中加入乙腈20 mL和KSCN 7.28 g(75 mmol),搅拌下于70℃ ~75℃缓慢滴加1-甲基环己基甲酰氯的乙腈(20 mL)溶液,滴毕,于70℃ ~75℃反应1 h。抽滤,滤液为桔红色透明液体4,密封保存备用。
(2)取代芳氧乙酸乙酯(2a~2h)的合成通法
在单口瓶中依次加入1 50 mmol,丙酮20 mL,氯乙酸乙酯7.32 g(60 mmol),K2CO38.28 g(60 mmol)以及KI 50 mg,搅拌下回流反应至终点(GC监测)。冷却至室温,旋蒸除去丙酮,加入冰水100 mL,用氯仿(3×100 mL)萃取,合并萃取液,依次用10%NaOH溶液、水和饱和NaCl溶液洗涤,无水Na2SO4干燥过夜;脱溶得淡黄色透明液体2a~2d或无色至淡黄色固体2e~2h。
(3)取代芳氧乙酰肼的合成(3a~3h)的合成通法
在反应瓶中加入2 7.5 mL和乙醇20 mL,冰水浴冷却,搅拌下缓慢滴加85%水合肼3 g(50 mmol),滴毕,回流反应4 h。冷却至室温,倒入100 g冰水中,析出白色固体;抽滤,滤饼用水(3×20 mL)洗涤,干燥后用10%乙醇重结晶得白色晶体3a~3h。
(4)5a~5h的合成通法
在单口瓶中加入4 1.10 g(6 mmol)和乙腈20 mL,搅拌使其溶解;加入3 5 mmol,于70℃ ~75℃反应3 h;于室温反应过夜(TLC检测)。蒸除溶剂,用混合溶剂[V(氯仿)∶V(乙醇)=3∶1]重结晶得白色粉末5a~5g和淡黄色粉末5h。
N-(苯氧乙酰胺基)-N'-(1-甲基环己基酰基)硫脲(5a):收率75.4%,m.p.132℃ ~133℃;1H NMR δ:13.28(s,1H,CONH),10.12(s,1H,NHCS),8.47(s,1H,NHCO),7.38 ~7.34(m,2H,ArH),7.07(ddd,J=5.0 Hz,2.0 Hz,1.0 Hz,1H,ArH),6.99(ddd,J=5.0 Hz,3.0 Hz,2.0 Hz,2H,ArH),4.71(s,2H,OCH2),1.99 ~1.93(m,2H,CH2),1.59 ~1.38(m,8H,CH2),1.26(s,3H,CH3);ESI-MS m/z:350.0{[M+H]+}。
N-(2-甲基-苯氧乙酰胺基)-N'-(1-甲基环己基酰基)硫脲(5b):收率77.2%,m.p.160℃ ~161 ℃;1H NMR δ:13.37(s,1H,CONH),10.30(s,1H,CONH),8.46(s,1H,NHCO),7.20(dd,J=10.0 Hz,4.0 Hz,2H,ArH),7.00 ~6.95(m,1H,ArH),6.80(d,J=8.0 Hz,1H,ArH),4.70(s,2H,OCH2),2.40(s,3H,CH3),2.00 ~1.93(m,2H,CH2),1.62~1.35(m,8H,CH2),1.26(s,3H,CH3);ESI-MS m/z:364.0{[M+H]+}。
N-(3-甲基-苯氧乙酰胺基)-N'-(1-甲基环己基酰基)硫脲(5c):收率72.7%,m.p.150℃ ~151℃;1H NMR δ:10.27(s,1H,CONH),7.22 ~7.17(m,1H,ArH),6.86 ~6.79(m,3H,ArH),5.42(s,2H,OCH2),2.35(s,3H,CH3),2.16 ~2.03(m,2H,CH2),1.66 ~1.40(m,8H,CH2),1.33(s,3H,CH3);ESI-MS m/z:364.0{[M+H]+}。
N-(4-甲基-苯氧乙酰胺基)-N'-(1-甲基环己基酰基)硫脲(5d):收率77.1%,m.p.162℃ ~163 ℃;1H NMR δ:13.26(s,1H,CONH),10.10(s,1H,CONH),8.46(s,1H,NHCO),7.16~7.12(m,2H,ArH),6.91~6.86(m,2H,ArH),4.68(s,2H,OCH2),2.32(s,3H,CH3),2.00 ~1.91(m,2H,CH2),1.61 ~1.35(m,8H,CH2),1.25(s,3H,CH3);ESI-MS m/z:364.0{[M+H]+}。
N-(2-氯-苯氧乙酰胺基)-N'-(1-甲基环己基酰基)硫脲(5e):收率80.5%,m.p.162 ℃ ~163℃;1H NMR δ:13.31(s,1H,CONH),10.35(s,1H,CONH),8.49(s,1H,NHCO),7.45 ~7.42(m,1H,ArH),7.30 ~7.25(m,2H,ArH),7.05 ~7.00(m,1H,ArH),6.93(dd,J=8.0 Hz,1.0 Hz,1H,ArH),4.74(s,2H,OCH2),1.99~1.94(m,2H,CH2),1.62~1.35(m,8H,CH2),1.26(s,3H,CH3);ESI-MS m/z:384.0{[M+H]+}。
N-(2,3-二氯-苯氧乙酰胺基)-N'-(1-甲基环己基酰基)硫脲(5f):收率 83.2%,m.p.176℃ ~179 ℃;1H NMR δ:13.30(s,1H,CONH),10.34(s,1H,CONH),8.49(s,1H,NHCO),7.24~7.19(m,2H,ArH),6.88~6.82(m,1H,ArH),4.74(s,2H,OCH2),1.99 ~ 1.94(m,2H,CH2),1.58 ~1.35(m,8H,CH2),1.26(s,3H,CH3);ESI-MS m/z:418.0{[M+H]+}。
N-(2,4-二氯苯氧乙酰胺基)-N'-(1-甲基环己基酰基)硫脲(5g):收率 83.7%,m.p.207℃ ~208 ℃;1H NMR δ:13.31(s,1H,CONH),10.31(s,1H,CONH),8.49(s,1H,NHCO),7.45(d,J=3.0 Hz,1H,ArH),7.26 ~7.23(m,1H,ArH),6.88 ~6.85(m,1H,ArH),4.72(s,2H,OCH2),1.97(m,2H,CH2),1.63 ~1.35(m,8H,CH2),1.26(s,3H,CH3);ESI-MS m/z:346.0[M -2Cl]。
N-(2-硝基-苯氧乙酰胺基)-N'-(1-甲基环己基酰基)硫脲(5h):收率79.4%,m.p.192℃ ~195 ℃;1H NMR δ:13.09(s,1H,CONH),10.22(s,1H,CONH),8.56(s,1H,NHCO),7.89(dd,J=8.0 Hz,2.0 Hz,2H,ArH),7.55(ddd,J=9.0 Hz,8.0 Hz,2.0 Hz,2H,ArH),4.85(s,2H,OCH2),1.96(m,2H,CH2),1.57 ~1.40(m,8H,CH2),1.26(s,3H,CH3);ESI-MS m/z:377.0[M -OH]。
(5)6a~6h的合成通法
在单口瓶中加入5 5 mmol和冰醋酸20 mL,搅拌下回流反应至终点(TLC检测)。冷却至室温,加冰水100 mL,析出淡黄色固体,静置过夜;抽滤,滤饼用水(3×20 mL)洗涤,干燥后用乙醇重结晶得6a~6h{6a和6h需经硅胶柱层析纯化[洗脱剂:V(石油醚)∶V(乙酸乙酯)=2∶1]}。
1-甲基-N-[5-(苯氧甲基)-1,3,4-噻二唑-2-基)环氧甲酰胺(6a):米黄色粉末,收率86.7%,m.p.143 ℃ ~145 ℃;1H NMR δ:10.00(s,1H,CONH),7.35 ~7.30(m,2H,ArH),7.04 ~6.99(m,3H,ArH),5.45(s,2H,OCH2),2.12 ~2.01(m,2H,CH2),1.60~1.38(m,8H,CH2),1.32(s,3H,CH3);ESI-MS m/z:332.1{[M+H]+}。
1-甲基-N-[5-(2-甲基-苯氧甲基)-1,3,4-噻二唑-2-基]环氧甲酰胺(6b):白色粉末,收率85.3%,m.p.149 ℃ ~150 ℃;1H NMR δ:10.70(s,1H,CONH),7.22 ~ 7.15(m,2H,ArH),6.94(t,J=8.0 Hz,2H,ArH),5.45(s,2H,OCH2),2.30(s,3H,CH3),2.19 ~ 2.09(m,2H,CH2),1.67 ~1.41(m,8H,CH2),1.37(s,3H,CH3);ESI-MS m/z:346.2{[M+H]+},368.1{[M+Na]+}。
1-甲基-N-[5-(3-甲基-苯氧甲基)-1,3,4-噻二唑-2-基]环氧甲酰胺(6c):咖啡色粉末,收率86.2%,m.p.156 ℃ ~159 ℃;1H NMR δ:10.29(s,1H,CONH),7.21 ~7.17(m,1H,ArH),6.85 ~6.82(m,3H,ArH),5.42(s,2H,OCH2),2.35(s,3H,CH3),2.15 ~2.06(m,2H,CH2),1.66 ~1.41(m,8H,CH2),1.33(s,3H,CH3);ESI-MS m/z:346.4{[M+H]+},368.3{[M+Na]+}。
1-甲基-N-[5-(4-甲基-苯氧甲基)-1,3,4-噻二唑-2-基]环氧甲酰胺(6d):淡黄色粉末,收率82.3%,m.p.172 ℃ ~174 ℃;1H NMR δ:10.54(s,1H,CONH),7.21 ~ 7.18(m,2H,ArH),6.92 ~ 6.86(m,2H,ArH),5.43(s,2H,OCH2),2.34(s,3H,CH3),2.17 ~ 2.08(m,2H,CH2),1.67 ~1.41(m,8H,CH2),1.36(s,3H,CH3);ESI-MS m/z:346.1{[M+H]+},368.2{[M+Na]+}。
1-甲基-N-[5-(2-氯-苯氧甲基)-1,3,4-噻二唑-2-基]环氧甲酰胺(6e):淡黄绿色粉末,收率89.4%,m.p.139 ℃ ~142 ℃;1H NMR δ:10.47(s,1H,CONH),7.43 ~7.39(m,1H,ArH),7.22(ddd,J=8.0 Hz,8.0 Hz,2.0 Hz,1H,ArH),7.08(dt,J=9.0 Hz,3.0 Hz,1H,ArH),7.01 ~ 6.94(m,1H,ArH),5.50(s,2H,OCH2),2.18 ~2.05(m,2H,CH2),1.66 ~1.41(m,8H,CH2),1.34(s,3H,CH3);ESI-MS m/z:366.7{[M+H]+}。
1-甲基-N-[5-(2,3-二氯-苯氧甲基)-1,3,4-噻二唑-2-基]环氧甲酰胺(6f):淡灰色粉末,收率87.7%,m.p.169 ℃ ~ 171 ℃;1H NMR δ:10.34(s,1H,CONH),7.22 ~7.20(m,2H,ArH),6.85(dd,J=6.4 Hz,3.2 Hz,1H,ArH),5.74(s,2H,OCH2),2.00 ~1.92(m,2H,CH2),1.57 ~1.34(m,8H,CH2),1.32(s,3H,CH3);ESI-MS m/z:401.2{[M+H]+}。
1-甲基-N-[5-(2,4-二氯-苯氧甲基)-1,3,4-噻二唑-2-基]环氧甲酰胺(6g):淡黄褐色粉末,收率89.3%,m.p.171 ℃ ~172 ℃;1H NMR δ:10.22(s,1H,CONH),7.41(d,J=3.0 Hz,1H,ArH),7.19(dd,J=9.0 Hz,3.0 Hz,1H,ArH),7.02(d,J=9.0 Hz,1H,ArH),5.49(s,2H,OCH2),2.17 ~2.05(m,2H,CH2),1.64 ~1.40(m,8H,CH2),1.33(s,3H,CH3);ESI-MS m/z:401.2{[M+H]+}。
1-甲基-N-[5-(2-硝基-苯氧甲基)-1,3,4-噻二唑-2-基]环氧甲酰胺(6h):淡黄色粉末,收率89.8%,m.p.159 ℃ ~162 ℃;1H NMR δ:10.69(s,1H,CONH),7.74(dd,J=8.0 Hz,2.0 Hz,2H,ArH),7.47(ddd,J=9.0 Hz,8.0 Hz,2.0 Hz,2H,ArH),5.84(s,2H,OCH2),2.01 ~1.96(m,2H,CH2),1.59 ~ 1.43(m,8H,CH2),1.27(s,3H,CH3);ESI-MS m/z:377.3{[M+H]+}。
1.3 杀虫活性测试(浸渍法)
粘虫:将适量剪好的玉米叶段在配好的药液中充分浸润后自然阴干,放入垫有滤纸的培养皿中,接粘虫3龄中期幼虫15头/皿,加盖标记后置于观察室内饲养和观察。3 d后检查结果。以毛笔轻触虫体,无反应视为死虫。
小菜蛾:将萝卜苗在药液中充分浸润后自然阴干,放入培养皿中,接3龄中期幼虫,加盖标记后置于观察室内。试验重复4次。3 d后检查结果。以毛笔轻触虫体,无反应视为死虫。
朱砂叶螨:将蚕豆叶片打成叶碟,背面朝上放在小块棉花上,置于塑料培养皿内,加少量水,接朱砂叶螨成螨。待成螨于叶片上稳定后,将叶片在药液中充分浸润5 s后迅速用吸水纸吸去叶片表面水滴,重新置于棉花上,风干。试验重复4次。3 d后检查结果。以毛笔轻触虫体,不能正常爬行为死虫。
苜蓿蚜:将蚕豆叶片剪去两端,背面朝上放在小块棉花上,置于塑料培养皿内,加少量水,接苜蓿蚜成蚜以产若蚜。24 h后去除成蚜,继续培养2 d后将叶片在药液中充分浸润5 s后,重新置于棉花上,自然凉干。1 d后检查结果。以毛笔轻触虫体,无反应视为死虫。
统计各处理的死虫数和活虫数,计算校正死亡率(Abbott’s公式)。
2 结果与讨论
2.1 合成
(1)2的合成
2的合成通常是碱性条件下,取代酚在丙酮或乙醇等溶剂中与氯乙酸乙酯或者溴乙酸乙酯反应。实验中,我们曾不加催化剂KI,TLC跟踪发现,10 h反应完全。但含有强吸电子基团(例如邻硝基苯酚)时,时间会有所增加。可能是该反应是亲核取代反应,吸电子基不利于形成酚钾负离子,因此阻碍了反应的进行。当加入催化量的KI时,反应时间大幅度缩短。可能是KI首先与氯乙酸乙酯发生取代反应,形成碘代乙酸乙酯,而I的离去能力强于Cl和Br,降低了整个反应的能垒,所以使得整个反应更加容易进行。
实验中考察了不同的碱对反应的影响,结果发现:只有 K2CO3才能使反应正常进行,而以Na2CO3为碱时,反应12 h反应也未完成。可能是碱性太弱,无法与取代酚生成酚钠,阻碍了反应的进行;NaOH和KOH会使反应液后期变得黏稠,且氯乙酸乙酯消失、酚不消失,可能是强碱性条件下,氯乙酸乙酯与体系中微量的水发生水解反应生成了氯乙酸的钠盐,致使反应液变黏稠。
(2)5的合成
在5的合成中,反应温度控制在70℃ ~75℃。因为酰肼类在乙腈中溶解度较低,适当升温能促进溶解,加速反应;但若温度过高,未反应的4可能会发生聚合,使得反应液颜色加深,降低反应收率。
(3)6的合成
1-酰基-4-芳酰基氨基硫脲作为酰基硫脲类的一种,可在酸性或碱性条件下分别关环得1,3,4-噻二唑酰胺和 1,2,4-三氮唑硫酮两类化合物。
本文用5为原料,分别在酸或碱性条件下关环,结果发现:5只能在酸性条件下关环生成6。可能是5在酸性条件下发生了脱水,进而关环的过程;而在碱性条件下则得不到预期产物6,可能是发生了降解,生成终产物7(Chart 1)。
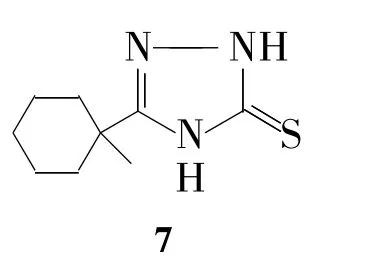
Chart 1
2.2 表征
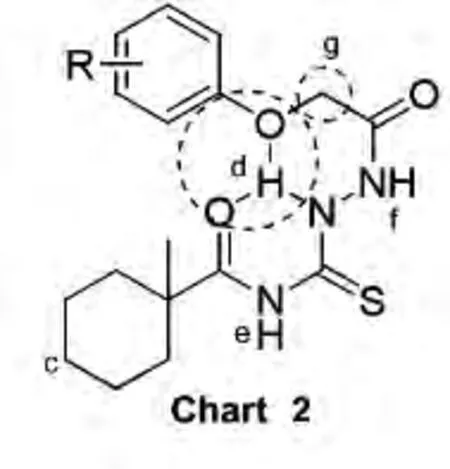
通过5a~5h的1H NMR谱图解析得出如下规律:(1)甲基环己环的共振信号均出现在 δ 1.0 ~2.0(Chart 2);δ 1.3附近的尖锐单峰归属甲基环己环的CH3;在δ 1.5~2.0间的两处多重峰中,δ 2.0附近的多重峰归属环己基 c-H;δ 1.5~2.0附近的多重峰则归属环己基对称的4处H。(2)δ 6.0~8.0间还会出现归属于芳环氢的信号,且该处信号的裂分情况与芳环上取代基的个数和位置基本吻合。(3)在低场的活泼H区域内,则多出3个活泼氢的信号(Chart 2),其中δ 13.0~14.0处吸收峰属于d处的活泼氢NH;δ 10.0处吸收峰归属 e处的活泼 NH;δ 8.0~9.0间吸收峰归属f处的活泼NH,可能的原因是d-H受到两处氧原子的分子内氢键作用,去屏蔽作用更大,所以明显向低场移动,而e-NH因为受到CONHCS的作用比f处的要大一点,所以应该会出现在 δ 10.0 附近。(4)δ 4.0 ~5.0 间还会出现一个属于g-CH2的碳氢单峰信号(Chart 2)。可能是因为受到来自芳环和氧原子的吸电子以及氧原子的σ-π超共轭作用的共同影响。此外5b~5d和5h还会在δ 2.0~3.0间还会出现归属于芳环上CH3单峰,原因可能是甲基都处在芳环的去屏蔽区域,因此比普通的甲基氢要向低场偏移。
2.3 杀虫活性
5a~5h对粘虫、小菜蛾、朱砂叶螨和苜蓿蚜的抑制活性结果为:在用药量为500 mg·L-1时,5a~5h对朱砂叶螨、蚕豆蚜、和稻飞虱均没有活性,只有5g对粘虫有80%的抑制率。
3 结论
以取代苯酚为起始原料,经亲核反应制得取代芳氧乙酸乙酯,然后经与水合肼反应得取代芳氧乙酰肼,进一步与1-甲基环己基酰基异硫氰酸酯反应合成了8个新颖的1-酰基-4-芳酰胺基硫脲化合物。
生物活性测试结果发现:5g在用药量为500 mg·L-1时对粘虫有80%的抑制率。
[1]刘博宏,叶非.芳氧苯氧基丙酸酯类除草剂的应用进展[J].农药科学与管理,2011,32(2):20-25.
[2]金丽霞.手性三唑类杀菌剂和芳氧苯氧丙酸类除草剂高效液相色谱对映体分离[D].杭州:浙江工业大学,2011.
[3]秦永华.芳氧苯氧丙酸酯类除草剂的研究进展[J].宁波大学学报(理工版),2007,20(3):381 -384.
[4] 吴发远,张爽,高金胜.高效氟吡甲禾灵合成方法的探索研究[J].中国西部科技,2011,10(9):06 -08.
[5]刘玉婷,晏会新,尹大伟,等.2,5-二取代-1,3,4-噻二唑类化合物的合成及应用研究[J].精细化工中间体,2009,39:8 -12.
[6]赵云,欧阳贵平,徐维明,等.4-(1,3,4-噻二唑-2-巯基)苯并[4,5]呋喃[3,2-d]嘧啶类衍生物合成、晶体结构及抗癌活性[J].有机化学,2010,30:1093 -1097.
[7]宋新建,邵宇,段正超,等.含1,3,4-噻二唑环吡唑并[3,4-d]嘧啶类化合物的合成及生物活性[J].有机化学,2012,32:755 -759.
[8]管谦,薛思佳.吡啶甲酰硫脲嘧啶衍生物的合成及生物活性研究(Ⅳ)[J].华中师范大学学报,2002,36:181-184.
[9]Chen Hansong,Li Zhengming,Han Yufeng.Synthesis and fungicidal activity against Rhizoctonia solani of 2-alkyl(alkylthio)-5-pyrazolyl-1,3,4-oxadiazoles(thiadiazoles)[J].J Agric Food Chem,2000,48:5312 -5315.
[10]柳闪星.含1,3,4-噻二唑的酰基硫脲化合物的合成表征及生物活性的研究[D].郑州:郑州大学,2012.
[11]宋新建,邵宇,段正超,等.含1,3,4-噻二唑环吡唑并[3,4-d]嘧啶类化合物的合成及生物活性[J].有机化学,2012,32:1755 -759.
[12]葛成林,欧阳桂平,贺宝安,等.含1,3,4-噻二唑的噻吩类化合物的合成与杀菌活性研究[J].精细化工中间体,2012,42:17 -21.
[13] 吴玮琳,杨曼丽,叶文法,等.N-(安替比林-4-基)-N'-取代芳甲酰基硫脲的合成及其生物活性[J].有机化学,2005,25:1291 -1293.
[14]吴玮琳,叶文法,杨曼丽,等.含氮杂环的芳甲酰基硫脲的合成及其生物活性[J].合成化学,2005,13:581-583.
[15]孙晓红,刘源发,王慧芳.硫脲衍生物的合成和生物活性研究[J].化学工程,2006,34:54 -57.
[16]Heinz L,Ingrid M,Christoph R.Synthesis of13C—O-labelled tertiary alkanoic acids by the Koch-haafreaction[J].Tetrahedron Lett,1981,22(25):2365 -2366.
