新型含 1,3,4- 噻二唑基的苯并[4,5]呋喃[3,2-d]嘧啶类化合物的合成及其抗癌活性*
2015-04-23朱红梅秦俊虎欧阳贵平
朱红梅,秦俊虎,欧阳贵平
(1.贵阳市白云区环境监测站,贵州贵阳 550014;2.贵阳市乌当区环境监测站,贵州 贵阳 550018;3.贵州大学药学院,贵州贵阳 550025)
近年来,苯并呋喃嘧啶类化合物因其结构与喹唑啉类化合物结构相似而备受关注。研究表明:苯并呋喃嘧啶类化合物是一类重要的小分子酪氨酸激酶抑制剂,目前已成为抗癌新药研发的一个重要方向[1]。同时,大量文献还报道了1,3,4-噻二唑类衍生物因其具抗菌、抗炎、抗惊厥及抗癌等广泛的生物活性而在新药物分子设计中备受关注[2],尤其是2-氨基噻二唑被作为抗癌药物以后[3],已经有许多噻二唑类化合物被合成以用于抗癌活性构效关系研究[4]。
近年来,本课题组[5-6]一直致力于具有高抗癌活性苯并呋喃嘧啶类化合物的研究,在前期研究基础上,本文采用亚活性基团拼接法,将1,3,4-噻二唑杂环引入到苯并呋喃嘧啶结构中,设计并合成了6个新型含1,3,4-噻二唑基的苯并呋喃嘧啶类化合物(5a~5f)。以取代苯胺为起始原料,合成了中间体 5-N-苯基-2-巯基-1,3,4-噻二唑(3a~3f);3a~3f分别与4-氯苯并呋喃[3,2-d]嘧啶(4)经取代反应合成了5a~5f(Scheme 1),其结构经1H NMR,13C NMR,IR和ESI-MS表征。并采用MTT法对5a~5f进行抑制人胃癌细胞(MGC-803)体外增殖活性测试。
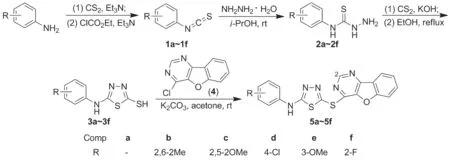
Scheme 1
1 实验部分
1.1 仪器与试剂
X-4型数字显微熔点仪(温度未校正);JOELECX500型核磁共振仪(DMSO-d6为溶剂,TMS为内标);VECTOR 22型红外光谱仪(KBr压片);Agilent 1100 MSD-Trap-VL型质谱仪。
3a ~ 3f[7-9]和 4[10-13]按文献方法合成;其余所用试剂均为分析纯,使用前经常规处理。
1.2 5a~5f的合成(以5a为例)
在反应瓶中依次加入丙酮25 mL和3a 0.21 g(1 mmol),搅拌使其溶解;加入碳酸钾0.28 g(2 mmol)和4 0.2 g(1 mmol),于室温反应 7 h(TLC检测)。减压蒸除溶剂,加入10 mL冰水,过滤,滤饼干燥后用DMF/H2O重结晶得白色固体5a。
用类似方法合成5b~5f。
5a:白色固体,收率74.1%,m.p.244℃ ~246 ℃;1H NMR δ:10.75(s,1H,NH),9.06(s,1H,2-H),8.27(d,J=8.0 Hz,1H,ArH),7.96(d,J=8.6 Hz,1H,ArH),7.87(t,J=8.6 Hz,1H,ArH),7.63(m,3H,ArH),7.40(t,J=8.0 Hz,2H,ArH),7.08 ~7.05(t,J=7.2 Hz,1H,ArH);13C NMR δ:168.2,157.5,153.2,148.7,148.3,144.4,142.4,141.3,138.9,133.2,129.6,125.1,124.1,122.8,121.6,119.3,114.6,113.3;IR ν:3 441,2 941,1 618,1 564,1 543,1 502,1 427,1 377,1 192,1 143,1 068,871,750 cm-1;ESI-MS m/z:400.0{[M+Na]+}。
5b:黄色固体,收率69%,m.p.229℃ ~231 ℃;1H NMR δ:9.91(s,1H,NH),9.03(s,1H,2-H),8.26(d,J=8.0 Hz,1H,ArH),7.86(m,2H,ArH),7.61(t,J=7.5 Hz,1H,ArH),7.18(s,3H,ArH),2.26(s,6H,CH3);13C NMR δ:173.6,157.5,153.3,148.6,148.2,144.4,140.9,138.1,135.9,133.2,129.1,127.9,125.6,122.9,121.2,113.5,18.4;IR ν:3 443,2 918,2 856,1 624,1 566,1 537,1 469,1 425,1 369,1 193,1 139,1 064,869,748 cm-1;ESIMS m/z:428.5{[M+Na]+}。
5c:黄色固体,收率68.6%,m.p.106℃ ~107 ℃;1H NMR δ:10.21(s,1H,NH),9.05(s,1H,2-H),8.27(d,J=8.0 Hz,1H,ArH),8.06 ~8.04(m,1H,ArH),7.96(d,J=8.6 Hz,1H,ArH),7.87(t,J=7.7 Hz,1H,ArH),7.62(t,J=7.5 Hz,1H,ArH),7.01(d,J=8.5 Hz,1H,ArH),6.63 ~ 6.61(m,1H,ArH),3.84(s,3H,OCH3),3.73(s,3H,OCH3);13C NMR δ:169.2,157.6,153.9,153.6,148.6,147.9,144.5,143.8,143.1,133.2,130.3,125.6,122.9,121.2,113.8,112.5,107.2,106.8,56.9,55.9;IR ν:3 446,2 954,2 827,1 625,1 570,1 541,1 489,1 438,1 371,1 197,1 143,1 066,873,748 cm-1;ESI-MS m/z:460.1{[M+Na]+}。
5d:白色固体,收率60.1%,m.p.>250 ℃;1H NMR δ:10.89(s,1H,NH),9.06(s,1H,2-H),8.27(d,J=7.5 Hz,1H,ArH),7.98(d,J=8.6 Hz,1H,ArH),7.67 ~ 7.83(m,2H,ArH),7.45(t,J=8.6 Hz,2H,ArH),7.14(d,J=8.6 Hz,2H,ArH);13C NMR δ:163.3,156.8,153.6,149.0,147.4,143.8,141.9,139.3,137.7,133.1,129.9,125.7,123.1,121.1,119.5,114.0;IR ν:3 442,3 037,1 622,1 571,1 544,1 498,1 440,1 375,1 193,1 147,1 066,873,759 cm-1;ESI-MS m/z:434.5{[M+Na]+}。
5e:黄色固体,收率62.8%,m.p.235℃ ~237 ℃;1H NMR δ:10.25(s,1H,NH),9.06(s,1H,2-H),8.27(d,J=8.0 Hz,1H,ArH),7.96(d,J=8.6 Hz,1H,ArH),7.82~7.72(m,2H,ArH),7.45 ~7.32(m,2H,ArH),7.09(d,J=8.0 Hz,1H,ArH),6.85(s,1H,ArH),3.85(s,3H,OCH3);13C NMR δ:172.1,158.2,153.7,148.6,147.6,145.9,144.5,142.1,136.2,133.1,129.6,125.4,123.5,122.8,121.5,119.8,113.5,112.3,54.8;IR ν:3 444,2 846,1 620,1 570,1 541,1 456,1 440,1 373,1 247,1 147,1 066,871,761 cm-1;ESI-MS m/z:430.1{[M+Na]+}。
5f:黄色固体,收率52.7%,m.p.>250 ℃;1H NMR δ:10.60(s,1H,NH),9.08(s,1H,2-H),8.25(d,J=8.1 Hz,1H,ArH),7.96(d,J=8.0 Hz,1H,ArH),7.86(t,J=8.0 Hz,1H,ArH),7.71(m,2H,ArH),7.65(t,J=7.5 Hz,1H,ArH),7.24(m,2H,ArH);13C NMR δ:170.1,161.2,158.4,157.9,153.9,149.7,147.8,145.1,143.4,136.9,133.5,126.0,123.0,121.5,120.15,117.3,115.2,112.1;IR ν:3 460,1 620,1 575,1 541,1 454,1 398,1 369,1 282,1 197,1 066,873,761 cm-1;ESIMS m/z:428.1{[M+Na]+}。
1.3 体外抗癌活性测定
以DMSO为参照,阿霉素(ADM)为对照药剂。采用噻唑兰(MTT)比色法测定了5a~5f对人胃腺癌细胞(MGC-803)的抑制率。将MGC-803细胞接种于96孔细胞培养板中,每孔2 200个细胞。在37℃,5%CO2饱和湿度的条件下培养24 h,加入含处理因子的1 640培养基(200 μL/孔)。设空白对照和溶媒对照。每组4个平行,继续培养 72 h,加入 5 mg·mL-1MTT 20 μL培养4 h,于酶标仪上测定OD570值。最后以溶媒对照组作参比计算抑制率。
2 结果与讨论
2.1 表征
5的1H NMR分析表明,N-H中氢的吸收峰位于 δ 10.89 ~9.91,且呈单一的明显尖峰;嘧啶环上2-位氢的吸收峰通常位于 δ 9.08~9.03,且为单峰。在5的 IR谱图中,3 400 cm-1~3 460 cm-1处吸收峰为 N-H的伸缩振动峰,1 425 cm-1~1 625 cm-1处的吸收峰为苯环及嘧啶环吸收峰,属于环骨架振动峰。MS分析表明,5a~5f均出现了明显的分子离子峰。
2.2 体外抗癌活性
在用药浓度为 10 μmol·L-1时,5a ~ 5f对人胃癌细胞(MGC-803)的抑制率见表1。

表1 5对MGC-803癌细胞的抑制率*Table 1 Inhibition rates of MGC-803 cells with 5
由表1可见,部分化合物对MGC-803表现出一定的抑制活性。其中,4-[5-N-(2,6-二甲基苯基)-1,3,4-噻二唑-2-巯基]苯并[4,5]呋喃[3,2-d]嘧啶(5b),4-[5-N-(2,5-二甲氧基苯基)-1,3,4-噻二唑-2-巯基]苯并[4,5]呋喃[3,2-d]嘧啶(5c)和 4-[5-N-(3-甲氧基苯基)-1,3,4-噻二唑-2-巯基]苯并[4,5]呋喃[3,2-d]嘧啶(5e)对 MGC-803癌细胞抑制率分别为89.5%,88.9%和70.2%。简单构效关系研究表明,当苯环上引入Cl和F等吸电基团时,会使化合物的抑制活性下降;当在苯环上引入甲基和甲氧基等供电基时,化合物的抑制活性显著提高。究其原因:可能是由于供电基团的引入,提高了苯并呋喃环和噻唑环的电子云密度,使得化合物与MGC-830癌细胞特异性酶的亲和性提高,进而使得化合物的抑制活性提高。
3 结论
以取代苯胺为起始原料,合成了6个新型含1,3,4-噻二唑基的苯并呋喃嘧啶类化合物(5a~5f)。部分化合物对MGC-803细胞具有良好的抑制活性,其中5b,5c和5e的抑制率分别为89.5%,88.9%和70.2%。
[1]Hurley L H,Mahadevan D,Bearss D J,et al.Protein kinase inhibitors[P].WO 2 005 037 825,2005.
[2]Schenone S,Brullo C,Bruno O,et al.New 1,3,4-thiadiazole derivatives endowed with analgesic and antiinflammatory activities[J].Bioorg Med Chem,2006,14(6):1698-1705.
[3]Asbury R F,Wilson J,Blessing J A,et al.Aminothiadiazole(NSC#4728)in patients with advanced ovarian carcinoma.a phaseⅡstudy of the gynecologic oncology group[J].Am J Clin Onco1,1986,9(4):334 -336.
[4]Holla B S,Rao B S,Gonsalves R,et al.Synthesis of some new biologically active thiadiazolotriazinones-partⅢ[J].Farmaco,2002,57(8):693 - 696.
[5]赵云,欧阳贵平,杜才富,等.杂环取代苯并[4,5]呋喃[3,2-d]嘧啶类衍生物的合成及其抗癌活性[J].合成化学,2011,19(3):321 -324.
[6]朱红梅,秦俊虎,欧阳贵平.新型4-(5-N-取代-1,3,4-噻二唑-2-巯基)-苯并[4,5]呋喃[3,2-d]嘧啶类衍生物的合成及其抗癌活性[J].合成化学,2012,20(2):156-160.
[7]Hodgkins J E,Reeves W P.The modified kaluza synthesis.Ⅲ.The synthesis of some aromatic isothiocyanates[J].J Org Chem,1964,29:3098 -3099.
[8]Huang H,Chen Q,Ku X,et al.A series of α-heterocyclic carboxaldehyde thiosemicarbazones inhibit topoisomerase Ⅱ α catalytic activity[J].J Med Chem,2010,53:3048 -3064.
[9]Chu C H,Hui X P,Xu P F,et al.Synthesis and antifungal activities of ω-(5-arylamino-1,3,4-thiadiazol-2-thio)-ω-(1H-1,2,4-triazol-1-yl)acetophenones[J].Indian J Chem,Sect B:Org Chem Incl Med Chem,2002,41:2436 -2438.
[10]Ando K,Tsuji E,Ando Y,et al.Syntheses of 3-acetoacetylaminobenzo[b]furan derivatives having cysteinyl leukotriene 2 receptor antagonistic activity[J].Org Biomol Chem,2004,2:625 -635.
[11]刘明国,胡扬根,程国平,等.3-氨基-2-苯并呋喃甲酸乙酯合成方法的改进[J].三峡大学学报,2007,29(2):174-175.
[12]Hollis Showalter H D,Bridges A J,Zhou H R,et al.Tyrosine kinase inhibitors.16.6,5,6-Tricyclic benzothieno[3,2-d]pyrimidines and pyrimido[5,4-b]and [4,5-b] indoles as potent inhibitors of the epidermal growth factor receptor tyrosine kinase[J].J Med Chem,1999,42:5464 -5474.
[13]Gerald G D A,North S,HansJurgen E H,et al.Benzothieno[3,2-d]and Benzofuro[3,2-d]pyrimidine[P].US 3 706 747,1972.
