新型庚铂衍生物的合成*
2015-04-23王德才
徐 伟,王德才
(1.南京理工大学泰州科技学院化工学院,江苏泰州 225300;2.南京工业大学药学院,江苏南京 210009)
庚铂(Chart 1),化学名为顺式-丙二酸[(4R,5R)-4,5-双-(氨甲基)-2-异丙基-1,3-二氧戊环]铂(Ⅱ),是韩国鲜京制药工业株式会社于1992年开始研发的新一代铂类抗癌药。1999年在韩国首次上市,临床上主要用于晚期不能手术的胃癌和小细胞肺癌等癌症的治疗[1-2]。与顺铂相比,庚铂具有毒副作用小、抗肿瘤作用强及临床疗效好[3-5]等特点。
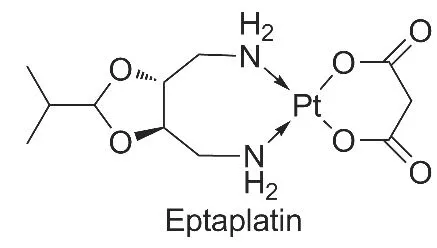
Chart 1
本文参考庚铂的合成与铂类抗癌药物作用机制的相关文献[2-3,6],合理避开庚铂在中国专利的基础上,以庚铂作为前体化合物,在不改变其母核的前提下对其进行结构修饰;同时参考Sbovata等[6]提出在铂类化合物中引入芳香基以提高其脂溶性,有利于化合物穿过细胞膜的思想,设计并合成了一系列将芳香基引入1,3-二氧戊环2-位庚铂的衍生物,以期获得比庚铂抗肿瘤活性更强、毒性更低且具有自主知识产权的铂类抗肿瘤药物。以D-酒石酸(1)与芳香醛(2a~2n)为起始原料,经缩合、氨解和还原反应制得中间体(4R,5R)-4,5-双(氨甲基)-1,3-二氧戊环类化合物(5a~5n)[7];5a~5n 分别与氯亚铂酸钾经配位反应合成了14个新型庚铂衍生物(6a~6n)[8];6a~6j依次与硝酸银和丙二酸钠反应合成了10个新型庚铂衍生物(7a~7j,Scheme 1),收率18.29% ~50.91%,其结构经1H NMR,ESI-MS和元素分析表征。
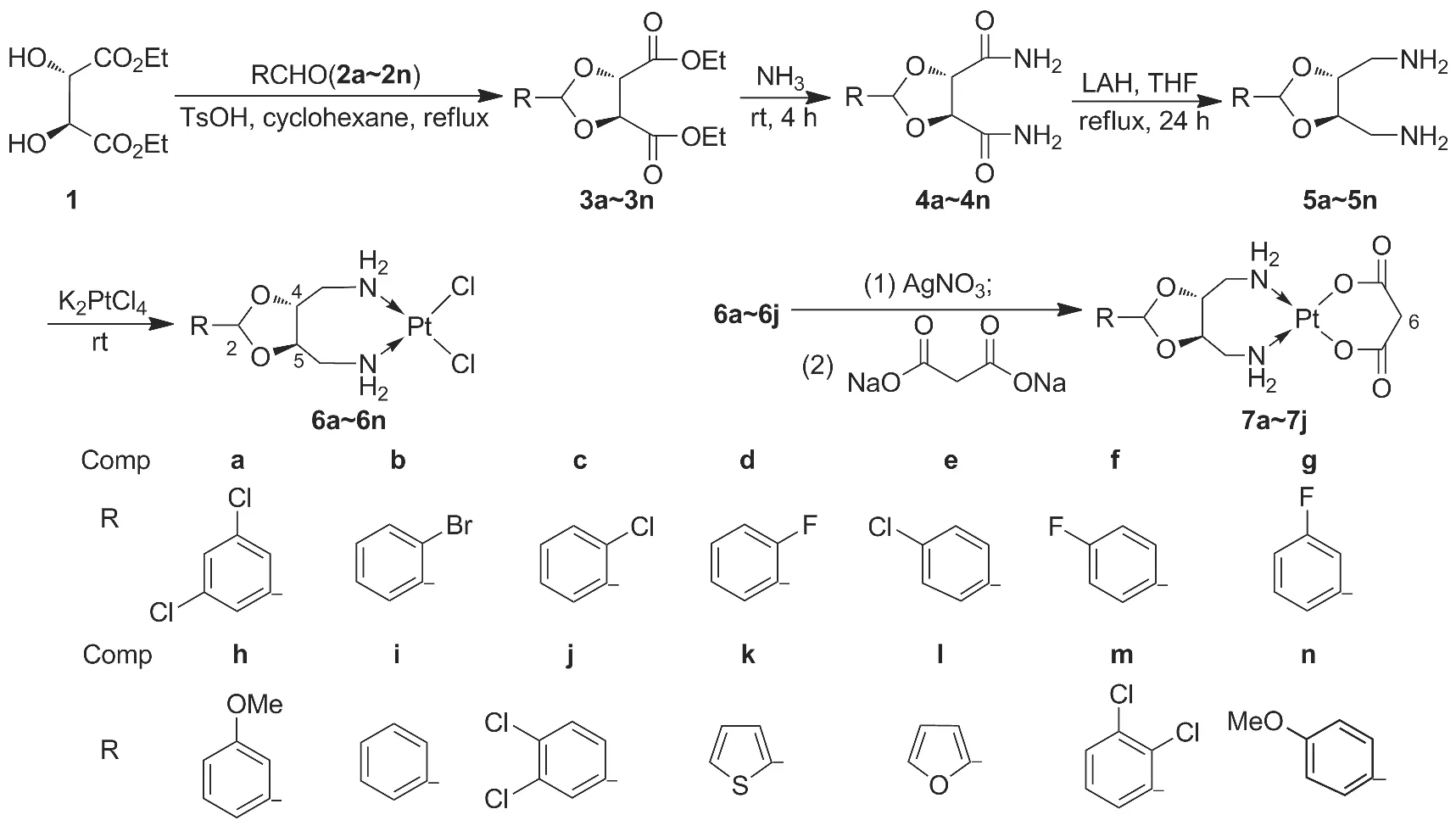
Scheme 1
1 实验部分
1.1 仪器与试剂
X4型显微熔点仪(温度未校正);Brucker DRX 300/500 MHz型核磁共振仪(DMSO-d6/D2O为溶剂,TMS为内标);API2000型液相色谱质谱联用仪(LC/MS/MS)。
所用试剂均为分析纯。
1.2 合成
(1)3a~3n 的合成(以3a 为例)[9]
在带分水器的三颈瓶中依次加入2a 17.4 g(0.10 mol),1 26.78 g(0.13 mol),对甲苯磺酸(TsOH)2.0 g和环己烷10 mL,搅拌下回流反应至无水分出。用水洗涤2次,用乙酸乙酯(3×50 mL)萃取,合并萃取液,用无水硫酸镁干燥,蒸去溶剂得淡黄色固体3a,直接进行下步反应。
用类似的方法合成3b~3n。
(2)4a~4n的合成(以4a为例)
在三颈瓶中加入3a和无水乙醇50 mL,通干燥氨气(NaOH干燥),搅拌下于室温反应4 h(TLC跟踪)。倒入水中析晶,过滤,滤饼用无水乙醇重结晶得白色粉末状晶体4a 6.95 g,两步收率67.7%。
用类似的方法合成4b~4n,收率分别为67.1%,69.8%,77.2%,66.3%,74.3%,78.1%,51.7%,55.7%,68.4%,69.3%,71.7%,71.7%和53.1%。
(3)5a~5n的合成(以5a为例)
在三颈瓶中加入四氢铝锂(LAH)3.45 g(82.3 mmol)和无水THF 100 mL,搅拌下回流反应0.5 h。冰浴冷却下缓慢滴加 4a 5.0 g(16.4 mmol)的THF(50 mL)溶液,滴毕,回流反应24 h(TLC跟踪)。依次滴加 H2O 3.45 mL,10%NaOH 溶液3.45 mL 和 H2O 10.4 mL。过滤,滤饼用二氯甲烷洗涤,合并滤液和洗液,用二氯甲烷(3×100 mL)萃取,合并萃取液,用无水硫酸镁干燥,浓缩后经硅胶柱层析[洗脱剂:V(二氯甲烷)∶V(甲醇)∶V(三乙胺)=100 ∶100 ∶1]纯化得淡黄色油状液体 5a 3.37 g,收率 67.3%。
用类似的方法合成5b~5n。5b,棕色油状液体,收率 65.7%;5c,黄色油状液体,收率67.1%;5d,无色油状液体,收率66.7%;5e,无色油状液体,收率63.7%;5f,黄色油状液体,收率62.7%;5g,黄色油状液体,收率60.2%;5h,无色油状液体,收率 60.2%;5i,无色油状液体,收率65.1%;5j,黄色油状液体,收率72.1%;5k,黄色油状液体,收率 55.2%;5l,黄色油状液体,收率76.1%;5m,黄色油状液体,收率60.1%;5n,无色油状液体,收率 61.7%。
(4)6a~6n的合成(以6a为例)
在三颈瓶中依次加入水10 mL和氯亚铂酸钾415 mg(1 mmol),搅拌下滴加5a 276 mg(1 mmol)水(10 mL)溶液,滴毕,于室温反应至不再析出固体。过滤,滤饼依次用水和无水乙醇洗涤,真空干燥得淡黄色固体6a 511 mg。
用类似的方法合成6b~6n。
6a:淡黄色固体,收率 94.5%,m.p.>250℃;1H NMR δ:7.56 ~7.14(m,3H,ArH),5.95(s,1H,2-H),4.88 ~ 4.55(m,2H,4,5-H),3.40~ 2.80(m,4H,CH2);ESI-MS m/z:542{[M+H]+},564{[M+Na]+};Anal.calcd for C11H14N2O2Cl4Pt:C 24.33,H 2.60,N 5.16,Pt 35.92;found C 24.31,H 2.58,N 5.13,Pt 35.95。
6b:棕色固体,收率94.5%,m.p.>250 ℃;1H NMR δ:7.42 ~7.21(m,4H,ArH),5.97(s,1H,2-H),4.78~4.57(m,2H,4,5-H),2.98~2.73(m,4H,CH2);ESI-MS m/z:553{[M+H]+},575{[M+Na]+};Anal.calcd for C11H15N2O2Cl2BrPt:C 23.89,H 2.73,N 5.06,Pt 35.27;found C 23.87,H 2.71,N 5.03,Pt 35.30。
6c:淡黄色固体,收率94.1%,m.p.>250℃;1H NMR δ:7.53 ~ 7.41(m,4H,ArH),6.01(s,1H,2-H),4.81 ~ 4.61(m,2H,4,5-H),3.19 ~2.87(m,4H,CH2);ESI-MS m/z:509{[M+H]+},547{[M+Na]+};Anal.calcd for C11H15N2O2Cl3Pt:C 25.97,H 2.97,N 5.51,Pt 38.35;found C 25.95,H 2.96,N 5.48,Pt 38.38。
6d:白色固体,收率96.8%,m.p.>250 ℃;1H NMR δ:7.60 ~7.21(m,4H,ArH),6.23(s,1H,2-H),4.97~4.89(m,2H,4,5-H),3.06~2.68(m,4H,CH2);ESI-MS m/z:491{[M -H]-},527{[M+Cl]-};Anal.calcd for C11H15N2O2FCl2Pt:C 23.84,H 3.07,N 5.69,Pt 39.63;found C 23.83,H 3.05,N 5.67,Pt 39.65。
6e:白色固体,收率96.1%,m.p.>250 ℃;1H NMR δ:7.49 ~7.43(m,4H,ArH),6.00(s,1H,2-H),4.78~4.55(m,2H,4,5-H),3.45~3.35(m,2H,CH2),3.32 ~ 2.86(m,2H,CH2);ESI-MS m/z:508{[M+H]+},546{[M+K]+};Anal.calcd for C11H15N2O2Cl3Pt:C 25.97,H 2.97,N 5.51,Pt 38.35;found C 25.95,H 2.94,N 5.49,Pt 38.37。
6f:白色固体,收率96.8%,m.p.>250℃;1H NMR δ:7.55 ~7.48(m,2H,ArH),7.25 ~7.18(m,2H,ArH),5.97(s,1H,2-H),5.05 ~4.72(m,2H,4,5-H),3.05 ~ 2.81(m,4H,CH2);ESI-MS m/z:491{[M -H]-},527{[M+Cl]-};Anal.calcd for C11H15N2O2FCl2Pt:C 26.84,H 3.07,N 5.69,Pt 39.63;found C 26.82,H 3.05,N 5.67,Pt 39.66。
6g:白色固体,收率93.4%,m.p.>250 ℃;1H NMR δ:7.35 ~7.21(m,4H,ArH),6.01(s,1H,2-H),4.91~4.75(m,2H,4,5-H),3.17~2.71(m,4H,CH2);ESI-MS m/z:512{[M+Na]+};Anal.calcd for C11H15N2O2FCl2Pt:C 26.84,H 3.07,N 5.69,Pt 39.63;found C 26.81,H 3.05,N 5.66,Pt 39.67。
6h:白色固体,收率95.1%,m.p.>250 ℃;1H NMR δ:7.36 ~7.31(m,1H,ArH),7.06 ~6.98(m,3H,ArH),5.96(s,1H,2-H),4.91 ~4.61(m,2H,4,5-H),3.76 ~ 3.57(m,3H,OCH3),3.46 ~3.16(m,2H,CH2),2.97 ~2.89(m,2H,CH2);ESI-MS m/z:504{[M+H]+},541{[M+K]+};Anal.calcd for C12H18N2O3Cl2Pt:C 28.58,H 3.60,N 5.56,Pt 38.69;found C 28.55,H 3.58,N 5.55,Pt 38.72。
6i:白色固体,收率95.2%,m.p.>250℃;1H NMR δ:7.41 ~7.48(m,5H,ArH),5.99(s,1H,2-H),4.82~4.88(m,2H,4,5-H),2.68~3.16(m,4H,CH2);ESI-MS m/z:509{[M+Cl]-},983{[2M+Cl]-};Anal.calcd for C11H16N2O2Cl2Pt:C 27.86,H 3.40,N 5.91,Pt 41.13;found C 27.84,H 3.38,N 5.89,Pt 41.15。
6j:白色固体,收率93.3%,m.p.>250℃;1H NMR δ:7.66 ~7.49(m,3H,ArH),6.15(s,1H,2-H),4.74~4.67(m,2H,4,5-H),3.13~2.92(m,4H,CH2);ESI-MS m/z:542{[M+H]+},575{[M+Cl]+},603{[M+Ac]+};Anal.calcd for C11H14N2O2Cl4Pt:C 24.33,H 2.60,N 5.16,Pt 35.92;found C 24.30,H 2.58,N 5.14,Pt 35.95。
6k:淡黄色固体,收率92.7%,m.p.>250℃;1H NMR δ:7.62(d,J=4.50 Hz,1H),7.24(d,J=2.10 Hz,1H),7.03 ~ 7.06(m,1H),6.32(s,1H,2-H),4.68 ~ 4.85(m,2H,4,5-H),2.63 ~3.17(m,4H,CH2);ESI-MS m/z:479{[M -H]-},515{[M+Cl]-},997{[2M+Cl]-};Anal.calcd for C9H14N2O2SCl2Pt:C 22.51,H 2.94,N 5.83,Pt 40.62;found C 22.49,H 2.91,N 5.81,Pt 40.65。
6l:白色固体,收率93.3%,m.p.>250℃;1H NMR δ:7.71 ~ 7.72(m,1H),6.58 ~ 6.62(m,1H),6.46~6.48(m,1H),6.08(s,1H,2-H),4.74 ~4.78(m,2H,4,5-H),2.63 ~3.17(m,4H,CH2);ESI-MS m/z:499{[M+Cl]-},963{[2M+Cl]-};Anal. calcdforC9H14N2O3Cl2Pt:C 23.29,H 3.04,N 6.03,Pt 42.02;found C 23.27,H 3.02,N 6.01,Pt 42.05。
6m:白色固体,收率 94.5%,m.p.>250℃;1H NMR δ:7.56 ~7.39(m,3H,ArH),6.00(s,1H,2-H),4.64 ~ 4.57(m,2H,4,5-H),3.09 ~ 2.82(m,4H,CH2);ESI-MS m/z:542{[M+H]+},565{[M+Na]+};Anal.calcd for C11H14N2O2Cl4Pt:C 24.33,H 2.60,N 5.16,Pt 35.92;found C 24.32,H 2.58,N 5.13,Pt 35.95。
6n:白色固体,收率94.8%,m.p.>250 ℃;1H NMR δ:7.36 ~7.31(m,1H,ArH),7.06 ~6.92(m,3H,ArH),5.91(s,1H,2-H),4.55 ~4.31(m,2H,4,5-H),3.80 ~ 3.71(m,3H,CH3),3.39~3.32(m,4H,CH2);ESI-MS m/z:541{[M+Na]+};Anal.calcd for C12H18N2O3Cl2Pt:C 28.58,H 3.60,N 5.56,Pt 38.69;found C 28.55,H 3.58,N 5.54,Pt 38.72。
(5)7a~7j的合成(以7a为例)
在西林瓶中依次加入6a 271 mg(0.5 mmol),H2O 5 mL和 AgNO3170 mg(1 mmol),搅拌下于室温避光反应24 h。过滤,滤液加入丙二酸二钠74 mg(0.5 mmol)水(10 mL)溶液,搅拌下于室温反应0.5 h。过滤,滤饼用水重结晶得7a 179 mg。
用类似的方法合成7b~7j。
7a:白色固体,收率62.3%,m.p.>250 ℃;1H NMR δ:7.53 ~7.22(m,3H,ArH),6.00 ~5.81(s,1H,2-H),4.81 ~4.52(m,2H,4,5-H),3.59 ~3.10(m,4H,NCH2),3.10 ~2.80(m,4H,NH2),2.80~2.60(m,2H,6-H);ESIMS m/z:575{[M+H]+},613{[M+K]+};Anal.calcd for C14H16N2O6Cl2Pt:C 29.28,H 2.81,N 4.88,Pt 33.97;found C 29.26,H 2.78,N 4.87,Pt 33.99。
7b:白色固体,收率63.3%,m.p.>250℃;1H NMR δ:7.53 ~ 7.19(m,4H,ArH),5.9(s,1H,2-H),5.41 ~5.21(m,4H,NCH2),4.79 ~4.59(m,2H,4,5-H),2.91 ~2.87(s,2H,6-H),2.80 ~ 2.71(m,4H,NH2);ESI-MS m/z:584{[M+H]+},645{[M+Ac]+};Anal.calcd for C14H17N2O6BrPt:C 28.78,H 2.93,N 4.79,Pt 33.39;found C 28.76,H 2.91,N 4.77,Pt 33.42。
7c:淡黄色固体,收率 65.5%,m.p.>250℃;1H NMR δ:7.55 ~7.31(m,4H,ArH),6.00(s,1H,2-H),5.62 ~ 5.49(m,4H,NCH2),4.81 ~4.61(m,4H,4,5-H),3.19 ~ 2.87(s,2H,6-H),2.87~2.61(m,4H,NH2);ESI-MS m/z:541{[M+H]+},579{[M+Na]+};Anal.calcd for C14H17N2O6ClPt:C 31.15,H 3.17,N 5.19,Pt 36.14;found C 31.13,H 3.15,N 5.17,Pt 36.17。
7d:白色固体,收率70.3%,m.p.>250 ℃;1H NMR δ:7.62 ~7.21(m,4H,ArH),6.22(s,1H,2-H),5.60~5.33(m,4H,NCH2),4.86 ~4.54(m,2H,4,5-H),3.09(s,2H,6-H),2.93~2.89(m,4H,NH2);ESI-MS m/z:522{[M -H]-},557{[M+Cl]-},584{[M+Ac]-};Anal.calcd for C14H17N2O6FPt:C 32.13,H 3.27,N 5.35,Pt 37.27;found C 32.11,H 3.25,N 5.33,Pt 37.30。
7e:淡黄色固体,收率 63.8%,m.p.>250℃;1H NMR δ:7.43 ~7.38(m,4H,ArH),5.97(s,1H,2-H),5.76 ~5.52(m,2H,4,5-H),4.92 ~4.61(m,4H,NCH2),2.82 ~ 2.72(s,2H,6-H),2.72~2.52(m,4H,NH2);ESI-MS m/z:540{[M+H]+},563{[M+Na]+},575{[M+Cl]+};Anal.calcd for C14H17N2O6ClPt:C 31.15,H 3.17,N 5.19,Pt 36.14;found C 31.13,H 3.15,N 5.17,Pt 36.17。
7f:白色固体,收率65.4%,m.p.>250℃;1H NMR δ:7.54 ~7.49(m,2H,ArH),7.25 ~7.19(m,2H,ArH),5.99(s,1H,2-H),5.42 ~5.21(m,4H,NCH2),4.60 ~4.79(m,2H,4,5-H),3.02(s,2H,6-H),2.71 ~ 2.92(m,4H,NH2);ESI-MS m/z:557{[M+Cl]+},584{[M+Ac]-};Anal.calcd for C14H17N2O6FPt:C 32.13,H 3.27,N 5.35,Pt 37.27;found C 32.11,H 3.25,N 5.32,Pt 37.29。
7g:白色固体,收率63.8%,m.p.>250 ℃;1H NMR δ:7.22 ~7.47(m,4H,ArH),5.98(s,1H,2-H),5.44~5.62(m,4H,NCH2),4.61 ~4.74(m,2H,4,5-H),3.28(s,2H,6-H),3.02~2.72(m,4H,NH2);ESI-MS m/z:524{[M+H]+},546{[M+Na]+};Anal.calcd for C14H17N2O6FPt:C 32.13,H 3.27,N 5.35,Pt 37.27;found C 32.10,H 3.25,N 5.32,Pt 37.30。
7h:白色固体,收率61.8%,m.p.>250 ℃;1H NMR δ:7.31 ~7.23(m,1H,ArH),7.04 ~6.99(m,3H,ArH),5.92(s,1H,2-H),4.73(m,2H,4,5-H),3.75(s,3H,OCH3),3.49 ~3.29(s,2H,6-H),2.86 ~2.73(m,4H,NH2);ESI-MS m/z:536{[M+H]+};Anal.calcd for C15H20N2O7Pt:C 33.65,H 3.77,N 5.23,Pt 36.44;found C 33.63,H 3.75,N 5.20,Pt 36.46。
7i:白色固体,收率62.5%,m.p.>250℃;1H NMR δ:7.40 ~7.46(m,5H,ArH),5.96(s,1H,2-H),5.42~5.64(m,4H,NCH2),4.57 ~4.78(m,2H,4,5-H),3.03(s,2H,6-H),2.68~2.72(m,4H,NH2);ESI-MS m/z:527{[M+Na]+};Anal.calcd for C14H18N2O6Pt:C 33.27,H 3.59,N 5.54,Pt 38.60;found C 33.25,H 3.57,N 5.52,Pt 38.63。
7j:白色固体,收率61.3%,m.p.>250 ℃;1H NMR δ:7.76 ~7.47(m,3H,ArH),6.21(s,1H,2-H),5.95(m,4H,CH2),4.79~4.58(m,2H,4,5-H),3.33 ~3.17(s,2H,6-H),2.85 ~2.74(m,4H,NH2);ESI-MS m/z:574{[M+H]+};Anal.calcd for C14H16N2O6Cl2Pt:C 29.28,H 2.81,N 4.88,Pt 33.97;found C 29.26,H 2.79,N 4.86,Pt 33.99。
2 结果与讨论
2.1 合成
文献报道中间体5a~5n的合成,不仅步骤多、成本高、总收率较低,而且反应条件较为苛刻,中间体需离子交换分离,不适宜工业化生产。本文将六步反应缩减为三步,收率从18.7%提高至41.5%。
在3a~3n的合成中,芳香醛无α-氢存在,不存在醛自身缩合的副反应。影响反应的相关因素包括1与2的投料比、反应时间、催化剂用量和反应温度等。通过反应条件的优化确定最佳条件为:n(1)∶n(2)=1.3 ∶1,催化剂用量占反应物总质量的4.5%,于100℃反应6 h。
在4a~4n的合成中,NH3是亲核试剂,进攻3的羰基碳原子,脱去两分子乙醇得产物酰胺。该步反应理论上很容易进行,实际操作过程中需注意氨气的干燥。
在5a~5n的合成中,酰胺的还原有催化氢化还原和氢化金属络合物还原等方法[10]。催化氢化法需在高温高压条件下进行;氢化金属络合物还原可将酰胺还原为一级胺或二级胺,且具有反应条件温和、反应速度快、反应收率高和选择性好等特点。本文通过探讨底物与LAH的物质量之比、反应时间对收率结果的影响,确定最佳反应条件为:n(4)∶n(LAH)=1∶5,油温80℃,反应液温度75℃,回流反应24 h。
3 结论
对庚铂1,3-二氧戊环2-位C原子进行结构修饰,合成了24个新型的庚铂衍生物,以期为药物合成及药物筛选提供依据。该合成工艺具有成本低廉和操作简单等优点,为庚铂以及铂类化合物的合成提供了实验数据与理论依据。相关化合物的药理活性将另文报道。
[1]肖远,黄平.新一代铂类抗肿瘤药——依铂(eptaplatin)[J].世界临场医药,2003,24(6):379 -380.
[2]Kim D K,Kim H T,Cho Y B,et al.Anticancer activity of cis-malonato [(4R,5R)-4,5-bis(aminomethyl)-2-isopropyl-1,3-dioxoane] platinum(Ⅱ),a new platinum analogue,as an anticancer agent[J].Cancer Chemotherapy and Pharmacology,1995,44(5):441 -445.
[3]Hong W S,Kim H T,Kim K H,et al.In vitro antitumor activity of a new platinum complex,cis-malonato[(4R,5R)-4,5-bis(aminomethyl)-2-isopropyl-1,3-dioxoane]platinum(Ⅱ)(SKI 2053R),against human stomach and lung cancer cell lines[J].Anticancer Research,1995,15(1):51 -54.
[4]Ahu M J,Oh H S,Choi J H,et al.Combination chemotherapy of Heptaplatin,Paclitaxel and 5-Fluorouracil in patients with adcanced gastric cancer:A pilot study[J].Cancer Research and Treatment,2004,36(3):182-186.
[5]Lee W S,Lee G W,Kim H W,et al.A PhaseⅡ trial of Heptaplatin/5-FU and Leucovorin for advanced stomach cancer[J].Cancer Research and Treatment,2005,37(4):208 -211.
[6]Sbovata S M,Bettio F,Mozzon M.Cisplatinum and transplatinum complexes with benzyliminoether ligands;Synthesis,characterization,structure-activity relationships,and In Vitro and In Vivo antitumor efficacy[J].Journal of Medical Chemistry,2007,50(19):4775-4784.
[7] 王德才,江建,欧阳平凯,等.(4R,5R)-4,5-双(胺甲基)-1,3-二氧戊环类化合物的制备方法[P].CN 1 911 926,2006.
[8]金大起,金康赫,甘钟植,等.铂配合物的制备方法[P].CN 1 204 650,1990.
[9] 王德才,徐伟,葛恒平,等.(4S,5S)-4,5-双(胺甲酰基)-1,3-二氧戊环类化合物的合成[J].合成化学,2010,18(3):335 -337.
[10]于世钧,郭宏.LiAIH4和NaBH4的还原反应[J].辽宁师范大学学报,2003,26(1):56 -58.
