新型苯并二氮卓类化合物的合成*
2015-04-23石富强董金丽
石富强,董金丽,张 龙
(长春工业大学化学工程学院,吉林长春 130012)
三环类苯并二氮卓具有广泛的生理活性和药理作用,是目前药物化学领域研究的热点。如苯并二氮卓类化合物(Chart 1)具有抗焦虑、镇静催眠、抗惊厥、肌肉松弛、安定等作用[1-10],在医学上常用作镇静剂和治疗心血管疾病的药物;吡啶并苯并二氮卓类化合物如哌仑西平(Chart 1)具有抑制胃分泌的的作用和抗细胞毒素、抗HIV-1的性能[11];嘧啶并苯并二氮卓类化合物如奈韦拉平类似物(Chart 1)具有抗细胞毒素和抗HIV-1的性能作用等[12]。
氧化反应是化学工业中最为常用的反应之一,但是在碳原子上引入酮羰基一直是有机合成领域的一个难题。已有相关文献报道亚甲基被氧化的事实。最早是 2004年 hayashi小组[14-17]报道的9-芴酮氧化。近几年也有相关报道,但实验中所需反应均比较复杂[18-19],反应条件比较苛刻,如高温、高压及强酸等,且氧化剂也不经济。

Chart 1

Scheme 1
本课题组在使用2-氯-3-硝基吡啶为原料经取代、还原后与苯乙酸关环生成6-苄酰基-11-甲基吡啶[2,3-b]并[1,4]苯并二氮卓化合物过程中发现其C(6)-位侧链的烷基亚甲基在室温发生了氧化反应,直接生成酮羰基[13],但氧化速率较缓慢。鉴于此,本文拟在纯氧气环境中对其进行氧化。在前期工作基础上[20-21]进行更深入的研究。
分别以 2-氯-3-硝基吡啶(1a)和 4,6-二氯-5-硝基嘧啶(1d)为起始原料,经取代、还原、Bischler-Napieralski关环和氧化反应合成了新型含酮羰基的吡啶并苯并二氮卓类化合物(6a~6c)和嘧啶并苯并二氮卓类化合物(6d)(Scheme 1),其结构经1H NMR,13C NMR和ESI-MS表征。并重点考察了氧化反应条件。
该反应以纯氧气作为氧化剂解决了在碳原子上引入酮羰基的难题,反应过程经济、安全、高效、无污染,同时可获得一类全新的苯二氮卓化合物,预期其在药物筛选中将获得良好的表现。
1 实验部分
1.1 仪器与试剂
X-5型显微熔点仪(温度未校正);Varian 400 MHz型和Varian 500 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Agilent 1100型液相色谱质谱联用仪。
所用试剂均为分析纯。
1.2 吡啶并苯并二氮卓类化合物的合成
(1)2a的合成
在100 mL单口烧瓶中加入1a 0.793 g(5 mmol),三乙胺1.010 g(10 mmol)和异丙醇 20 mL,搅拌下加入氮甲基苯胺 0.803 g(7.5 mmol),回流反应至终点(TLC监测)。蒸干溶剂,残余物用水和乙酸乙酯溶解,分液,有机相用饱和氯化钠溶液洗涤,无水硫酸镁干燥,蒸干溶剂,固体经甲醇重结晶后得棕色固体 N-甲基-3-硝基-N-苯基吡啶-2-胺(2a)0.591 g,收率 70% 。
(2)3a的合成
在反应瓶中加入2a 0.687 g(3 mmol)和异丙醇12 mL,搅拌使其溶解;加入氯化氨0.129 g(2.4 mmol)和铁粉0.840 g(15 mmol),氮气保护下回流反应至终点(TLC跟踪)。用硅藻土滤去铁粉,蒸干溶剂,残余物用混合溶剂[A=V(水)∶V(乙酸乙酯)=1∶1]溶解,水相用乙酸乙酯萃取,合并萃取液,依次用水和饱和氯化钠溶液洗涤,无水硫酸镁干燥,蒸干溶剂后经硅胶柱层析[洗脱剂:B=V(乙酸乙酯)∶V(石油醚)=1∶5]纯化得白色固体 N2-甲基-N2-苯基吡啶-2,3-二胺(3a)0.537 g,收率90%。
(3)6a~6c的合成通法
在反应瓶中依次加入乙腈10 mL,3a 3 mmol和三氯氧磷1.842 g(12 mmol),搅拌下加入4a~4c 3.6 mmol,于80℃反应至终点(TLC跟踪)。减压蒸干溶剂,残余物用混合溶剂(A=1∶1)溶解,水相用5 mol·L-1氢氧化钠溶液调至pH 9,用乙酸乙酯萃取,合并萃取液,依次用饱和碳酸氢钠溶液和饱和氯化钠溶液洗涤,无水硫酸镁干燥(1 h~2 h),减压蒸除溶剂后经硅胶柱层析(洗脱剂:B=1 ∶5)纯化得5a~5c。
将5a~5c用乙腈10 mL溶解,通氧气,保持密闭,搅拌下回流反应至终点(TLC跟踪)。减压蒸干溶剂,残余物用水和乙酸乙酯溶解,有机相依次用饱和氯化钠溶液和水洗涤,无水硫酸镁干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:B=1 ∶5)纯化得6a~6c。
6-苄酰基-11-甲基吡啶[2,3-b]并[1,4]苯并二氮卓(6a):黄色固体,收率 85.0%,m.p.110.7 ℃ ~111.4 ℃;1H NMR δ:8.19 ~8.17(m,3H),7.61(t,J=7.2 Hz,1H),7.55(d,J=7.2 Hz,1H),7.50(t,J=7.6 Hz,2H),7.42(t,J=7.6 Hz,1H),7.24(s,1H),7.08(d,J=8.0 Hz,1H),7.04 ~7.00(m,2H),3.40(s,3H);13C NMR δ:192.5,168.2,155.0,154.4,145.5,135.4,135.3,134.0,133.0,132.0,129.5,128.3,127.6,127.5,125.7,122.5,118.9,118.1,35.1,28.7;ESI-MS m/z:314.1{[M+H]+}。
6-丙酰基-11-甲基吡啶[2,3-b]并[1,4]苯并二氮卓(6b):黄色固体,收率64.7%;1H NMR δ:8.17(dd,J=3.6 Hz,1.2 Hz,1H),7.55(dd,J=6.0 Hz,1.6 Hz,1H),7.42(td,J=7.8 Hz,1.2 Hz,1H),7.19(d,J=6.4 Hz,1H),7.08 ~7.02(m,3H),3.29(s,3H),3.16(dd,J=7.2 Hz,3.2 Hz,2H),1.21(t,J=7.2 Hz,3H);13C NMR δ:203.0,166.2,156.5,155.5,146.8,136.7,136.2,132.3,130.7,125.8,123.2,119.8,119.0,35.8,31.7,8.2;ESI-MS m/z:266.1{[M+H]+}。
6-乙酰基-11-甲基吡啶[2,3-b]并[1,4]苯并二氮卓(6c):黄色固体,收率72.6%;1H NMR δ:8.19(d,J=4.5 Hz,1H),7.56(d,J=8.5 Hz,1H),7.40(t,J=7.5 Hz,1H),7.20(d,J=7.5 Hz,1H),7.09 ~7.03(m,3H),3.28(s,3H),2.67(s,3H);13C NMR δ:200.4,166.2,156.7,155.5,147.2,136.9,132.5,131.0,123.4,120.0,119.2,37.2,27.3,22.9,14.3;ESI-MS m/z:252.1{[M+H]+}。
1.3 嘧啶并苯并二氮卓类化合物的合成
(1)4-(N-甲 基 苯 氨 基)-5-硝 基-6-氯 嘧 啶(2d)的合成
在反应瓶中依次加入 1d 2.084 g(10.8 mmol),THF 25 mL 和三乙胺 0.55 mL(12.96 mmol),搅拌下缓慢滴加 N-甲基苯胺0.85 mL(10.8 mmol)的 THF(15 mL)溶液,滴毕,于室温反应至终点(TLC跟踪)。蒸干溶剂,用蒸馏水和乙酸乙酯溶解,分液,有机相依次用1 mol·L-1盐酸和饱和氯化钠溶液洗涤,无水硫酸镁干燥1 h,蒸干溶剂后用甲醇重结晶得黄色固体2d 1.846 g。
(2)5-氨 基-4-(N-甲 基 苯 氨 基)-6-氯 嘧 啶(3d)的合成
在反应瓶中依次加入乙醇120 mL,蒸馏水30 mL 和2d 3.270 g(12.39 mmol),搅拌下加入铁粉2.081 g(37.17 mmol)和氯化铵 1.127 g(21.06 mmol),氮气保护下回流反应至终点(TLC跟踪)。用硅藻土滤出铁粉,减压蒸干溶剂,用蒸馏水和乙酸乙酯溶解,分液,有机相依次用蒸馏水和饱和NaCl溶液洗涤,无水硫酸镁干燥,蒸干溶剂后经硅胶柱层析[洗脱剂:B=V(乙酸乙酯)∶V(石油醚)=1∶5]纯化得白色固体3d。
(3)6d的合成
在反应瓶中依次加入多聚磷酸(PPA)254 mg(0.75 mmol)和3d 350 mg(0.5 mmol),搅拌下加入 POCl3(5 mL)和 4a 0.75 mmol,氮气保护下回流反应至终点(TLC监测)。倒入装有碎冰中,搅拌下用5 mol·L-1NaOH 溶液调至 pH 9.0,用乙酸乙酯(3×20 mL)萃取,合并萃取液,依次用饱和NaHCO3溶液和饱和NaCl溶液洗涤,无水硫酸镁干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:B=1∶10)纯化得棕色油状物5d。
将5d用THF 10 mL溶解,通氧气,保持密闭环境,搅拌下回流反应至终点(TLC跟踪)。减压蒸干溶剂,残余物用蒸馏水和乙酸乙酯溶解,分液,有机相用饱和氯化钠溶液洗涤,无水硫酸镁干燥,减压蒸除溶剂后经硅胶柱层析(洗脱剂:B=1∶5)纯化得黄色固体6d。
4-氯-6-苄酰基-11-甲基-嘧啶并[4,5-b][1,4]苯并二氮 (6d):黄色固体,收率78%,m.p.121.8 ℃ ~ 123.0 ℃;1H NMR δ:7.99(dd,J=4.8 Hz,1.8 Hz,1H),7.41 ~ 7.38(m,2H),7.32(td,J=8.7 Hz,1.5 Hz,1H),7.11(d,J=7.8 Hz,1H),7.05 ~ 7.00(m,1H),6.95(dd,J=7.8 Hz,5.1 Hz,1H),3.27(s,3H),1.38(s,9H);13C NMR δ:181.3,155.9,155.2,143.3,137.0,133.6,130.2,128.8,127.3,122.6,119.6,117.9,41.3,35.1,30.3;ESIMS m/z:349.08{[M+H]+}。
2 结果与讨论
2.1 合成6a~6c的反应条件优化
为寻找最佳合成条件,以6a为例,分别考察氧化剂、反应温度、溶剂和载体对氧化效果的影响。
(1)氧化剂
3a 3 mmol,其余反应条件同 1.2(3),考察空气、氧气、过氧化氢和次氯酸钠对氧化效果的影响,结果见表1。由表1可见,将5a直接暴露在空气中,不加任何溶剂,只以空气中的氧气作为唯一氧化剂对其进行氧化反应。由于这是一个自发的缓慢氧化,反应24 h对其进行1H NMR谱分析,结果显示多数原料未反应完,且无副产物生成,反应30 d,收率 >99%(No.1),产物中仍有原料。我们推测只要给予足够的反应时间,5a即能够氧化完全。因为自氧化时间太久,空气中氧气浓度低,故猜测是否有其他条件可以缩短反应时间。于是用纯氧气作为氧化剂,结果显示反应时间大大缩短(No.2)。为了进一步缩短反应时间,采取加溶剂加热法,反应24 h收率55.0%,效果仍不够理想。于是更换了其他氧化剂,如过氧化氢和次氯酸钠,实验结果证明,这两种氧化剂的氧化性太强,反应剧烈,产物被分解了,而氧气作为氧化剂时,反应温和,有目标产物生成,且氧气廉价、安全。因此,本文选用氧气作为唯一氧化剂。
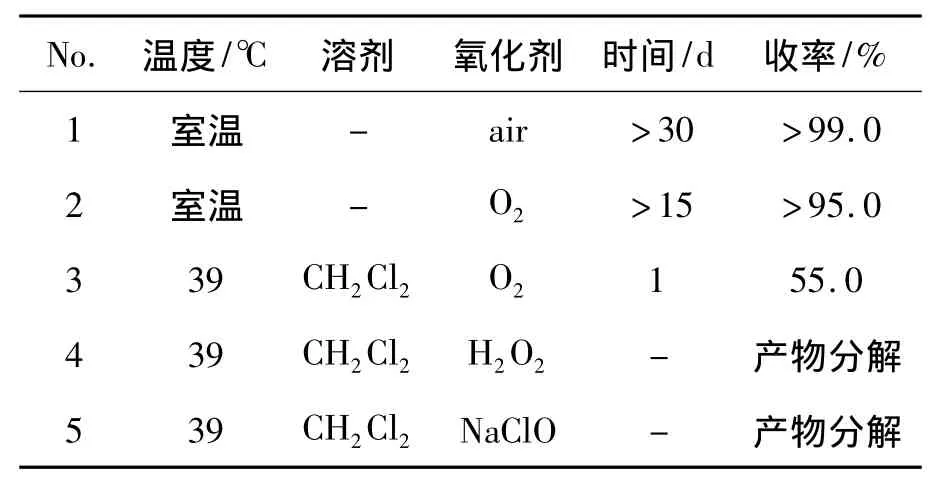
表1 氧化剂对氧化效果的影响*Table 1 Effect of the oxidant on the oxidation reaction
(2)温度和溶剂
为了进一步缩短反应时间,提高反应效率,使反应均匀、充分,以氧气为氧化剂,将5a溶解于不同溶剂中,加热回流反应24 h,其余反应条件同表2.1(1),考察温度和溶剂对氧化效果的影响,结果见表2。由表2可见,当温度升高时,反应速率明显加快,但收率却受到了影响,表明溶剂对氧化速率也有一定影响。由表2还可看出,在不同溶剂各自回流温度反应时,收率不同。可能原因是由于溶剂化效应阻碍了氧化的顺利进行。综合温度和溶剂的影响,以乙腈为溶剂,于80℃反应,氧化效果较好,反应时间短,收率较高(76.2%)。

表2 反应温度和溶剂对氧化效果的影响Table 2 Effect of the temperature and solvent on the oxidation reaction
(3)载体
为了进一步提高收率,以乙腈为溶剂,于80℃反应,其余反应条件同2.1(2),考察载体对氧化效果的影响,结果见表3。由表3可见,由于不同载体吸附氧的程度不同,导致收率不同。以活性炭、硅胶、分子筛或硅藻土为载体时,收率分别为51.1%,70.6%,73.0% 和 85.0%,可见硅藻土作用最好。推其原因可能是硅藻土目数大,能够很好的分散氧气与溶液,使两者分子碰撞机率增大,从而加快了反应速度,缩短反应时间,提高收率。

表3 载体对氧化效果的影响*Table 3 Effect of the carrier on the oxidation reaction
2.2 C-6位侧链对氧化效果的影响
C-6位侧链对氧化效果的影响是指进行Bischler-Napieralski关环反应时所用的羧酸对氧化效果的影响。反应条件同2.1(3),考察了R分别为苯基、乙基和甲基时的反应收率,结果见表4。由表4可见,R为苯基时较烷基更容易发生氧化,且氧化效果比较好,收率较高。在相同溶剂和载体下,对于吡啶环类苯二氮卓化合物来说,R为苯基、乙基、甲基时,6a~6c收率分别为85.0%,64.7%和72.6%,R为苯基(6a)时收率最高;推测原因可能是因为苯基与七元环形成了共轭体系,使其化学性质变得更加活泼;而甲基或乙基没有与苯环形成共轭键,活性降低,故反应收率较苯基低。而R为甲基时比乙基收率较高,可能是因为随着碳链的增加,羧酸的酸性随之降低,使得氧化收率降低。

表4 C-6位侧链R对氧化效果的影响*Table 4 Effect of R on the oxidation reaction

表5 反应条件对5d氧化效果的影响*Table 5 Effect of the reaction conditions on oxidation of 5d
2.3 嘧啶环取代吡啶环的Bischler-Napieralski关环氧化反应
以氧气为氧化剂,采用类似方法探索嘧啶并苯并苯二氮卓化合物(5d)的Bischler-Napieralski关环氧化反应,结果见表5。由表5可见,温度和溶剂探索中THF为溶剂时氧化效果较乙腈好。在载体的探索中,尝试了引发剂偶氮二异丁氰(AIBN),因为嘧啶胺反应所用时间太长,引发剂的加入可以大大加速反应,但是反应进程不易控制,从而使目标产物部分分解,氧化产率下降,没有达到预期的目的。同时,活性炭的作用要远远好于硅藻土,收率78.0%。
3 结论
在Bischler-Napieralski关环反应中发现三环化合物中吡啶和嘧啶类苯并二氮卓芳环侧链亚甲基可进行直接氧化,采用该直接氧化法合成了新型含酮羰基的吡啶并苯并二氮卓类化合物(6a~6c)和嘧啶并苯并二氮卓类化合物(6d),并优化了氧化反应条件。合成6a~6c时,以乙腈为溶剂,硅藻土为载体,氧化效果较好。合成6d时,以THF为溶剂,活性炭为载体,氧化效果较理想。
6a~6d可用以合成一系列结构新颖多样的、具有潜在药理活性的化合物或其中间体,该研究结果为增加此类分子结构的多样性提供了重要的方法,也为合成具有并环芳烃基本骨架的化合物提供了便捷途径。
[1]Ritz M,Wang C,Micale N,et al.Mechanism of inhibition of the GluA2 AMPA receptor channel opening:The role of 4-methyl versus 4-carbonyl group on the diazepine ring of 2,3-benzodiazepine derivatives[J].ACS Chem Neurosci,2011,2(9):506 -513.
[2]Qneibi M S,Micale N,Grasso S,et al.Mechanism of inhibition of GluA2 AMPA receptor channel opening by 2,3-benzodiazepine derivatives:Functionalconsequences of replacing a 7,8-methylenedioxy with a 7,8-ethylenedioxy moiety[J].biochemistry,2012,51(8):1787-1795.
[3]Joseph C G,Wilson K R,Wood M S,et al.The 1,4-benzodiazepine-2,5-dione small molecule template results in melanocortin receptor agonists with nanomolar potencies[J].J Med Chem,2008,51(5):1423 -1431.
[4]Rivas F M,Stables J P,Murphree L,et al.Activity of novel γ-aminobutyric acid(A)receptor subtype-selective benzodiazepine analogues in mice and rat models[J].J Med Chem,2009,52(7):1795 -1798.
[5]Antonow D,Kaliszczak M,Kang G,et al.Structureactivity relationships of monomeric C2-aryl pyrrolo[2,1-c][1,4]benzodiazepine(PBD)antitumor agents[J].J Med Chem,2010,53(7):2927 - 2941.
[6]Anzini M,Valenti S,Braile C.New insight into the central benzodiazepine receptor-ligand interactions:Design,synthesis,biological evaluation,and molecular modeling of 3-substituted 6-phenyl-4H-imidazo[1,5-a][1,4]benzodiazepines and related compounds[J].J Med Chem,2011,54(16):5694 -5711.
[7]Rahman K M,Vassoler H,James C H,et al.DNA sequence preference and adduct orientation of pyrrolo[2,1-c][1,4]benzodiazepine antitumor agents[J].ACS Med Chem Lett,2010,1(8):427 -432.
[8]Liu P,Lanza TJ Jr,Chioda M,et al.Discovery of benzodiazepine sulfonamide-based bombesin receptor subtype 3 agonists and their unusual chirality[J].ACS Med Chem Lett,2011,2(12):933 -937.
[9]Fotso S,Zabriskie T M,Proteau P J,et al.Pyrrolo[1,4]benzodiazepine antibiotics from an indonesian micrococcus sp[J].J Nat Prod,2009,72(4):690 -695.
[10]Nakamichi N,Kawashita Y,Hayashi M.Oxidative aromatization of 1,3,5-trisubstituted pyrazolines and Hantzsch 1,4-dihydropyridines by Pd/C in acetic acid[J].Org Lett,2002,4:3955 -3957.
[11]王国村,蔡承,邹艳冶.哌仑西平的药理作用[J].华西药学杂志,1987,2(1):16 -20.
[12]花中霞.1,5-苯并二氮杂卓类化合物的合成研究及抑菌活性研究[D].石家庄:河北师范大学,2011.
[13]Shi F,Xu X,Zheng L,et al.Method development for a pyridobenzodiazepine library with multiple diversification points[J].J Comb Chem,2008,10:158 -161.
[14]Shi F,Bai X,Dang Q,et al.A rapid synthetic method of pyridobenzodiazepines[J].Res Chem Intermed,2010,36:253 -258.
[15]Nakamichi N,Kawashita Y,Hayashi M.Oxidative aromatization of 1,3,5-trisubstituted pyrazolines and Hantzsch 1,4-dihydropyridines by Pd/C in acetic acid[J].Org Lett,2002,4:3955 -3957.
[16]Nakamichi N,Kawabata H,Hayashi M.Oxidative aromatization of 9,10-dihydroanthracenes using molecular oxygen promoted by activated carbon[J].J Org Chem,2003,68:8272 -8273.
[17]Kawashita Y,Nakamichi N,Kawabata H,et al.Direct and practical synthesis of 2-arylbenzoxazoles promoted by activated carbon[J].Org Lett,2003,5:3713-3715.
[18]Kawabata,Hirotoshi,Hayashi M.Benzylic oxygenation of alkylarenes with molecular oxygen in the presence of activated carbon[J].Tetrahedron Letters,2004,45:5457 -5459.
[19]Xu Y,Hu J T,Yan J.An environmentally benign benzylic oxidation catalyzed by hypervalent iodine intermediate in water[J].Chinese Chemical Letters,2012,23:891 -894.
[20]Moriyama K,Takemura M,Togo H.Direct and selective benzylic oxidation of alkylarenes via C -H abstraction using alkali metal bromides[J].Org Lett,2012,14(9):2414 -2417.
[21]王金凤,张龙,石富强.吡啶苯并二氮卓氧化反应的研究[J].化学与生物工程,2010,27(3):
