基于随机双盲安慰剂对照试验的一氧化碳吸入疗法在新生儿肺炎应用的安全性研究
2015-04-20蔡康兴
王 灿 蔡康兴 陈 龙 王 楠 史 源
·论著·
基于随机双盲安慰剂对照试验的一氧化碳吸入疗法在新生儿肺炎应用的安全性研究
王 灿1,2,3蔡康兴3陈 龙1王 楠1史 源1
目的探讨一氧化碳(CO)吸入疗法在足月新生儿中应用的安全性以及抗炎、抗氧化作用。方法纳入2013年3~6月第三军医大学附属大坪医院NICU住院的肺炎足月新生儿,随机分为8组,分别予以空氧气体(安慰剂)和10、20、30、40、50、60、70 mg·L-1浓度的CO吸入2 h;吸入安慰剂气体或CO期间持续观察受试者的反应,监测心率、血氧饱和度、呼吸和血压等生命体征,检测吸入前(0 h)和吸入后2和5 h时点血清碳氧血红蛋白(COHb)浓度,评估吸入CO的安全性;检测晚期氧化蛋白产物(AOPPs)、总抗氧化能力 (TAOC)、丙二醛 (MDA)和巨噬细胞炎症蛋白-2 (MIP-2)水平,评估吸入CO的抗炎和抗氧化作用。结果48例足月新生儿符合纳入和排除标准进入观察,每组各6例。8组间胎龄、年龄、体重、白蛋白、Hb和WBC计数等基线指标差异均无统计学意义。①CO 70 mg·L-1组1例因不良事件退出研究,其余受试者均完成试验;COHb在不同时点和8组间差异均无统计学意义(P>0.05);②随着吸入CO浓度的增加,MIP-2总体上呈下降趋势 (P=0.000),3个观察时点差异总体上有统计学意义(P=0.001); TAOC水平8组间比较差异无统计学意义(P=0.917),不同时点差异有统计学意义(P=0.005); AOPPs和MDA在不同时点以及不同组间差异均无统计学意义(P>0.05)。结论吸入CO浓度≤60 ppm在新生儿肺炎中的应用是安全的,且具有抗炎和改善氧化应激状态的作用。
一氧化碳; 新生儿肺炎; 炎症; 氧化应激
动物实验显示,吸入一氧化碳(CO)对组织缺血性损伤、高氧肺损伤、移植物抗宿主反应和炎症反应等具有保护作用[1~6]。成人中应用CO吸入疗法的研究已在临床开展[7],提示吸入CO具有抗炎和抗氧化应激作用。基于CO的作用机制、相关研究基础和临床的研究结果,推测吸入CO可能对新生儿过度炎症反应[8]、氧化应激[9,10]和肺血管化[11]相关的疾病有治疗价值,如支气管肺发育不良(BPD)和新生儿持续肺动脉高压(PPHN)。但目前尚无CO应用于新生儿的临床研究,也未见相关临床试验注册和文献发表。探讨吸入CO疗法的可行性和安全性,是一种新的治疗方法应用于新生儿的先决条件。
1 方法
1.1 研究设计 本研究以足月新生儿肺炎病例为研究对象,随机分为8组,分别吸入安慰剂气体和不同浓度的CO 2 h,监测生命体征,检测碳氧血红蛋白(COHb)浓度评估安全性;检测炎症和氧化指标评估抗炎和抗氧化作用。
1.2 伦理 本研究经过第三军医大学大坪医院(我院)医学伦理委员会批准。受试者家属均签署知情同意书。
1.3 注册 本研究在美国Clinical Trial平台(http://www.clinicaltrials.gov)注册,注册号:NCT01818843。
1.4 诊断标准 新生儿肺炎的诊断符合文献[12]标准。
1.5 纳入标准 ①2013年3~6月我院NICU符合新生儿肺炎诊断的足月新生儿;②持续氧饱和度≥95%,心率<160·min-1,呼吸频率<60·min-1,且无需吸氧。
1.6 排除标准 除肺炎外合并的其他严重疾病或系统功能异常,如心、肝和肾功能异常,脑部疾病(缺氧缺血性脑病、脑室内出血等),遗传代谢性疾病,先天性畸形等。
1.7 分组和分配隐藏 以随机数字表法分为8组,分组序列号装入密闭的信封。试验参与者(医生、操作者和检验员)均不知晓随机序列分配列表。
1.8 干预 不同浓度(10、20、30、40、50、60、70 mg·L-1)的气缸压缩标准CO气体瓶(CO纯度99%)和安慰剂气体瓶(不含CO的空氧气体),均由中国重庆气体研发有限公司提供。安慰剂气体瓶和不同浓度CO气体瓶外观一致,贴上分组标签,操作者对标签代表是安慰剂气体或CO气体的浓度不知晓。通过减压阀减压至0.3~0.5 kPa后,受试者使用非复吸面罩分别吸入7种不同浓度的CO气体或安慰剂气体2 h,吸入流量为1 L·min-1。
1.9 观察指标 在吸入前(0 h)、吸入后2和5 h的3个时点采集股静脉血2~3 mL,检测安全性(COHb)和抗炎、抗氧化指标。
1.9.1 基线指标 包括年龄、体重、白蛋白水平、Hb水平和WBC计数。
1.9.2 主要结局指标 ①吸入CO或安慰剂期间由本文第一作者持续观察受试者的反应,心电监护仪监测心率,血氧饱和度、呼吸和血压等生命体征;②血清COHb水平。
1.9.3 次要结局指标 血清晚期氧化蛋白产物(AOPPs)、总抗氧化能力 (TAOC)、丙二醛 (MDA)和巨噬细胞炎症蛋白-2 (MIP-2)水平(酶联免疫法)。
1.10 不良事件处置和退出标准 在安慰剂气体或CO吸入过程中,受试者出现烦躁不安、发绀、难以安慰的激惹,或出现以下任一情况并持续2~3 min:①心率>160·min-1或<100·min-1;②血氧饱和度<85%;③呼吸频率>70·min-1;③收缩压降低>20%;立即停止CO或安慰剂气体吸入,改为吸氧2~3 min,待上述指标恢复正常后,继续予CO或安慰剂气体吸入并观察;如出现≥2次上述任一情况,立即停止CO或安慰剂气体吸入,停止观察并退出研究,并予以吸氧2~3 min。

2 结果
2.1 一般情况 研究期间我院确诊133例新生儿肺炎,48例肺炎足月新生儿符合纳入和排除标准进入研究,被随机分配至8组,每组各6例,图1显示了研究对象纳入、排除、分配和退出的情况。
表1显示,8组间胎龄、年龄、体重、白蛋白、Hb和WBC计数等基线指标差异均无统计学意义(P均>0.05)。
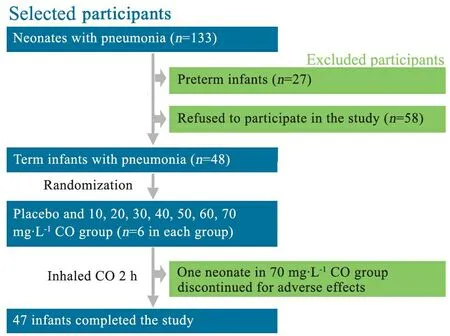
图1 纳入、排除、分配和退出流程图
Fig 1 Flowchart of inclusion, exclusion, allocation and quit procedure

表1 8组新生儿的基线数据比较Tab 1 Comparisons of patient characteristics at admission of 8 groups
Notes F/M: female/male; ALB: albumin; GA: gestational age
2.2 安全性指标 70 mg·L-1CO组1例吸入过程中出现2次经皮血氧饱和度<85% 和心率>160·min-1持续2~3 min,退出研究,吸氧1 min后恢复正常。余病例吸入CO或安慰剂气体期间,未观察到烦躁不安、发绀和激惹等反应,心率均维持在100~160·min-1,血氧饱和度≥85%、呼吸频率≤70·min-1,收缩压降低<20%,均完成研究。
表2显示,血清COHb 水平在3个时点和8组间的差异均无统计学意义。
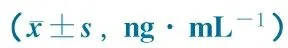

Notes Repeated measure ANOVA was employed to test the difference among 8 groups and 3 abserved time points. The difference among 8 groups:F=0.538,P=0.800; The difference among 3 time points:F=0.347,P=0.715 2.3 抗炎和抗氧化效应指标 表3显示,AOPPs在3个时点和8组间差异均无统计学意义。MIP-2水平在3个时点和8组间差异有统计学意义。TAOC水平在8组间差异无统计学意义,3个时点间差异有统计学意义;MDA水平在3个时点和8组间差异均无统计学意义。
3 讨论
一氧化碳(CO)作为一种内源性气体分子第二信使,由生物体内血红素氧合酶(HO)分解代谢血红素产生,当体内组织遭遇缺氧和(或)炎症[14],以及氧化应激时,内源性CO增加。研究表明,CO具有调控血管张力[15]、参与免疫调节[16]、抗炎和抗氧化能力[17]的生物学作用。多项研究表明,氧化应激和炎症反应参与多种心血管疾病(如PPHN)以及肺疾病(如BPD)的发病机制[18]。NO是一种选择性肺血管舒张剂和体内抗炎、抗氧化分子,能降低新生儿PPHN的肺动脉压[19,20]。吸入NO疗法被认为是治疗PPHN最有效的方法[21],然而,吸入NO疗法不能改善30%~40% PPHN病例的氧合状态[22],因此迫切需要寻求一种治疗PPHN或其他由过度炎症反应和氧化应激引起的疾病的其他方法具有重要意义。与NO相似,CO能激活鸟苷酸环化酶以增加环磷酸鸟苷的细胞浓度,从而引起血管舒张和血压降低[23]。
CO吸入作为一种全新的治疗方法,虽然在成人中已开展相关临床研究,但是国内外尚无新生儿吸入CO的临床试验报道。因此首先需要明确新生儿吸入CO疗法的安全性。考虑到新生儿肺炎的发生率和病死率较高[24,25],氧化应激在新生儿肺炎的发病机制中起重要作用,且足月儿相对成熟;故选择足月新生儿肺炎病例作为本文的观察对象,同时排除了除肺炎外的其他系统功能异常或严重疾病的干扰。CO具有毒性,应将新生儿暴露于有效且安全的治疗浓度中,以免发生中毒反应,因此对于吸入浓度的把握非常关键[26]。本研究检测吸入前和吸入后2、5 h血清COHb水平,并观察吸入期间受试者的生命体征,评估吸入CO的潜在不良事件。既往研究显示,健康成人吸入CO 100 mg·L-12 h可使体内COHb水平达4%[27],低于平均安全值的5.3%[28],且慢性阻塞型肺疾病(COPD)成人患者对该浓度CO同样耐受[7]。COHb分解/合成动力学在新生儿、成人和动物有所不同,不能直接使用成人或动物研究结果,因此本研究使用的CO最高浓度(70 mg·L-1)相比既往成人研究低。本研究发现10~60 mg·L-1CO和安慰剂组的新生儿未观察到显著的不良事件 ,且其体内COHb水平差异无统计学意义,70 mg·L-1CO组有1例出现了2次血氧饱和度<85%和心率>160·min-1,停止吸入CO并给予吸氧1 min后恢复正常。由于本研究中出现不良事件时的CO浓度(70 mg·L-1)低于既往报道的成人[7]和动物实验[3]中的浓度(100~125 mg·L-1),因此有必要对低浓度CO吸入的安全性做进一步的研究。



为了探索CO吸入对系统炎症和氧化应激的作用,本研究检测了血液中促炎细胞因子MIP-2的水平,同时检测了体内氧化蛋白复合物家族AOPPs,AOPPs是一种体内氧化应激时形成的含二酪氨酸的蛋白产物,在体内主要由白蛋白运载[29,30],血浆中AOPPs、MDA和TAOC积聚提示体内存在过度氧化应激。本研究显示10~60 mg·L-1CO组和安慰剂组,随着吸入CO浓度的增加可使MIP-2水平呈下降趋势,3个时点TAOC呈下降趋势,与小鼠中的研究报道结果一致[3]。对健康志愿受试者注入脂多糖(LPS)后吸入CO的临床试验显示,给予LPS 2 ng·kg-1使血液中IL-1, IL-6, IL-8水平短暂升高,后吸入500 mg·L-1浓度CO 1 h,导致体内COHb峰值达到7.0%,但并未影响上述细胞因子的水平[31],考虑可能与CO吸入的时间较短有关。COPD成人患者吸入100~125 mg·L-1CO的研究显示,可显著减少痰液嗜酸细胞和改善乙酰甲胆碱反应性的趋势[7]。对注入了大剂量LPS脓毒症的小鼠模型研究结果显示,吸入CO能够提高小鼠的存活率,其血浆IL-6和IL-1水平相比未予CO吸入的对照组显著下降[32],对由机械通气引起的肺损伤[33]和高氧肺损伤[34,35]吸入CO也有类似的研究结果。上述研究提示吸入CO的治疗作用可能是通过降低体内持续存在的炎症反应和氧化应激水平来实现的,也提示吸入CO疗法对新生儿体内存在过度炎症反应和氧化应激水平的严重疾病可能有潜在的重要作用。
结论:给予肺炎新生儿吸入≤60 mg·L-1浓度的CO是可行和安全的,受试者没有出现任何相关不良事件且血清COHb水平无显著性变化。吸入CO浓度可使受试者体内MIP-2水平显著降低,提示吸入CO具有抗炎和抗氧化作用。
[1]El-Mousleh T, Casalis PA, Wollenberg I, et al. Exploring the potential of low doses carbon monoxide as therapy in pregnancy complications. Med Gas Res,2012, 20:2(1):4
[2]Chiang N, Shinohara M, Dalli J, et al. Inhaled carbon monoxide accelerates resolution of inflammation via unique proresolving mediator-heme oxygenase-1 circuits. J Immunol, 2013,190(12):6378-6388
[3]Wilson MR, O′Dea KP, Dorr AD, et al. Efficacy and safety of inhaled carbon monoxide during pulmonary inflammation in mice. PLoS One, 2010 13;5(7):e11565
[4]Fujita T, Toda K, Karimova A, et al. Paradoxical rescue from ischemic lung injury by inhaled carbon monoxide driven by derepression of fibrinolysis. Nat Med, 2001,7(5):598-604
[5]Sato K, Balla J, Otterbein L, et al. Carbon monoxide generated by heme oxygenase-1 suppresses the rejection of mouse-to-rat cardiac transplants. J Immunol, 2001,166(6):4185-4194
[6]Chapman JT, Otterbein LE, Elias JA, et al. Carbon monoxide attenuates aeroallergen-induced inflammation in mice. Am J Physiol Lung Cell Mol Physiol, 2001, 281(1):209-216
[7]Bathoorn E, Slebos DJ, Postma DS, et al. Anti-inflammatory effects of inhaled carbon monoxide in patients with COPD: a pilot study.Eur Respir J, 2007,30(6):1131-1137
[8]Waterberg KI. American Academy of Pediatrics, Committee on Fetus and Newborn. Policy statement postnatal corticosteroids to prevent or treat bronchopulmonary dysplasia. Pediatrics, 2010,126(4):800-808
[9]Speer CP. Chorioamnionitis, postnatal factors and proinflammatory response in the pathogenetic sequence of bronchopulmonary dysplasia. Neonatology,2009,95(4):353-361
[10]Firth AL, Yuan JX. Bringing down the ROS: a new therapeutic approach for PPHN. Am J Physiol Lung Cell Mol Physiol,2008,295(6):976-978
[11]Cabral JE, Belik J. Persistent pulmonary hypertension of the newborn: recent advances in pathophysiology and treatment. J Pediatr (Rio J), 2013,89(3):226-242
[12]Cloherty JP, Eichenwald EC, Stark AR. Mannual of neonatal care. 6th edition. 2008 Lippincott Williams and Wilkins. 274-300
[13]Montori VM, Guyatt GH. Intention-to-treat principle. CMAJ, 2001,165(10):1339-1341
[14]Otterbein LE, Choi AM. Heme oxygenase: colors of defense against cellular stress. Am J Physiol Lung Cell Mol Physiol, 2000 279(6): 1029-1037
[15]Ryter SW, Morse D, Choi AM. Carbon monoxide: to boldly go where NO has gone before. Sci STKE, 2004(230):RE6
[16]Mackern-Oberti JP, Llanos C, Carreno LJ, et al. Carbon monoxide exposure improves immune function in lupus prone mice. Immunology,2013 ,140(1):123-132
[17]Ghosh S, Gal J, Marczin N. Carbon monoxide: endogenous mediator, potential diagnostic and therapeutic target. Ann Med,2010,42(1):1-12
[18]Rossi GP, Seccia TM, Nussdorfer GG. Reciprocal regulation of endothelin-1 and nitric oxide: relevance in the physiology and pathology of the cardiovascular system. Int Rev Cytol, 2001,209:241-272
[19] Lakshminrusimha S, Russell JA, Wedgwood S, et al. Superoxide dismutase improves oxygenation and reduces oxidation in neonatal pulmonary hypertension. Am J Respir Crit Care Med,2006,174(12):1370-1377
[20]Fike CD, Dikalova A, Slaughter JC, et al. Reactive oxygen species-reducing strategies improve pulmonary arterial responses to nitric oxide in piglets with chronic hypoxia-induced pulmonary hypertension. Antioxid Redox Signal, 2013,18(14):1727-1738
[21]Sanchez Luna M, Franco ML, Bernardo B. Therapeutic strategies in pulmonary hypertension of the newborn: where are we now? Curr Med Chem,2012,19(27):4640-4653
[22]Steinhorn RH. Nitric oxide and beyond: new insights and therapies for pulmonary hypertension.J Perinatol, 2008,28(S3):67-71
[23]Marks GS, Brien JF, Nakatsu K, et al. Does carbon monoxide have a physiological function? Trends Pharmacol Sci,1991,12(5):185-188
[24]Rudan I, Chan KY, Zhang JS,et al. Causes of deaths in children younger than 5 years in China in 2008. Lancet,2010,375(9720):1083-1089
[25]Xia L(李霞), Zhong D. Evolution of cause of infant mortality and mortality in some countries and regions in the world. Chin J Evid Based Pediatr(中国循证儿科杂志), 2010,5(2):151-154
[26]Thom SR, Weaver LK, Hampson NB. ′′Therapeutic′′ carbon monoxide may be toxic. Am J Respir Crit Care Med,2005,171(11): 1318
[27]Peterson JE, Stewart RD. Absorption and elimination of carbon monoxide by inactive young men. Arch Environ Health, 1970, 21(2):165-171
[28]Zevin S, Saunders S, Gourlay SG, et al. Cardiovascular effects of carbon monoxide and cigarette smoking. J Am Coll Cardiol, 2001,38(6):1633-1638
[29]Witko-Sarsat V, Friedlander M, Capeillere-Blandin C, et al. Advanced oxidation protein products as a novel marker of oxidative stress in uremia. Kidney Int, 1996,49(5):1304-1313[30]Witko-Sarsat V, Friedlander M, Nguyen KT, et al. Advanced oxidation protein products as novel mediators of inflammation and monocyte activation in chronic renal failure. J Immunol, 1998,161(5):2524-2532
[31]Mayr FB, Spiel A, Leitner J, et al. Effects of carbon monoxide inhalation during experimental endotoxemia in humans. Am J Respir Crit Care Med, 2005,171(4):354-360
[32]Morse D, Pischke SE, Zhou Z, et al. Suppression of inflammatory cytokine production by carbon monoxide involves the JNK pathway and AP-1. J Biol Chem, 2003, 278(39):36993-36998
[33]Hoetzel A, Dolinay T, Vallbracht S, et al. Carbon monoxide protects against ventilator-induced lung injury via PPAR-gamma and inhibition of Egr-1. Am J Respir Crit Care Med, 2008,177(11):1223-1232
[34]Otterbein LE, Mantell LL, Choi AM.Carbon monoxide provides protection against hyperoxic lung injury.Am J Physiol, 1999,276(4 Pt 1):688-694
[35]Otterbein LE, Otterbein SL, Ifedigbo E, et al. MKK3 mitogen-activated protein kinase pathway mediates carbon monoxide-induced protection against oxidant-induced lung injury.Am J Pathol, 2003,163(6):2555-2563
(本文编辑:丁俊杰)
Safety and feasibility of inhaled carbon monoxide treatment for neonates with stabilized pneumonia: a randomized-blinded study
WANGCan1,2,3,CAIKang-xing3,CHENLong1,WANGNan1,SHIYuan1
(1DepartmentofPediatrics,DapingHospitalofThirdMilitaryMedicalUniversity,Chongqing400042; 2ChongqingMedicalandpharmaceuticalCollege,Chongqing401331; 3Hasequalcontributiontothestudy)
SHI Yuan,E-mail: petshi530@vip.163.com
ObjectiveThe aim of the present study was to investigate the feasibility, safety and anti-inflammatory and anti-oxidant properties of carbon monoxide (CO) inhalation in term infants.MethodsNeonates with pneumonia in NICU of Daping Hospital of Third Military Medical University from March 2013 to June 2013 were randomly divided into 8 groups, respectively inhaled 0, 10, 20, 30, 40, 50, 60, 70 mg·L-1of CO for 2 h; during CO inhalation,observating the reaction of subjects, continuous monitoring of heart rate, blood oxygen saturation, respiration and blood pressure and other vital signs, detecting the serum levels of carboxyhemoglobin (COHb) concentration before inhalation (0 h) and 2 and 5 h after inhalation to evaluate the feasibility and safety of inhaled CO. The total antioxidant capacity (TAOC), malondialdehyde (MDA) and macrophage inflammatory protein-2 (MIP-2) levels before inhalation (0 h) and 2 and 5 h after inhalation were detected to evaluate anti-inflammatory and antioxidant effects of CO.Results48 infants met the inclusion and exclusion criteria and were taken into the observation, 6 cases in each group. Baseline index between 8 groups did not significantly differ. ①One neonate in 70 mg·L-1group was discontinued for adverse effects and others enrolled patients were completed the study ultimately. There were no significant changes of carboxyhaemoglobin among 8 groups.②With the increase of iCO concentration, macrophage inflammatory protein-2 showed a reducing trend among groups (F=212.437,P<0.001) and time points (F=4.603,P=0.001), and TAOC showed sigificant difference between three times points (F=9.618,P=0.005). No significant changes of advanced oxidation protein products and malondialdedyde concentrations during the course of iCO were found among time points and groups.ConclusioniCO≤60 mg·L-1in term neonates with pneumonia in a stable phase was feasible and safe, and induced anti-inflammatory and anti-oxidant effects. Application of inhalation CO therapy in neonates is worthy of further study.
Carbon monoxide; Neonatal pneumonia; Inflammation; Oxidative stress
重庆市科技开发项目:cstc2013yykfA0193
1 第三军医大学附属大坪医院儿科 重庆,400042;2 重庆市医药高等专科学校 重庆,401331;3 共同第一作者
史源,E-mail:petshi530@vip.163.com
10.3969/j.issn.1673-5501.2015.03.003
2014-04-20
2015-01-25)
