人脐静脉内皮细胞分离培养方法的建立及优化
2015-04-19马振华张连杰马艳琴
马振华,张连杰,马艳琴*
(1.山西农业大学 生命科学学院,山西 太谷 030801;2.山西农业大学 山西省环境兽医学重点实验室,山西 太谷 030801)
人脐静脉内皮细胞分离培养方法的建立及优化
马振华1,张连杰2,马艳琴1*
(1.山西农业大学 生命科学学院,山西 太谷 030801;2.山西农业大学 山西省环境兽医学重点实验室,山西 太谷 030801)
为优化人脐静脉内皮细胞(HUVEC)原代及传代的培养方法,建立一种简便且能够获得数量较多及活力良好的HUVEC培养体系。分离脐静脉并插管,用0.1%的II型胶原酶灌注消化分离内皮细胞。M199完全培养基悬浮并接种于细胞培养瓶,37℃,5%CO2培养。待细胞铺满80%时,0.25%胰酶-EDTA消化传代培养。倒置显微镜观察内皮细胞生长情况,姬姆萨染色法鉴定内皮细胞的形态,vWF因子相关抗原免疫荧光法鉴定内皮细胞。比较不同胶原酶消化时间、不同接种密度、不同胰酶消化时间、不同培养基组分对细胞得率、形态和纯度的影响。结果表明,原代培养时,II型胶原酶最佳消化时间为15 min,最佳接种密度为1×106mL-1;传代培养时,胰酶最佳消化时间为2 min。倒置显微镜下观察和姬姆萨染色结果显示,贴壁内皮细胞呈长梭形,且呈单层铺路石状排列。免疫荧光检测结果表明,细胞胞浆呈绿色荧光,为vWF因子阳性细胞,DAPI衬染细胞核呈蓝色,显示内皮细胞纯度接近100%。本实验成功建立了HUVEC原代分离培养的优化体系,纯度高、活力好,为后续研究做好了准备。
人脐静脉血管内皮细胞;胶原酶消化法;姬姆萨染色;免疫荧光技术
血管内皮细胞(endothelial cells,EC)是一种多功能细胞,其在多种疾病中所起的重要作用已越来越受到重视,已成为当今医学、生物学领域的重要研究对象[1]。人脐静脉 (human umbilical vein,HUV)是培养血管内皮细胞的常用来源之一,与动物血管内皮细胞相比,人脐静脉内皮细胞 (human umbilical vascular endothelial cells,HUVEC)使实验条件更符合人体情况,结果更有意义[2]。自1963年起,人们便不断地开展内皮细胞体外培养的研究,以便提供一个接近人体的研究模型。但由于人血管内皮细胞培养条件要求高,不易在体外生长,长期以来只能在体外维持培养2~3代。1981年[3],Maciag的研究使人血管内皮细胞的体外培养获得突破性进展,他用从牛下丘脑提取的ECGF作为生长促进剂,成功地使人血管内皮细胞在体外连续培养15~20代。目前,获取内皮细胞的方法有机械刮取法、组织贴块法和酶消化法3种[4,5]。前2种易混杂平滑肌细胞、成纤维细胞等其它血管壁细胞,近年已逐渐被酶消化法取代。
本研究采用II型胶原酶灌注法消化分离脐静脉内皮细胞,观察原代培养时不同的胶原酶消化时间、不同接种密度和传代培养时不同的胰酶-EDTA消化时间对细胞得率和细胞活力状态的影响,并对培养基成分进行优化,从而改进并建立一套操作性强、细胞获得多、传代次数多的HUVEC培养方法。
1 材料与方法
1.1 材料
实验用新生儿脐带取自晋中市第二人民医院,产妇体健,剖宫产,实验方案经医院伦理委员会批准,产妇及家属均签署知情同意书。
主要试剂:M199培养基、II型胶原酶、0.25%胰酶-EDTA、胎牛血清、青霉素、链霉素(Gibco公司),明胶(MP公司),4%多聚甲醛、0.2%TritonX-100、10%山羊血清(Solarbio公司),兔抗人VIII因子抗体、FITC标记山羊抗兔-IgG(博奥森公司),HEPES、肝素、谷氨酰胺、内皮细胞生长因子(VEGF)(Sigma公司)。M199完全培养基添加:20%(或10%)胎牛血清、2 mmol·L-1谷氨酰胺、6.25 U·mL-1肝素、100 U·mL-1青霉素、100 μg·mL-1链霉素、10 ng·mL-1VEGF。
主要仪器:巴氏吸管、细胞培养瓶、六孔培养板(Corning公司),输液器延长管。
1.2 方法
1.2.1 HUVEC原代分离培养
将脐带放置于大平皿中,挤去血液,用巴氏吸管吸弃,剪去血肿多的和有夹痕的脐带段。脐带的一端剪断,暴露出两条脐动脉和一条脐静脉(脐动脉壁厚,管腔小,静脉壁薄,管腔大)。剪输液延长管适当长度,插入脐静脉3 cm以上,止血钳固定。从延长管的一端用20 mL注射器吸取PBS冲洗脐静脉,吸弃洗液。将脐带转移至新的平皿,结扎另一端脐带,注入10 mL左右胶原酶溶液,充盈脐静脉,止血钳封闭端口,37℃培养箱孵育。本实验对孵育时间进行优化,设置10、15、20 min3个时间梯度,观察胶原酶不同处理时间对细胞得率、纯度的影响。期间,轻揉脐带,以助于细胞脱落。处理结束后打开下端,使酶液收集入离心管,PBS冲洗,并收集。1000 r·min-1离心5 min,弃上清,用含20%FBS的M199完全培养液重悬细胞,接种于明胶预包被的25 cm2培养瓶,于37℃、5%CO2培养箱中培养。
1.2.2 原代细胞不同接种密度的比较
台盼蓝拒染法进行细胞计数,设置1×104、1×105、1×106和1×107mL-14个不同的接种浓度,37℃、5%CO2培养,每2天换液一次,观察细胞生长情况及原代培养时间。
1.2.3 HUVEC传代时胰酶处理时间的比较
吸弃培养瓶中的培养基,用预热的PBS洗2次(以去除残留的血清)。加入预热的胰酶-EDTA溶液,覆盖细胞(25 cm2加0.5 mL),放入37℃培养箱中孵育。本实验对孵育时间进行优化,设置1、2、3 min 3个时间梯度,观察不同胰酶消化时间对细胞脱壁效果及细胞活力的影响。
处理结束后加5~7 mL预热的含血清M199培养基,以终止胰酶的作用。用巴氏吸管反复吹打,使细胞团块分离,1000 r·min-1,离心5 min。倾倒上清,用含10%FBS的M199完全培养基培养基重悬细胞,37℃、5%CO2培养。
1.2.4 HUVEC的鉴定
培养的细胞在相差显微镜下进行形态学观察,并在6孔培养板制备细胞爬片,姬姆萨染色法更清晰地呈现细胞形态图像。采用vWF抗体免疫荧光法鉴定HUVEC细胞,具体操作如下:从培养板中取出细胞爬片,PBS洗3次,4%多聚甲醛固定15 min;0.2%TritonX-100破膜;10%山羊血清室温封闭30 min;加入兔抗人vWF抗体(1∶100稀释),放入湿盒内,37℃,60 min;加入FITC标记山羊抗兔-IgG,37℃避光孵育60 min;5 μg·mL-1的DAPI室温衬染细胞核2 min,荧光显微镜下观察。
2 结果与分析
2.1 胶原酶不同消化时间对细胞纯度的影响
研究发现孵育10 min时,内皮细胞并未完全脱落,细胞数量较少;孵育20 min时,不仅内皮细胞脱落,平滑肌细胞也部分脱落,给后期纯化培养造成困难。最佳孵育时间是15 min,此时,内皮细胞消化完全,得率较高且无杂细胞的污染。HUVEC倒置显微镜下形态学观察:细胞2 h开始贴壁,24 h大部分贴壁,到48 h已完全贴壁。如图1所示,细胞呈长梭形生长,且呈单层铺路石状排列。姬姆萨染色后细胞形态学观察如图2所示,细胞核染成紫红色或蓝紫色,胞浆染成粉红色,在光镜下呈现出清晰的细胞染色图像。
vWF抗体免疫荧光法鉴定结果显示:荧光显微镜下观察到胞质中可见大量绿色荧光,为vWF抗原阳性细胞,即人脐静脉内皮细胞。DAPI衬染所有的胞核均呈蓝色荧光,以PBS缓冲液替代兔抗人vWF抗体的阴性对照无此反应。如图3显示,所有的细胞均为HUVEC,纯度接近100%。
2.2 不同接种密度细胞生长状态的比较
比较了4个接种密度下原代HUVEC细胞的生长状态及原代培养时间,结果见表1。1×104mL-1组细胞分布稀疏,培养10 d以上未达到汇合,且后期细胞变大、形态不规则,不能传代; 1×107mL-1组细胞密度太高,平均1.2 d即达到汇合需要传代;1×106mL-1组平均4.1 d能达到80%汇合,可以传代,认为1×106mL-1是适宜的接种密度。

图1 倒置显微镜下观察HUVEC呈典型的“铺路石”形态(100×)Fig.1 The characteristic “cobblestone” morohology of HUVEC in culture under an inverted microscope(100×)
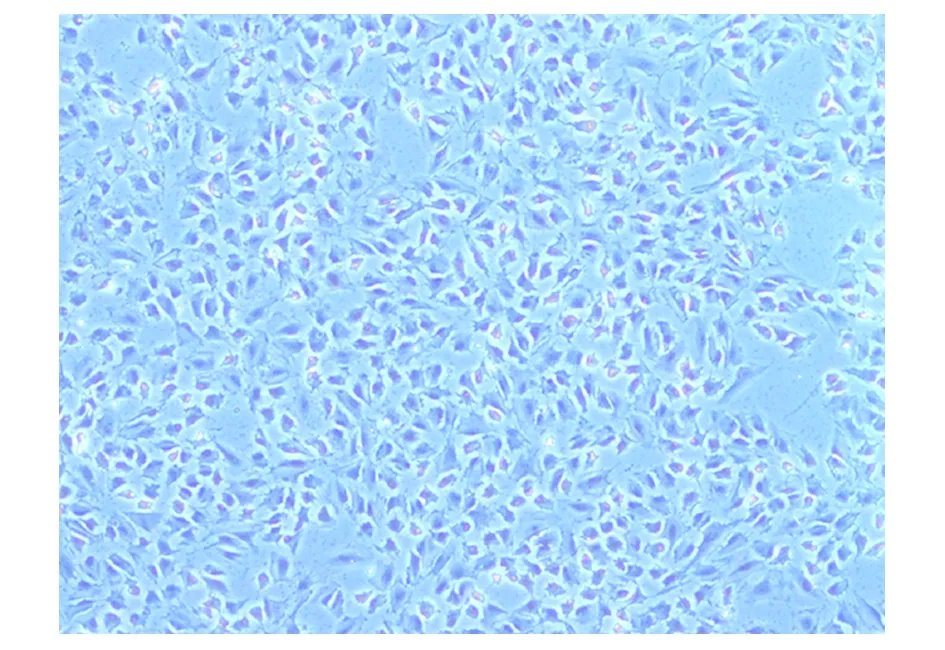
图2 HUVEC的吉姆萨染色(100×)Fig.2 Giemsa staining of HUVEC(100×)

图3 vWF抗体免疫荧光法鉴定HUVEC(100×)Fig.3 Identifying the HUVEC by immunostaining with antibodies against vWF factor(100×)
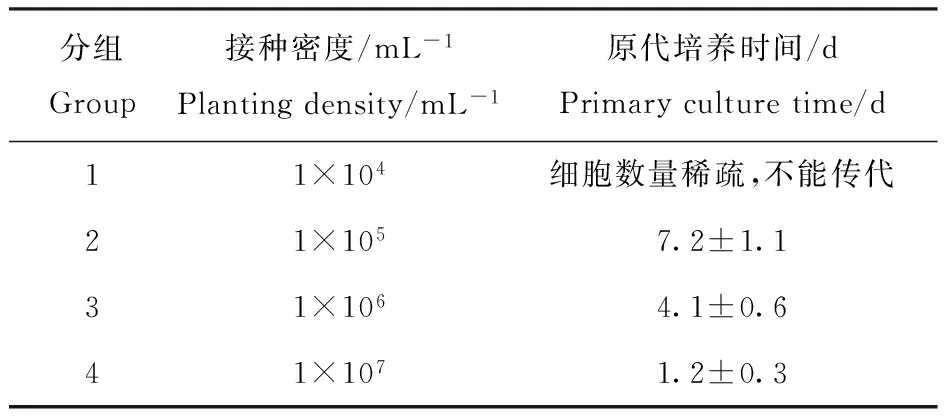
表1 原代培养不同接种密度下原代培养时间的比较Table 1 Comparing the primary culture time in different planting density
2.3 不同胰酶消化时间对传代后细胞数量及活力的影响
当胰酶消化时间为1 min时,细胞并未全部从培养板底部脱落,传代后的培养瓶中,细胞浓度太低;当消化时间为3 min时,胰酶对细胞的作用时间太长,使细胞活力降低,导致传代后的培养瓶中细胞长势不好,且贴壁性差。结果表明,最佳的消化时间是2 min,此时,培养板上的细胞几乎完全脱落,而且传代后的细胞能在2 h左右贴壁,长势良好。所以,本实验消化时间采用2 min,消化过程中,用显微镜检测细胞分离的状态,也可以轻轻敲打细胞瓶的侧壁,以促进细胞分离。
3 结论与讨论
3.1 HUVEC分离培养条件的优化
胶原酶灌注消化法分离HUVEC作用温和,能够获得纯度较高的内皮细胞,适用于人和多种动物较大血管内皮细胞的分离和培养,故是分离血管内皮细胞的常用方法[6]。本实验使用输液器的延长管将胶原酶注入静脉后,顶端和末端均用止血钳固定,避免了注射器直接接触静脉内皮,对内皮细胞造成损伤,从而使得酶消化的方法简单高效[7]。原代培养时,对胶原酶消化时间进行了优化,结果表明II型胶原酶的最佳消化时间是15 min。传代培养时,胰酶-EDTA的最佳消化时间是2 min,而且这一时间也并非固定,取决于胰酶-EDTA的活力(如反复冻融会降低胰酶活力)。总之,当胰酶-EDTA消化细胞时,应在倒置显微镜下,密切关注细胞的动态,当细胞大范围开始流动,即终止消化。
接种密度亦是影响细胞生长的关键因素。密度过高影响贴壁细胞的伸展和营养;密度过低,细胞无法形成生长需要的细胞社会,生长缓慢造成无法传代或达到传代密度所需的时间过长,造成原代细胞老化,失去了原有形态及特性[8]。且不同的细胞类型适宜的接种密度是不同的,故需要通过实验摸索。经比较发现,1×106mL-1是HUVEC适宜的接种密度。HUVEC属于难贴壁型的细胞,体外培养时细胞培养瓶和培养板预先用2%明胶包被处理会极大改善细胞的贴壁性能,增加培养细胞的存活率。
3.2 HUVEC培养基的选择
血清是动物细胞培养基的重要组成成分,血清质量的优劣直接影响细胞培养的成功与否[9]。作者对20余次的培养条件进行摸索,比较了不同厂家、不同来源的血清对细胞生长状态的影响,结果表明选择高质量的胎牛血清是HUVEC培养成功的关键,并在原代培养中使用20%血清含量的M199培养基以利于细胞的贴壁,24 h后更换为10%血清含量的培养基即能满足HUVEC生长的需要。内皮细胞生长因子(vascular endothelial growth factor,VEGF)是维持血管内皮细胞在体外长期培养的必要条件[10]。在实验中发现,培养基中加入了VEGF后,细胞的长势和贴壁性都比没添加VEGF时有明显的改善。文献显示,HUVEC培养时肝素钠的添加可使内皮细胞的纯度提高[11];谷氨酰胺在细胞生长过程中会消耗,亦需在培养基中补充添加。
本实验建立的分离培养方法培养的HUVEC原代细胞和传代细胞经倒置显微镜观察、姬姆萨染色形态观察及免疫荧光染色技术鉴定,可以确定培养的细胞为内皮细胞且纯度高、细胞贴壁性好,为进一步的基础和临床研究提供有用的细胞模型。
[1]Siow RC.Culture of human endothelial cells from umbilical veins[J].Methods Mol Biol,2012,806:265-274.
[2]严凤英,于萍,关林波,等.原代人脐静脉内皮细胞分离培养方法的探讨及其鉴定[J].华西医学,2010(4):727-729.
[3]Maciag T,Hoover GA,Stemerman MB,et al.Serial propagation of human endothelial cells in vitro[J].J Cell Biol,1981,91(2):420-426.
[4]Mitry RR HRD.Human Cell Culture Protocols[M].London:Springer science,2012(3):265-274.
[5]Krause BJ,Prieto CP,Munoz-Urrutia E,et al.Role of arginase-2 and eNOS in the differential vascular reactivity and hypoxia-induced endothelial response in umbilical arteries and veins[J].Placenta,2012,33(5):360-366.
[6]Holzhauser E,Albrecht C,Zhou Q,et al.Nicotinic acid has anti-atherogenic and anti-inflammatory properties on advanced atherosclerotic lesions independent of its lipid-modifying capabilities[J].J Cardiovasc Pharmacol,2011,57(4):447-454.
[7]阮溦,李锁北,戴如平,等.人脐静脉内皮细胞的体外改良分离、培养及鉴定[J].中国现代医学杂志,2010(6):848-850.
[8]贾涵婧,王逸群,黄锭,等.微载体浓度与细胞接种密度对MDCK细胞生长的影响[J].中国生物制品学杂志,2014(9):1138-1144.
[9]庞钰莹,岳文斌,于雪静,等.绵羊卵巢卵泡颗粒细胞体外培养中促卵泡素和胰岛素浓度优化研究[J].山西农业大学学报(自然科学版),2012,32(6):540-543.
[10]Harjes U,Bridges E,McIntyre A,et al.Fatty acid binding protein 4,a point of convergence for angiogenic and metabolic signalling pathways in endothelial cells[J].J Biol Chem,2014,289:23168-23176.
[11]校娟.原代狒狒股动脉内皮细胞的炎症损伤机制和干预研究[D].山东大学,2013.
(编辑:马荣博)
Establishment and Optimizing of the Method of Isolating and Culturing Human Umbilical Vein Endothelial Cells in Vitro
Ma Zhenhua1,Zhang Lianjie2,Ma Yanqin1*
(1.CollegeofLifeScience,ShanxiAgriculturalUniversity,TaiguShanxi030801,China;2.ShanxiKeyLaboratoryofEnvironmentalVeterinaryMedicine,ShanxiAgriculturalUniversity,TaiguShanxi030801,China)
Objective To build a simple and efficient culture system which can get more and active human umbilical veins endothelial cells.Methods The newborn umbilical cord was collected and placed in the HBSS collection medium.A cannula was inserted into the vein.Pre-warmed collagenase II was filled into it to isolate the endothelial cells.The cells were collected by centrifugation and resuspended in serum containing culture medium.Then they were transfered to a tissue culture flask and placed in an incubator at 37℃,5% CO2.When a confluent monolayer had formed,the HUVECs were subcultured by 0.25% trypin solution.The cells were observed using an inverted microscope and stained with Giemsa.Then the cells were identified by their positive immunostaining with antibodies against vWF factor.The optimal digestion time of collagenase and trypin was identified.The optimal planting density was analyzed.Result The optimal digestion time of collagenase was 15 min in primary culture and that of the trypin in subculture was 2 min.The optimal planting density was 1×106mL-1The confluent monolayers of HUVEC exhibited the characteristic "cobblestone" morohology in culture under an inverted microscope.Immunofluorescence showed that the cytoplasm presented green fluorescence which was vWF factor positive cell.The nucleus was dyed blue by DAPI.The purity of the cultured endothelial cells was almost 100%.Conclusion We established successfully the optimal system of primary HUVEC culture,which provided high-graded cell models for further research.
Human umbilical vein endothelial cells; Collagenase digestion; Giemsa staining; Immunofluorescence
2014-12-06
2015-01-10
马振华(1989-),女(汉),山西大同人,在读硕士,研究方向:心血管毒理学。
*通讯作者:马艳琴,博士,副教授,硕士生导师。Tel:0354-6286908; E-mail:mayanqin466@163 com
国家自然科学基金(31302155,31302158);山西农业大学博士启动基金(2013YJ39)
Q813.1
A
1671-8151(2015)03-0285-05
