新型油料作物亚麻荠种子油脂积累的研究
2015-04-19苑丽霞郝敬云周广航薛金爱李润植
苑丽霞,郝敬云,周广航,薛金爱,李润植*
(1.山西农业大学 分子农业与生物能源研究所,山西 太谷 030801;2.晋中学院 生物科学与技术学院,山西 晋中 030600)
新型油料作物亚麻荠种子油脂积累的研究
苑丽霞1,2,郝敬云1,周广航1,薛金爱1,李润植1*
(1.山西农业大学 分子农业与生物能源研究所,山西 太谷 030801;2.晋中学院 生物科学与技术学院,山西 晋中 030600)
亚麻荠(Camelinasativa(L.) Crtz.)是一种新型优质油料作物,含油量高达40%以上,其中不饱和脂肪酸亚油酸和亚麻酸占油脂的58%以上,广泛应用于食品生产和多种工业领域。为更深入解析亚麻荠种子油脂合成与积累机制,测定了在山西太谷自然条件下,亚麻荠种子形态发育、种子含油量、种子脂肪酸组成,以及蛋白质合成积累的动态过程。结果发现:发育早期阶段1~16 DAF(days after flowering)的亚麻荠种子高含棕榈酸、硬脂酸和油酸,但含油量较低;在种子发育中间阶段16~24 DAF,种子油脂迅猛积累,多种长链不饱和脂肪酸含量大幅度提高,在24 DAF每粒平均含油量可达0.47 mg,含油量达到26.8%;在种子发育后期阶段24~36 DAF,油脂合成与积累相对缓慢,由于干燥失水,含油量持续升高。在36 DAF的时候与其它组织根、茎、叶等营养器官相比,种子中亚油酸和亚麻酸的含量较高,分别是14.8%和41.3%。本文为亚麻荠新种植区域品种遗传改良和建立相配套的栽培体系提供科学参考。
亚麻荠;种子发育;种子油;脂肪酸;油脂积累
亚麻荠(Camelinasativa(L.) Crantz )是一种十字花科一年生草本植物,起源于欧洲东南地区和亚洲西南地区,一直是在欧洲许多国家广泛种植的一种重要油料作物[1]。亚麻荠具有优良的农艺性状,如高产、早熟、对危害十字花科植物的多数害虫和病原菌都有很强的抗性,对不利的环境条件具有较强的适应性,对水分和养分的需求也较低,可以在干旱、贫瘠、盐碱地等边际土地生长和种植[2]。
亚麻荠种子含油量可达36%~47%,约是大豆含油量(18%~22%)的2倍[3]。种子油主要脂肪酸成分包括棕榈酸(16∶0)、硬脂酸(18∶0)、油酸(18∶1)、亚油酸(18∶2)、亚麻酸(18∶3)、花生酸(20∶0)、二十碳烯酸(20∶1)和芥酸(22∶1)等。亚麻荠种子油突出优点是含有多种对人体有益的不饱和脂肪酸(油酸、亚油酸和亚麻酸),尤其是高水平的α-亚麻酸(ω-3脂肪酸),是应用于人类营养、心血管及大脑等保健和功能食品生产等的珍贵高值脂肪酸[4]。亚麻荠因较高的不饱和脂肪酸含量不仅广泛应用于食品领域,更适用于生产生物燃油和润滑剂,是应用于工业领域的再生能源物质[5,6]。另外,由于亚麻荠生育期仅80~100 d,作为一种重新发掘的优质能源作物,现今亚麻荠新种植区域快速扩展,全面评估在新种植区域条件下亚麻荠生长发育和种子品质等农艺性状就成为一项迫切任务。
我们课题组近年来在山西太谷新种植地域开展了亚麻荠引种、试验、新品种培育和种子油脂代谢工程等研究。本文报道的有关亚麻荠优良种质SC-N16 在山西太谷大田自然条件下种子形态发育和种子油脂生物合成积累的研究结果,将为当地亚麻荠新品种的选育和建立这种新型能源作物在当地优化栽培种植和新的耕作体系提供科学指导和参考。
1 材料与方法
1.1 材料的种植
亚麻荠种质材料选用优良SC-N16品种(来自系统选育),6月15日播种于山西农业大学试验田,常规大田管理。用于分析的种子材料分别取自4、8、12、16、20、24、28、32和36 DAF(花后天数)共 9个不同发育时期的亚麻荠植株。在36 DAF选取植株幼嫩的根、茎、叶材料,其中根部材料用自来水反复冲洗掉表面土层,所有新鲜样品先在液氮中速冻,然后-80℃保存。用于分析的每份种子和组织材料均为随机取材于至少6个不同的植株。
1.2 种子大小及鲜重测定
取9个不同发育时期种子样品各50粒,先用分析天平称量种子鲜重。而后各样品随机选取30粒种子,在解剖镜下实测种子长度和宽度。各样品生物学重复至少6次。
1.3 种子总油脂和脂肪酸成分测定
亚麻荠种子和其他组织样品的总油脂提取按照Dahmer 等[7,8]方法进行。取20~30 mg 亚麻荠种子或组织,研磨成粉末状,放入6 cm 长的有盖玻璃试管,向玻璃管中加入1 mL5%(V/V)硫酸甲醇,同时以10 μg/10 mg 样品的标准加入十七烷酸甘油三酯 (C17∶0) 作为内标,90~95℃ 加热1.5 h。加入 1 mL 含有0.01% (W/V)丁化羟基甲苯 (BHT) 的己烷,混匀后离心,萃取脂肪酸甲酯(FAMEs)。用HP 5890A气相色谱仪检测各种脂肪酸,检测程序中起始温度设定为 120℃,氦气作为运载气体,流速为 10 mL·min-1。色谱仪所测原始数据经匀质化处理后,按相应的公式计算各脂肪酸含量和总油脂含量。各样品生物学重复至少6次。计算各样品脂肪酸含量的平均值 ± 标准误。
1.4 种子蛋白质和水分的测定
蛋白测定:利用LECO CHNS-932分析仪,取100粒干燥的亚麻荠种子,通过元素分析检测蛋白含量,以N含量乘以6.25得到总蛋白含量。各样品生物学重复至少6次。水分测定:将100粒亚麻荠种子鲜样品进行48 h 、80℃干燥处理。测定干燥处理前后的重量/mg,处理前重量减去干燥处理后的重量即为所测样品的种子水分含量。各样品生物学重复至少6次。
所用数据都采用DPS 6.5软件进行统计分析,差异显著性用t检验,利用Excel 2013进行数据处理与作图。
2 结果与分析
2.1 亚麻荠种子及果实发育形态学特征
亚麻荠果实为短角果、呈倒梨形(图1),随着发育由浅绿(幼果)变为深绿(中期果实)。 从自然脱水开始,果实色泽逐渐去绿变为成熟时暗土黄色。36DAF时每粒果重为6.8~11.5 mg,成熟种子棕褐色、呈卵圆形。自然成熟时,种子百粒重为97~113 mg,是拟南芥种子百粒重的48倍多(图2)。
亚麻荠种子的发育早期先进行伸长生长,然后开始加宽横向生长。在16DAF时,种子长宽比基本固定。在4 DAF到36 DAF的发育期间内,长度变化范围是1.13~2.48 mm,宽度变化范围是0.83~1.49 mm,鲜重变化范围是0.52~2.37 mg。亚麻荠在16 DAF时,种子大小和鲜重均达到最高值(图3),且与前期相比,均呈显著增长趋势,在后期均呈缓慢下降趋势。种子在发育前期呈乳白色,随着光合作用加强,种子色泽逐渐变绿,到24DAF呈墨绿色。在种子发育后期,因光合减弱和干燥失水,种子色泽逐渐呈现黄褐色。

图 1 亚麻荠种子和角果发育过程中的形态变化Fig.1 Morphological changes of Camelina sativa fruits and seeds during development注:a、b、c、d、e、f、g、h、i:分别表示开花后4、8、12、16、20、24、28、32、36天的种子;A、B、C、D、E、F、G、H、I:分别表示开花后4、8、12、16、20、24、28、32、36天的角果.Note:a、b、c、d、e、f、g、h、i: respectively means 4、8、12、16、20、24、28、32、36 DAF seed;A、B、C、D、E、F、G、H、I: respectively means 4、8、12、16、20、24、28、32、36 DAF silique.

图 2 亚麻荠与拟南芥种子大小比较Fig.2 Seed size comparison between Camelina sativa and Arobidopsis thaliana注:亚麻荠种子百粒重为97~113 mg; 拟南芥种子百粒重为2.1~3.4 mg.Note: Camelina: 97~113 mg per 100seeds; Arabidopsis: 2.1~3.4mg per 100seeds.
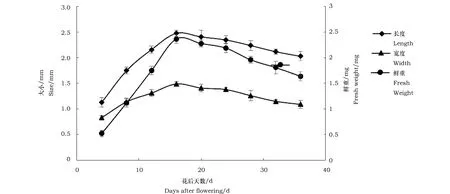
图 3 亚麻荠发育种子大小和鲜重的变化Fig.3 Changes in size and fresh weight of Camelina sativa seeds during development
2.2 亚麻荠种子发育过程中油脂和蛋白积累的动态变化
取不同发育时期亚麻荠种子样品,分别检测种子油脂和蛋白积累的动态变化。油脂和蛋白合成积累的速度在不同阶段有显著差异(图4)。亚麻荠种子发育早期阶段(1~16 DAF)是种子形成期,此阶段油脂合成与积累相对缓慢,蛋白质合成积累很快。到种子发育中期阶段(16~24 DAF),油脂急剧大量合成积累,积累速率约15 μg·d-1。在24 DAF时,含油量显著增长,达到26.8%(干重),而每粒含油量可达到0.47 mg。种子发育后期阶段(24~36 DAF)是成熟脱水期,油脂合成与积累持续缓慢上升,由于干燥失水,含油量继续增加。在16 DAF到36 DAF时期,蛋白质合成积累速度减慢,积累量明显低于油脂水平。在亚麻荠种子成熟干燥前,水分含量虽逐渐变少却始终占较大比例,蛋白质在种子发育早期积累相对较高,在后期发育过程中虽仍在不断积累,但相对含量增加缓慢。
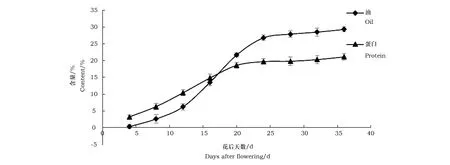
图 4 亚麻荠种子发育过程中油与蛋白的含量变化Fig.4 Content changes of oil and protein in Camelina sativa seeds during development
2.3 亚麻荠种子发育过程中油脂成分的动态变化
在亚麻荠种子发育至成熟的过程中,种子油各脂肪酸成分的合成积累也有明显不同的动态变化(表1)。棕榈酸(16∶0)、硬脂酸(18∶0)和花生酸(20∶0)等饱和脂肪酸在种子发育早期合成积累多,分别为21.7%、 19.5%和3.2%。随着种子发育,这3种脂肪酸含量先增长,然后再逐渐降低为6.9%、2.5%和1.2%。相反,亚麻酸(18∶3)、二十碳烯酸(20∶1)和芥酸(22∶1)的含量从发育早期的0.3%、0.1%和0 分别持续增加合成积累高达41.3%、11.4%和5.6%。油酸(18∶1)和亚油酸(18∶2)的合成积累变化趋势表现为前期由低(18.9%和14.6%)到高(25.1%和34.1%),后期则从峰值逐渐降低(6.1%和14.8%),其中油酸峰值出现在12 DAF,然而亚油酸峰值出现在16 DAF。
脂肪酸成分这种动态变化显然与参与脂肪酸合成途径酶蛋白功能的时序表达有关。棕榈酸、硬脂酸和油酸是在质体内从头合成,然后从质体转出进入细胞质。因此在发育早期这3种脂肪酸含量高。进入细胞质后,他们在脂肪酸脱氢酶作用下生成长链单不饱和脂肪酸(20∶1)多不饱和脂肪酸(18∶2,18∶3),或在脂肪酸延长酶催化下碳链加长生成(20∶0)和(22∶1)。这样在种子发育后期,棕榈酸、硬脂酸和花生酸以及油酸含量逐渐降低。然而,其他几种长链脂肪酸则随着种子发育持续上升。
2.4 亚麻荠不同组织中油脂成分的变化
进一步检测亚麻荠根、茎和叶等营养器官各种脂肪酸含量可为亚麻荠营养器官的综合利用提供依据。如表2所示,饱和脂肪酸即棕榈酸、硬脂酸和花生酸在根茎叶器官中含量显著高于种子中含量,而亚麻酸和二十碳烯酸含量测明显低于种子中的水平。其他几种脂肪酸在营养器官和种子中含量差异不大。
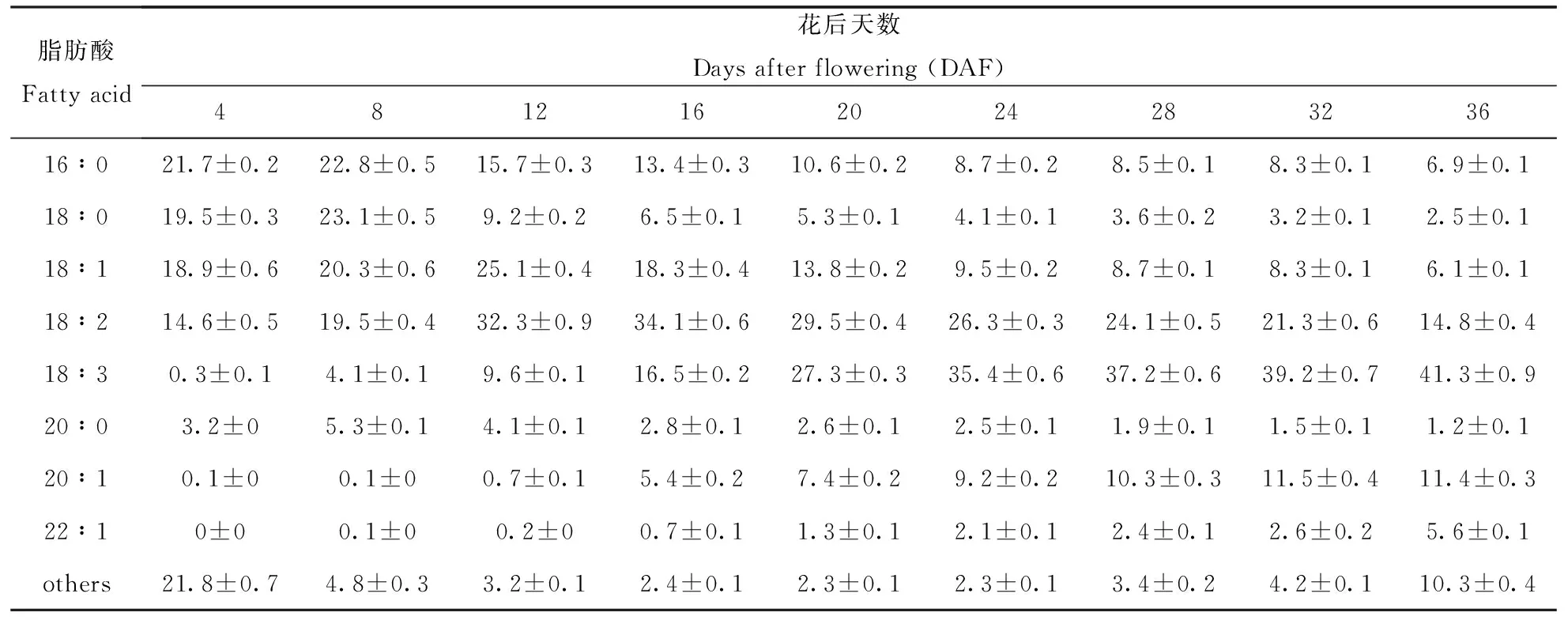
表1 亚麻荠种子在不同发育时期的脂肪酸组成Table 1 Fatty acid profiles (% wt) of camelina sativa seeds at different development stages
注:数据来自6个独立实验,以(平均值±标准误)表示。16∶0(棕榈酸),18∶0(硬脂酸),18∶1(油酸),18∶2(亚油酸),18∶3(亚麻酸),20∶0(花生酸),20∶1(二十碳烯酸),22∶1(芥酸),others(其它脂肪酸)。下表同。
Note:Data represent the mean of 6 independent determinations.Values showed by mean ± stand error.16∶0(Palmitic acids),18∶0(Stearic acids),18∶1(Oleic acids),18∶2(Linoleic acids),18∶3(Linolenic acids),20∶0(Arachidic acids),20∶1(Eicosenoic acids),22∶1(Erucic acids),others(Other fatty acids).The same as bellow.
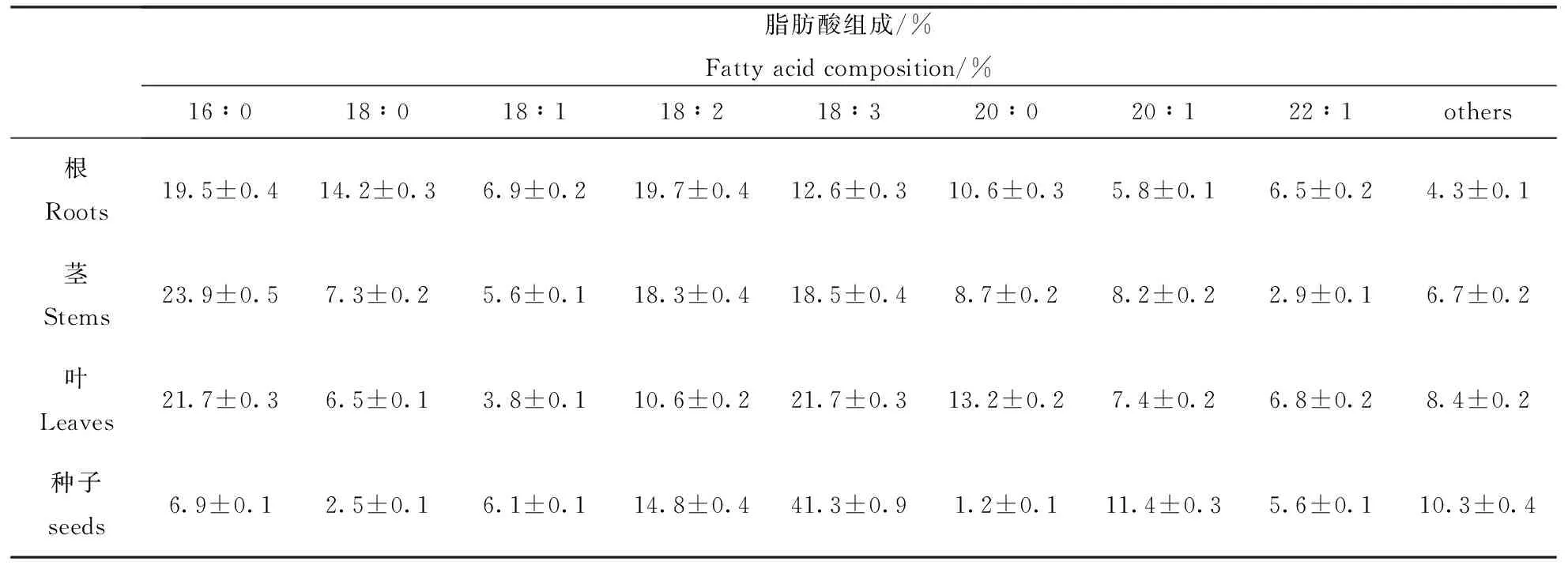
表2 亚麻荠不同器官中脂肪酸的组成Table 2 Fatty acid composition (% wt) of camelina sativa organs
3 讨论与结论
亚麻荠作为一种非粮的新型能源油料作物,产量高达2 800 kg·hm-2,种子含油量高达480 g· kg-1,ω-3型脂肪酸即亚麻酸占总油脂的25%~42%。这些特征使得亚麻荠在食品领域,特别是生物能源领域的应用受到人们的广泛关注。种子产量及种子油脂、蛋白品质等农艺性状的稳定性对其在新种植地域推广极为重要。然而,与其他作物一样,亚麻荠的籽粒产量,贮藏蛋白质和种子油脂、脂肪酸合成积累等性状又受很多因素的影响,包括品种、气候、地理位置、生长阶段和土壤环境,以及大田管理等[9~11]。
山西太谷是亚麻荠新引进种植区域,本文第一次检测了在太谷种植区域自然条件下亚麻荠种子发育和油脂、蛋白生物合成积累等性状表达。试验表明, 所测性状的变化处于正常变异范围之内。无论是春播还是复播和秋播,亚麻荠均能在该种植区域正常完成生长发育。与Rodríguez等[12]的研究结果相比,本试验所测得种子含油量及脂肪酸等数值比其他所测相应时期的数值略高,可能与试验所用品种、当地气候和土壤条件影响有关。进一步分析种子产量高低和种子大小、种子含油量等性状的相关性,发现为负相关,这与已有报道基本相似[13]。正是由于这种负相关存在,使得同时提高种子含油量和种子重量(百粒重)的遗传改良进展缓慢,收效不大。
亚麻荠还是一种适于轮作和复种的环境友好型油料作物。Chatenet等[14]研究发现每年3月下旬是亚麻荠高产的最佳播种期。我们从3月到10月每隔半月播种一次,发现在亚麻荠新引进地(山西太谷)6月底7月初播种,能在9月中旬完全成熟和收获。当地小麦于6月10日前后收割,小麦收获后完全可以复播亚麻荠,从而增加一季作物收获。值得进一步深入研究,以便在当地建立一种投资少、见效快、效益高的复种亚麻荠提高单位面积土地产值的新耕作模式。本文有关亚麻荠种子发育及种子油脂积累动态变化的分析,对亚麻荠新品种的选育、当地栽培种植技术配套,以及工业应用具有科学参考价值。
[1]Battey JF,Schmid,KM,Ohlrogge,JB.Genetic engineering for plant oils:potential and limitations [J].Trends Biotechnol,1989,7: 122-126.
[2]Zubr J.Oil seed crop:Camelinasativa[J].Industrial Crops and Products,1997,6:113-119.
[3]Moser,B.R.Biodiesel from alternative oilseed feedstocks: camelina and field pennycress [J].Biofuels,2012,3:193-209.
[4]Chaofu Lu,Jinling Kang.Generation of transgenic plants of a potential oilseed cropCamelinasativabyAgrobacterium-mediated transformation [J].Plant Cell Rep,2008,27:273-278.
[5]Kagale S,Koh C,Nixon J,et al.The emerging biofuel cropCamelinasativaretains a highly undifferentiated hexaploid genome structure [J].Nature Communications,2014,23(5): 3706.
[6]Vollmann J,Damboeck A,Eckl A,et al.Improvement ofCamelinasativa,an under exploited oilseed.In: Janick Jed.Progress in New Crops [M].Alexandria: ASHS Press,1998:357-362.
[7]Dahmer ML,Fleming PD,Collins GB,et al.A rapid screening technique for determining the lipid composition of soybean seeds [J].J Am Oil Chem Soc,1989,66(4): 543-548.
[8]薛金爱,毛雪,吴永美,等.酿酒酵母脂酰-△9脱氢酶亚细胞定位表达及其对烟草脂肪酸合成的影响[J].生物工程学报,2013(5):630-645.
[9]邓曙东,张青文.亚麻荠种植和利用的研究现状[J].植物学通报,2004,21 (3):376-382.
[10]Josef Z.Oil-seed crop:Camelinasativa[J].Industrial Crops and Products,1997,6(2): 113-119.
[11]Zubr J.Qualitative variation ofCamelinasativaseed from different locations [J].Industrial Crops and Products,2003,17: 161-169.
[12]Manuel Fernando Rodríguez-Rodríguez,Alicia Sánchez-García,Joaquín J.Salas.Characterization of the morphological changes and fatty acid profile of developingCamelinasativaseeds [J].Industrial Crops and Products,2013,50: 673- 679.
[13]Johann Vollmann,Thomas Moritz,Christine Kargl et al.Agronomic evaluation of camelina genotypes selected for seed quality characteristics [J].Industrial Crops and Products,2007,26:270-277.
[14]Chatenet F.Cultivation ofCamelina[J].Oleoscope,1998,48: 27-28.
(编辑:武英耀)
Study on Accumulation of Seed Oil inCamelinasativa,A New Alternative Oilseed Crop
Yuan Lixia1,2,Hao Jingyun1,Zhou Guanghang1,Xue Jin'ai1,Li Runzhi1*
(1.InstituteofMolecularAgricultureandBioenergy,ShanxiAgriculturalUniversity,TaiguShanxi030801,China;2.CollegeofBiologicalScienceandTechnology,JinzhongUniversity,JinzhongShanxi030600,China)
Camelinasativa(L.) Crtz is a new alternative oilseed crop that produces seeds containing up to 40% oil,among the oil,content of unsaturated fatty acids linoleic and linolenic acid is up to 58%.ω-3 and ω-6 fatty acids (found mainly as linoleic and linolenic acid) are mostly used for food and industrial applications.For comprehensive understanding of Camelina oil synthesis in seed development under the natural environments in Taigu,Shanxi,we characterized the morphological changes,oil content,the fatty acid content and composition of developing Camelina seeds.In the early stages of seed development (1~16DAF,days after flowering),higher levels of palmitic,stearic and oleic acids were formed but total oil lower.During the middle developing period (16~24 DAF),the fatty acid composition progressively changed and produced many kinds of long-chain unsaturated fatty acids,oil content is up to 26.8%,and 0.47 mg each seed at 24 DAF.The final developmental stages (24~36 DAF),at which seed oil content increased due to desiccation.Compared to the vegetable organs including roots,stems and leaves,seed at 36 DAF accumulated much higher levels of linoleic acid (up to 14.8%) and linolenic acid (up to 41.3%).The present data provide some scientific references for Camelia genetic improvement and developing a cultivation system in such newly expanded areas for this important oilseed.
Camelinasativa;Seed development;Seed oil;Fatty acid;Oil accumulation
2015-02-11
2015-04-02
苑丽霞(1979-),女(汉),山西武乡人,博士研究生,研究方向:分子遗传与基因工程
*通讯作者:李润植,教授,博士生导师。Tel:0354-6288374; E-mail: rli2001@hotmail com
国家自然科学基金(30971806;31201266;31401430),国家“948”项目(2014-Z39),山西省煤基重点科技攻关项目(FT-2014-01)
S565.9
A
1671-8151(2015)03-0271-06
