传统细菌培养法、实时荧光PCR法在冷却水中的比较*
2015-04-19袁展红周日东吴灿权刘绮明
袁展红 周日东 吴灿权 刘绮明
军团菌广泛存在于各种天然和人工水环境中,其中嗜肺军团菌是引起非典型肺炎的重要病原菌,具有极强的传染性和较高的病死率,严重危害人类的健康和生命安全,已成为世界性的公共卫生问题;嗜肺军团菌在美国首次被发现,它主要是通过建筑物的水系统进行传播,感染该菌后发病速度快,死亡率高,我国自1982年在南京首次证实军团病以来,已有资料证实军团菌污染冷却水与军团菌病的暴发密切相关[1]。2003年卫生部《公共场所集中空调通风系统卫生规范》中明确规定在空调冷却水中不得检出军团菌[2]。冷却水中军团菌传统实验室检测采用细菌培养、生化反应和血清学鉴定等方法,耗费时间长,易受水中杂质和其他微生物的干扰,检测结果的时效性和准确性难以满足疫情控制的需求,而实时荧光PCR法因其操作简便、快速可靠、抗污染性强等优点,已逐渐得到广泛应用。本次研究就冷却水中嗜肺军团菌传统细菌培养法和实时荧光PCR法检测结果进行对比分析,现报道如下。
1 资料与方法
1.1 主要仪器 Opticon 2实时荧光定量PCR仪(美国MJ Research公司),多功能智能厌氧系统(荷兰MART公司),Microfic微检过滤系统(美国Minipore公司)。
1.2 主要试剂 军团菌诊断血清购自日本生研株式会社和天津生物芯片技术有限责任公司,GVPC、BCYE、BCYECyS琼脂平板购自某公司,嗜肺军团菌实时荧光PCR检测试剂盒购自某公司,所有试剂均在有效期内使用。
1.3 水样采集 抽取某市范围的集中空调冷却水,以灭菌玻璃瓶采集500 mL水样,采样后立即送实验室当天检验。
1.4 方法
1.4.1 军团菌的分离培养与鉴定 按照卫生部《公共场所集中空调通风系统卫生规范 附录A》(2013)的要求进行军团菌检测[3]。
1.4.2 传统细菌培养法 (1)水样处理:将水样预处理后通过孔径0.45 μm滤膜过滤,取下滤膜置于灭菌水中,充分洗脱,备用。(2)热处理:取1 mL洗脱样品置50 ℃水浴加热30 min。(3)酸处理:取2 mL洗脱样品调pH至2.2摇匀放置5 min。(4)分离培养:将不处理和经处理的样品各0.1 mL分别接种GVPC琼脂平板,置于35~37 ℃、2.5% CO2培养1~10 d,每天观察菌落生长情况。(5)军团菌的鉴定:凡是在GVPC琼脂平板上48 h后生长,菌落呈灰白色、圆形稍凸、边缘整齐、表面光滑湿润、毛玻璃状,挑起似牙膏状,可初步确定为可疑菌落[4]。挑取可疑菌落接种BCYE和BCYE-CyS琼脂平板,35~37 ℃培养2 d,凡在BCYE琼脂平板生长而在BCYE-Cys琼脂平板不生长的菌落可初步认定为军团菌,再通过革兰氏染色涂片镜检、生化试验、血清凝集试验鉴定军团菌。
1.4.3 实时荧光PCR测定 (1)样品处理:取待测样品1 mL加到1.5 mL无菌离心管中,8000 rpm离心5 min,弃上清,加入50 μL提取液,混匀后水浴5 min,13 000 rpm离心5 min,吸取上清液进行PCR检测。(2)PCR扩增:反应体系为25 μL,包括DNA模板2 μL,PCR反应液22.5 μL,混合酶液0.5 μL[5]。反应条件设为第1步:37 ℃ 5 min,95 ℃3 min,1 个循环;第 2 步:95 ℃ 5 s,60 ℃ 40 s,40 个循环。FAM通道采集荧光信号。(3)结果判定:荧光定量PCR检测图见图1,荧光定量PCR检测以Ct值<37且扩增曲线呈S型为阳性判定原则,其中,样本检测结果Ct值<35,且曲线有明显的指数增长期,可直接判定为阳性;若样本检测结果Ct值35~37值,需重复检测,若两次实验均得到良好的S型扩增曲线则应判定为阳性[6]。
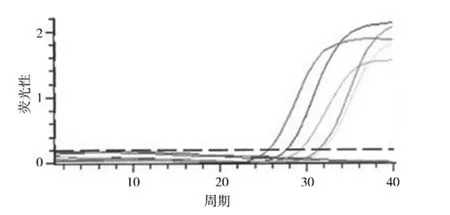
图1 荧光定量PCR检测图
1.5 统计学处理 使用SPSS 13.0统计学软件进行数据处理,计量资料采用(x-±s)表示,比较采用t检验,计数资料采用 字2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 培养法和实时荧光PCR法检测结果 64份冷却水通过培养法检出嗜肺军团菌8株,阳性率为12.50%,同时有14株有可疑菌落生长,通过实时荧光PCR法做进一步鉴定。对培养法分离出的8株嗜肺军团菌和14株有可疑菌株进行实时荧光PCR鉴定时,结果显示22株均为嗜肺军团菌阳性,阳性率为34.38%,两种检测方法差异有统计学意义( 字2=9.389,P<0.05)。
2.2 军团菌血清型分布 分离的22株嗜肺军团菌中,血清型分布以LP1为主,占菌株总数的68.18%(15/22),其次是LP3占菌株总数的13.64%(3/22),LP5和LP8各2株,LP6 1株。其中一份样品同时存在2种血清型(LP5和LP6)。
3 讨论
目前,军团菌已知有52个种,70多种血清型,能引起人类疾病的有20多种[7-8]。嗜肺军团菌是引起军团菌病的重要病原体,已发现15种血清型[9]。军团菌检测方法主要有分离培养法、免疫学检测法和分子生物学检测法。培养法是水军团菌检测标准方法,军团菌生长条件苛刻,要求特殊培养基,生长速度缓慢,活的不可培养军团菌的存在以及其他菌种在培养基上的过度生长影响培养法的检测结果,对实验人员的技术要求比较高,不能作快速鉴定。利用实时荧光PCR法检测环境样品中嗜肺军团菌,检测时间快,但PCR检测程序没有标准化,容易受样品中和前处理PCR抑制剂,核酸扩增过程中引物和探针选择等因素影响,产生一定假阴性和假阳性[10]。
将培养法分离的阳性菌株及可疑阳性菌株用实时荧光PCR法予以验证,结果均为阳性,随着培养基配方的改进,样品前处理技术的发展,培养法分离军团菌的灵敏度有所提高。朱兵清等[11-12]研究表明,在BCYE-a培养基中添加合适的抗生素可有效抑制环境水样中的杂菌,提高嗜肺军团菌的分离率。培养法具有不可替代的优点,如发现新菌种等[13]。随着实时荧光PCR技术的不断发展,检测方法敏感性和特异性会相应提高。培养法和实时荧光PCR技术的联合应用,将对军团菌污染早期预警具有重要作用。
[1]胡元玮,徐卸佐.公共场所中央空调系统军团军污染环节的调查[J].中国卫生检验杂志,2010,20(4):879-880.
[2]朱庆义,胡朝晖,梁耀铭,等.广东地区环境水源和临床标本嗜肺军团菌培养与基因快速鉴定[J].中华医院感染学杂志,2006,16(1):19-22.
[3]牛莉娅,程欣,郭玉梅,等.军团菌双重荧光定量PCR检测方法的建立于应用[J].环境卫生学,2014,4(1):76-80.
[4]张琦,陈晓东,张宝莹.嗜肺军团菌荧光定量PCR检测方法的建立[J].江苏预防医学,2010,2l(3):3-6.
[5]朱水荣,张政,卢亦愚,等.嗜肺军团菌荧光定量PCR检测[J].中国公共卫生,2008,24(9):1111-1113.
[6]欧阳松应,杨冬,欧阳红生,等.实时荧光定量PCR技术及其应用[J].生命的化学,2004,24(1):74-76.
[7]李达,张晶波,王永全,等.应用实时荧光PCR检测各种环境标本中的嗜肺军团菌[J].国际检验医学杂志,2014,35(12):1609-1611.
[8]杜昕颖,苏晓,王玉飞,等.嗜肺军团菌实时荧光定量PCR快速检测方法的建立[J].生物技术通讯.2013,24(6):843-845.
[9]吴冬雪,王乃福,黄晨.嗜肺军团菌15种血清型基因芯片检测方法的建立[J].食品研究与并发,2014,35(14):99-101.
[10]章乐怡,李毅,郑文力.公共场所冷却塔水嗜肺军团菌的基因序列分型研究[J].中国人兽共患病学报,2013,29(3):262-266.
[11]张颖,屈平华,张健,等.广州地区嗜肺军团菌环境分离株的基因序列分型分析[J].微生物学报,2011,51(3):320-325.
[12]朱兵清,任红宇,周海健,等.我国九省(市、区)82株嗜肺军团菌血清1型菌株的序列分型[J].中国预防医学杂志,201l,45(10):890-894.
[13] Yáñez M A,Carrasco-Serrano C,Barberá V M,et al.Quantitativedetection of Legionella pneumophila in water samples by immunomagnetic purification and real-time PCR amplification of the dotA gene[J].Appl Environ Microbiol,2005,71(7):3433-3441.
