脊髓缺血再灌注损伤对兔脊髓微循环的影响*
2015-04-18章建平章放香张竞超王泉云王儒蓉
方 华,章建平#,章放香,张竞超,王泉云,王儒蓉,刘 进
1)贵阳医学院附属人民医院麻醉科 贵阳 550002 2)四川大学华西医院麻醉科 成都 610041
脊髓缺血再灌注损伤对兔脊髓微循环的影响*
方 华1),章建平1)#,章放香1),张竞超1),王泉云2),王儒蓉2),刘 进2)
1)贵阳医学院附属人民医院麻醉科 贵阳 550002 2)四川大学华西医院麻醉科 成都 610041
#通信作者,女,1979年6月生,硕士研究生,主治医师,研究方向:临床麻醉学,E-mail:zhangjianping666@126.com
脊髓;缺血再灌注;微循环;核转录因子-κB;兔
目的:探讨脊髓缺血再灌注损伤(SCIRI)对脊髓微循环的影响。方法:采用肾下腹主动脉阻断模型,分别阻断兔腹主动脉30(C30组)、45(C45组)和60 min(C60组)后再灌注, 假手术组(C0组)不阻断血流。于缺血前、缺血期间、再灌注期间监测脊髓微循环血流速度和微循环血流量(SCMBF),再灌注120 min后观察脊髓组织中丙二醛(MDA)含量,诱生型一氧化氮合酶(iNOS)、髓过氧化物酶(MPO)、活性氧(ROS)活力,核转录因子-κBp65 (NF-κBp65)、抑制蛋白-κBα(I-κBα)和细胞间黏附分子-1(ICAM-1)蛋白的表达及脊髓病理学变化。结果:C30、C45、C60组脊髓组织分别表现为轻、中、重度SCIRI病理学改变。缺血再灌注期间,4组脊髓微循环血流速度和SCMBF的变化差异有统计学意义(F组间=12.051和54.514,F时间=66.084和171.028,F交互=12.032和35.752,P均<0.05);C45、C60组再灌注120 min时SCMBF仍未恢复至术前水平(P<0.05)。再灌注120 min 时,C0、C30、C45、C60组脊髓组织中MDA含量和iNOS、MPO、ROS活力依次增高(P<0.05),NF-κBp65和ICAM-1蛋白表达依次增强(P<0.05),I-κBα表达依次降低(P<0.05)。结论:脊髓微循环状态能够敏感而准确地反映SCIRI程度, ICAM-1和NF-κBp65表达上调加重脊髓微循环障碍。
微循环障碍是脊髓缺血再灌注损伤(spinal cord ischemia-reperfusion injury, SCIRI)中重要的病理生理学特征[1-2]。脊髓神经功能的维持依赖于微循环结构的完整,脊髓微循环障碍将严重影响SCIRI术后神经功能的恢复[3-6]。微循环障碍的发生发展与细胞间黏附分子(intercellular adhesion molecule,ICAM-1)等炎症信号转导启动的炎症反应有关,而核转录因子-κBp65(nuclear factor-kappa Bp65,NF-κBp65)和抑制蛋白-κBα(inhibitor-kappa Bα,I-κBα)的相互作用在调控炎症反应信号转导方面起重要作用[3-6]。作者比较了不同程度SCIRI模型兔脊髓微循环血流量(spinal cord microcirculatory blood flow,SCMBF)和血流速度的变化规律,同时观察了脊髓组织中ICAM-1、NF-κBp65和 I-κBα表达的变化。
1 材料与方法
1.1 主要试剂 鼠抗兔ICAM-1、I-κBα及 NF-κBp65 多克隆抗体均为Sigma公司产品;SABC检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、活性氧(reactive oxygen species,ROS)活力检测试剂盒、诱生型一氧化氮合酶(inducible nitric oxide synthase,iNOS)活力检测试剂盒及髓过氧化物酶(myeloperoxidase,MPO)活力检测试剂盒均为中国上海研吉生物科技有限公司产品。
1.2 动物模型的建立及实验分组 4~6月龄健康纯种新西兰大耳白兔40只,由四川大学实验动物中心提供,体重2.0~2.5 kg,雌雄不拘,按照随机数字表法分为假手术组(C0组)、C30、C45和C60组,每组10只。采用左肾动脉下方腹主动脉阻断法建立SCIRI动物模型[7]:耳缘静脉注射30 mg/kg戊巴比妥钠麻醉兔后,无菌条件下取腹正中切口,仔细分离并显露左肾动脉及腹主动脉,于左肾动脉起始点下方约0.5 cm处,用中号动脉夹暂时夹闭腹主动脉,夹闭前经耳缘静脉注射肝素1 mg/kg。证实钳夹点以下腹主动脉搏动完全消失后,C30、C45、C60组分别在阻断30、45和60 min后取消夹闭,开放腹主动脉行再灌注,时间均为120 min。C0组不阻断腹主动脉,其他操作同上。左腹股沟区备皮,消毒铺巾后股动脉插管监测血压并抽取血气。术中以生理盐水浸润的温纱垫覆盖腹腔脏器,肛门温度维持在36~37 ℃。术中监测心电图(ECG)、动脉血气、经皮脉搏氧饱和度、平均动脉压及肛门温度。
1.3 观测指标
1.3.1 脊髓微循环血流速度和SCMBF的测量 选用Peri Flux System 5001型多通道系统激光多普勒血流仪(瑞典PERIMED公司)测定缺血前、缺血1 min、缺血5 min、再灌注15 min、再灌注30 min、再灌注60 min和再灌注120 min时L3/4段的SCMBF:无菌条件下取背部正中切口,逐层切开背部皮肤、皮下及肌肉组织,充分暴露L3/4段腰椎间隙,用细嘴咬骨钳咬去双侧椎板,显露L3/4段脊髓。将无菌激光扫描探头与暴露的脊髓面成90°角贴于L3/4硬脊膜上,以获取脊髓微循环血流信号[8];将标准光纤探头置于腰椎旁肌表面作为对照。血流速度单位为VU(velocity unit),SCMBF的单位为PU(perfusion unit)。C0组在对应时间点测定血流速度和SCMBF。
1.3.2 脊髓组织病理学观察及ICAM-1、I-κBα和NF-κBp65蛋白的检测 各组分别于再灌注120 min后取L3/4节段脊髓组织,于福尔马林中固定。取一部分脊髓组织常规HE染色后,采用OlympusBX51图像采集分析系统等距随机抽样法观察脊髓组织病理学表现。另取一部分脊髓组织,采用免疫组化SABC法测定脊髓组织中ICAM-1、I-κBα和NF-κBp65的表达。参照文献[9],使用OlympusBX51图像采集分析系统等距随机抽样摄片并定量分析各时间点ICAM-1、I-κBα和NF-κBp65细胞核阳性细胞百分数和胞核平均灰度值。
1.3.3 脊髓组织中MDA含量和iNOS、MPO及ROS活力检测 各组分别于再灌注120 min后取L3/4节段脊髓组织,加入4 ℃生理盐水超声匀浆,3 500 r/min离心5 min后取上清液置于-80 ℃冰箱冻存,采用硫代巴比妥酸法测定脊髓组织中MDA含量,采用Fenton自由基反应法测定iNOS活力,采用过氧化氢还原法测定MPO活力,采用催化L-Arg氧反应法测定ROS活力,均按照试剂盒说明书操作。
1.4 统计学处理 采用SPSS 16.0进行统计分析,组间血流速度和SCMBF的比较采用重复测量数据的方差分析,组间MDA含量,iNOS、MPO、ROS活力和目的蛋白表达水平的比较采用单因素方差分析和SNK-q检验,检验水准α=0.05。
2 结果
2.1 动物一般情况 手术结束2 h内实验动物均完全清醒。实验过程中,动物均无意外死亡。
2.2 4组血流速度和SCMBF的比较 见表1、2。C0组血流速度和SCMBF均无明显变化。缺血后各损伤组血流速度和SCMBF均较缺血前迅速下降,缺血5 min时血流波形消失。C30组再灌注15和30 min时血流速度和SCMBF均高于缺血前,再灌注60和120 min时则明显下降至缺血前水平。C45、C60组再灌注15和30 min时血流速度和SCMBF均高于缺血前和同期C30组水平,再灌注60和120 min时血流速度和SCMBF均明显低于缺血前和同期C30组水平,C60组变化较C45组更显著。

表1 4组脊髓血流速度的比较 VU
F组间=12.051,F时间=66.084,F交互=12.032,P均<0.001;*:与缺血前比较,P<0.01;#:与C30组比较,P<0.01;▲:与C45组比较,P<0.01。

表2 4组脊髓SCMBF的比较 PU
F组间=54.514,F时间=171.028,F交互=35.752,P均<0.001;*:与缺血前比较,P<0.01;#:与C30组比较,P<0.01;▲:与C45组比较,P<0.01。
2.3 4组脊髓组织病理学表现 C0组脊髓组织结构完整,无出血、水肿等病理学表现,运动神经元轮廓清晰(图1A)。C30组脊髓组织中可见出血灶,运动神经元轻度肿胀,周围间隙增加,部分核仁不清(图1B)。C45组脊髓组织内出血灶明显,运动神经元显著肿胀,周围间隙明显增加,核仁不清,少量运动神经元空泡形成或变性坏死(图1C)。C60组脊髓组织内可见大片状出血灶,大量运动神经元变性坏死及广泛空泡形成(图1D)。
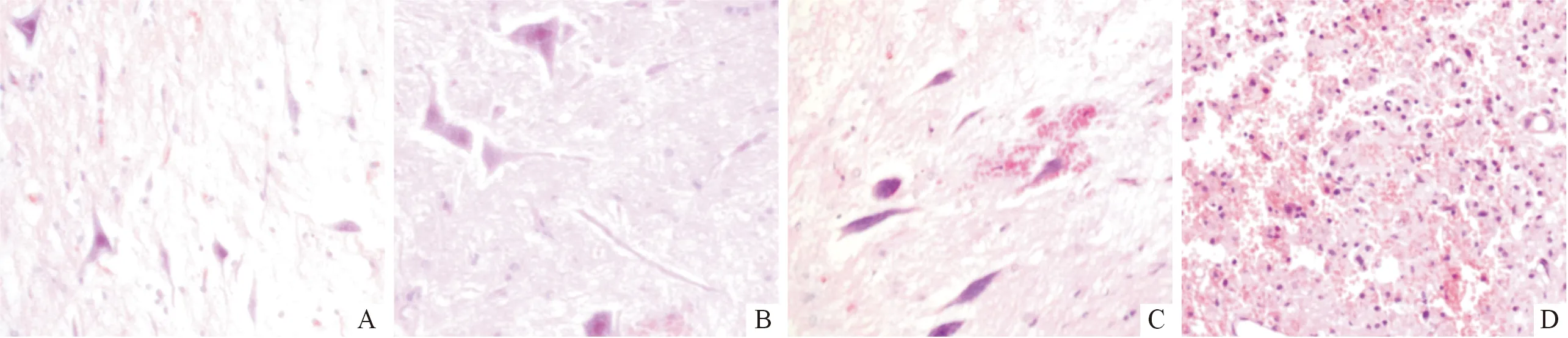
图1 脊髓病理学表现(HE, ×400)
2.4 4组脊髓组织中NF-κBp65、I-κBα和ICAM-1表达水平的比较 见表3。C0、C30、C45、C60组脊髓组织中NF-κBp65和ICAM-1蛋白表达依次增强,I-κBα表达则依次减弱。
2.5 4组脊髓组织中MDA含量及iNOS、MPO、ROS活力的比较 见表4。再灌注120 min时,C0、C30、C45、C60组MDA含量和iNOS、MPO、ROS活力依次增高。
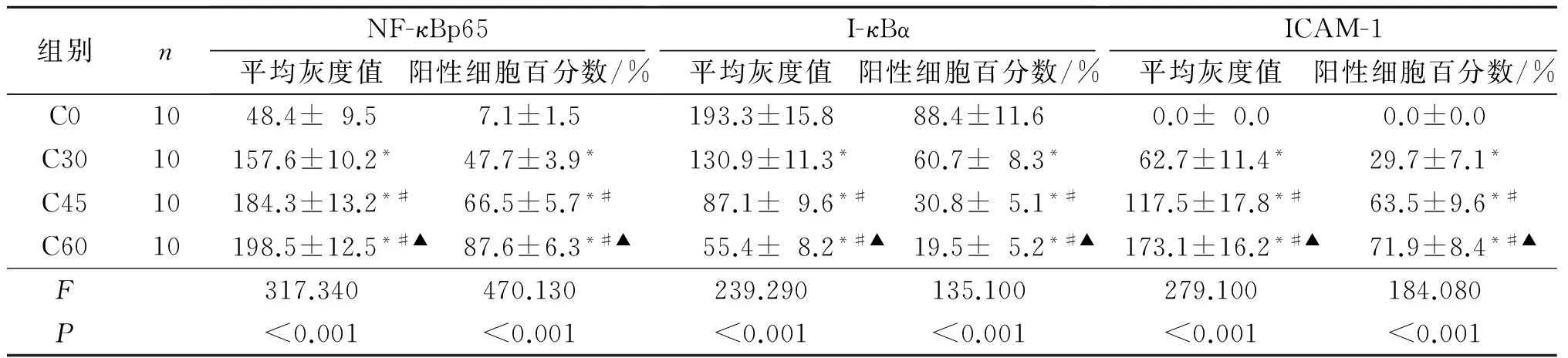
表3 4组脊髓组织中NF-κBp65、I-κBα和ICAM-1表达的比较
*:与C0组比较,P<0.01;#:与C30组比较,P<0.01;▲:与C45组比较,P<0.01。

表4 4组脊髓组织中iNOS、ROS、MPO活力及MDA含量的比较
*:与C0组比较,P<0.01;#:与C30组比较,P<0.01;▲:与C45组比较,P<0.01。
3 讨论
脊髓神经功能的维持依赖于微循环结构的完整,SCIRI期间脊髓微循环障碍将严重影响术后神经功能的恢复[3-6]。该实验中,麻醉药物戊巴比妥钠对SCMBF无明显影响[9],而阻断腹主动脉血流1 min后脊髓微循环血流速度和SCMBF较缺血前明显降低,阻断腹主动脉5min时微循环灌注波形完全消失,提示阻断水平以下脊髓血液循环完全被阻断,说明血流速度和SCMBF可灵敏反映脊髓微循环状态。为不影响术中完整的脊髓微循环监测,监测过程中未采集脊髓组织进行病理学观察及生化指标检测。
该研究中在灌注120 min后,C30组表现为运动神经元轻度肿胀及周围间隙增加等轻度SCIRI病理学改变,C45组表现为运动神经元明显肿胀及核固缩等中度SCIRI病理学改变,C60组表现为运动神经元广泛性溶解及坏死等重度SCIRI病理学改变,说明腹主动脉血流阻断30、45及60 min后再灌注可分别引起轻、中和重度SCIRI。轻度SCIRI(C30组)再灌注60 min后脊髓微循环能够恢复至缺血前水平,提示轻度SCIRI中微循环障碍具有可逆性,微循环功能可以自行恢复,术后脊髓神经功能可能恢复较好;中、重度SCIRI(C45和C60组)再灌注15和30 min后脊髓微循环表现为病理性高灌流状态,再灌注60 min后脊髓微循环表现为延迟性低灌流状态,且中、重度SCIRI中脊髓微循环功能变化存在明显差异,中度SCIRI(C45组)再灌注60 min后血流速度和SCMBF均显著高于重度SCIRI(C60组),提示中度SCIRI中微循环功能仅仅部分恢复,而重度SCIRI中微循环功能与结构的完整性受到不可逆破坏。
中枢神经系统中普遍存在着NF-κBp65/I-κBα炎症信号转导系统,静息状态下NF-κBp65与I-κBα以同源或异源二聚体非活性形式锚定于细胞质内,只有I-κBα磷酸化后NF-κBp65/I-κBα二聚体解离,NF-κBp65才具备活性[10-11]。该研究发现,轻、中和重度SCIRI再灌注120 min后脊髓组织中I-κBα蛋白表达逐渐降低,而NF-κBp65和ICAM-1蛋白表达逐渐升高,提示SCIRI时脊髓组织中NF-κBp65/I-κBα炎症信号转导系统启动,调控ICAM-1表达上调,引发炎症反应。ROS和iNOS可通过直接诱导I-κBα蛋白水解磷酸化启动NF-κBp65/I-κBα炎症信号转导系统[12-13]。MDA、ROS及MPO是中性粒细胞活化过程中脂质过氧化反应中的炎症因子[14-16]。iNOS可通过NO自由基与超氧自由基反应生成超氧亚硝基阴离子ONOO-而损伤细胞[17-18]。该研究结果表明,中、重度SCIRI脊髓微循环障碍时脊髓组织中NF-κBp65及ICAM-1蛋白表达升高的同时,MDA含量和MPO、iNOS、ROS活力也显著增强,提示在脊髓微循环障碍状态下MDA、iNOS、MPO及ROS等炎症介质可能通过NF-κBp65/I-κBα途径引发炎症反应,加重SCIRI。
[1]Thorfinn J,Sjöberg F,Lidman D.Perfusion of buttock skin in healthy volunteers after long and short repetitive loading evaluated by laser Doppler perfusion imager[J].Scand J Plast Reconstr Surg Hand Surg,2007,41(6):297
[2]Huang L,Lin X,Tang Y,et al.Quantitative assessment of spinal cord perfusion by using contrast-enhanced ultrasound in a porcine model with acute spinal cord contusion[J].Spinal Cord,2013,51(3):196
[3]Kubota K,Saiwai H,Kumamaru H,et al.Neurological recovery is impaired by concurrent but not by asymptomatic pre-existing spinal cord compression after traumatic spinal cord injury[J].Spine(Phila Pa 1976),2012,37(17):1448
[4]Jan YK,Liao F,Jones MA,et al.Effect of durations of wheelchair tilt-in-space and recline on skin perfusion over the ischial tuberosity in people with spinal cord injury[J].Arch Phys Med Rehabil,2013,94(4):667
[5]Phillips JP,Cibert-Goton V,Langford RM,et al.Perfusion assessment in rat spinal cord tissue using photoplethysmography and laser Doppler flux measurements[J].J Biomed Opt,2013,18(3):037005
[6]Liang CL,Lu K,Liliang PC,et al.Ischemic preconditioning ameliorates spinal cord ischemia-reperfusion injury by triggering autoregulation[J].J Vasc Surg,2012,55(4):1116
[7]Simon F,Scheuerle A,Calzia E,et al.Erythropoietin during porcine aortic balloon occlusion-induced ischemia/reperfusion injury[J].Crit Care Med,2008,36(7):2143
[8]Blaser A,Lang J,Henke D,et al.Influence of durotomy on laser-Doppler measurement of spinal cord blood flow in chondrodystrophic dogs with thoracolumbar disk extrusion[J].Vet Surg,2012,41(2):221
[9]成令忠,钟翠平,蔡文琴.现代组织学[M].上海:上海科学技术文献出版社,2003:38
[10]Zhou C,Shi X,Huang H,et al.Montelukast attenuates neuropathic pain through inhibiting p38 mitogen-activated protein kinase and nuclear factor-kappa B in a rat model of chronic constriction injury[J].Anesth Analg,2014,118(5):1090
[11]Xu YQ,Jin SJ,Liu N,et al.Aloperine attenuated neuropathic pain induced by chronic constriction injury via anti-oxidation activity and suppression of the nuclear factor kappa B pathway[J].Biochem Biophys Res Commun,2014,451(4):568
[12]Liou CJ,Len WB,Wu SJ,et al.Casticin inhibits COX-2 and iNOS expression via suppression of NF-κB and MAPK signaling in lipopolysaccharide-stimulated mouse macrophages[J].J Ethnopharmacol,2014,158(Pt A):310
[13]Koriyama Y,Nakayama Y,Matsugo S,et al.Anti-inflammatory effects of lipoic acid through inhibition of GSK-3β in lipopolysaccharide-induced BV-2 microglial cells[J].Neurosci Res,2013,77(1/2):87
[14]Tavukçu HH,Sener TE,Tinay I,et al.Melatonin and tadalafil treatment improves erectile dysfunction after spinal cord injury in rats[J].Clin Exp Pharmacol Physiol,2014,41(4):309
[15]Wang Y,Su R,Lv G,et al.Supplement zinc as an effective treatment for spinal cord ischemia/reperfusion injury in rats[J].Brain Res,2014,1545:45
[16]Senturk S,Gurcay AG,Bozkurt I,et al.Effects of tadalafil-Type-V phosphodiesterase enzyme inhibitor-On rats with spinal trauma[J].Br J Neurosurg,2014,7(3):1
[17]Chou AK,Yang MC,Tsai HP,et al.Adenoviral-mediated glial cell line-derived neurotrophic factor gene transfer has a protective effect on sciatic nerve following constriction-induced spinal cord injury[J].PLoS One,2014,9(3):e92264
[18]Zirak MR,Rahimian R,Ghazi-Khansari M,et al.Tropisetron attenuates cisplatin-induced nephrotoxicity in mice[J].Eur J Pharmacol,2014,738(38):222
(2014-11-25 收稿 责任编辑王 曼)
Effects of spinal cord ischemia-reperfusion injury on rabbit spinal cord microcirculatory
FANGHua1),ZHANGJianping1),ZHANGFangxiang1),ZHANGJingchao1),WANGQuanyun2),WANGRurong2),LIUJin2)
1)DepartmentofAnesthesiology,theAffiliatedPeople’sHospital,GuiyangMedicalCollege,Guiyang550002 2)DepartmentofAnesthesiology,WestChinaHospital,SichuanUniversity,Chengdu610041
spinal cord;ischemia-reperfusion;microcirculatory;NF-κB;rabbit
Aim: To investigate the effects of spinal cord ischemia-reperfusion injury(SCIRI) on spinal cord microcirculatory.Methods: The kidney ventral aorta block model was established and the rabbit abdominal aorta were blocked for 0(C0 group), 30(C30 group), 45(C45 group) and 60(C60 group) min, respectively.During ischemia and reperfusion, velocity and microcirculation blood flow(SCMBF) were monitored. After 120 min reperfusion, the pathological observation of spinal cord tissue was performed, and malondialdehyde(MDA) content, the activity of inducible nitric oxide synthase(iNOS), myeloperoxidase(MPO), reactive oxygen species(ROS), nuclear factors-kappa Bp65 (NF-κBp65), inhibitor-kappa Bα(I-κBα) and intercellular adhesion molecule-1(ICAM-1) protein expression were detected. Results: The C30, C45, C60 group performanced mild, medium and heavy SCIRI pathological manifestations. During the period of ischemia and reperfusion, the differences in changes of the velocity and SCMBF among the four groups were statistically significant (Fgroup=12.051 and 54.514,Ftime=66.084 and 171.028,Finteraction=12.032 and 35.752,P<0.05); SCMBF of C45, C60 groups still had not returned to preoperative levels after 120 min reperfusion(P<0.05). After 120 min reperfusion, MDA content and the activity of iNOS, MPO and ROS in C0, C30, C45, and C60 groups increased in turn(P<0.05), the NF-κBp65 and ICAM-1 expression increased in turn(P<0.05), and I-κBα expression reduced(P<0.05). Conclusion: Spinal cord microcirculation monitoring can sensitively and accurately reflect the degree of SCIRI. The upregulation of the expressions of ICAM-1 and NF-κBp65 might aggravate the spinal cord SCIRI during microcirculatory dysfunction.
10.13705/j.issn.1671-6825.2015.03.007
*贵州省卫生厅基金项目 gzwkj2010-1-006,gzwkj2012-1-015;贵州省科技厅基金项目 黔科合SY字[2011]008号,黔科SY字[2012]3090号
R615
