杜氏盐藻环盒子1相互作用蛋白的酵母双杂交法筛选*
2015-04-18张楠楠张彦婷李庆华朱相展薛乐勋关方霞1
许 尧,张楠楠,张彦婷,李庆华,杨 露,朱相展,薛乐勋#,关方霞1,#
1)郑州大学生命科学学院 郑州 450001 2)郑州大学第一附属医院 郑州 450052
杜氏盐藻环盒子1相互作用蛋白的酵母双杂交法筛选*
许 尧1),张楠楠2),张彦婷1),李庆华1),杨 露1),朱相展1),薛乐勋1)#,关方霞1,2)#
1)郑州大学生命科学学院 郑州 450001 2)郑州大学第一附属医院 郑州 450052
#通信作者:薛乐勋,男,1944年2月生,教授,研究方向:肿瘤标志物与基因工程,E-mail:xuelx@zzu.edu.cn;关方霞,女,1969年2月生,博士,教授,研究方向:生物医学前沿技术与应用,E-mail:guanfangxia@126.com
酵母双杂交;杜氏盐藻;诱饵载体;自激活;环盒子1
目的:构建杜氏盐藻环盒子1(RBX1)的酵母双杂交诱饵载体pGBKT7-RBX1,筛选与RBX1相互作用的蛋白。方法:采用PCR技术扩增杜氏盐藻RBX1的开放阅读框,测序分析后插入酵母表达质粒,构建诱饵载体pGBKT7-RBX1。将酶切鉴定正确的诱饵载体用PEG/LiAc法分别转化到酵母菌Y187和AH109中,通过表型筛选检测RBX1对酵母菌有无自激活和毒性作用。转化诱饵质粒的Y187与文库菌AH109杂交,待三叶草形状的合子形成后用营养缺陷型培养基和α-半乳糖苷酶活性实验筛选阳性克隆并测序。结果:成功构建了pGBKT7-RBX1,它对Y187和AH109两种酵母菌既无自激活又无毒性作用。杂交后筛选得到两个阳性克隆,阳性克隆1与莱茵衣藻和拟南芥中氧化还原酶铁硫蛋白亚基的同源性为38%和39%,阳性克隆2与莱茵衣藻中转化抑制剂蛋白的同源性为57%。结论:诱饵载体pGBKT7-RBX1可用于酵母双杂交。成功筛选得到两个阳性克隆,可能是与RBX1相互作用的蛋白。
泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)是细胞内蛋白选择性降解的重要途径,其功能失调可促进肿瘤的发生、发展和转移[1]。肿瘤发生时,泛素介导的蛋白质降解途径在细胞周期紊乱、DNA损伤和细胞凋亡中起关键作用[2]。环盒子1(ring-box 1,RBX1)是SCF-E3泛素-蛋白连接酶复合体中的指环亚基,通过靶向降解不同的底物蛋白而发挥调节多种细胞生物学过程的作用[3-4]。RBX1存在于动植物的细胞质和细胞核中,进化上比较保守。人的RBX1包含一个环指-H2 的结构域,对锌离子结合和泛素连接是必需的[5-6]。作为泛素连接酶 E3 的重要组成部分,RBX1在肿瘤发生时表达异常而无法产生调节作用,不能诱导肿瘤细胞衰老和凋亡,在肿瘤发生发展过程中起重要作用,但具体分子机制尚不清楚。肿瘤发生与纤毛异常密切相关。然而,在人类细胞中进行纤毛的研究比较困难,而杜氏盐藻以其无细胞壁、有一对等长的鞭毛、生长周期短、培养条件简单等独特的优势成为鞭毛研究的模式生物[7]。作者所在的实验室前期研究发现RBX1可能参与了鞭毛的再生过程,为揭示RBX1的生物学功能及肿瘤的发生机制提供了新的视野。该实验以杜氏盐藻为模式生物,利用酵母双杂交技术[8],通过构建杜氏盐藻RBX1酵母双杂交诱饵载体pGBKT7-RBX1,分别转化酵母菌株Y187和AH109并检测其对酵母菌株有无自激活和毒性作用,转化诱饵质粒的Y187与文库菌AH109杂交,待三叶草形状的合子形成后用α-半乳糖苷酶活性实验和营养缺陷型培养基筛选阳性克隆并测序,寻找RBX1相互作用蛋白,并为研究其在杜氏盐藻鞭毛再生中的功能做基础性工作。
1 材料与方法
1.1 藻体、菌株和主要试剂 大肠杆菌DH5α系郑州大学医学实验中心细胞生物学研究室保存;杜氏盐藻藻株UTEX LB-1644购于美国得克萨斯州大学;杜氏盐藻cDNA酵母文库由作者所在的实验室构建并保存;诱饵载体pGBKT7、酵母菌株Y187和AH109购于Clontech公司;pMD19-T simple、pUCm-T购于Sangon公司;诱饵载体pGEM-T Easy购于Promega公司;Trizol试剂购于美国Invitrogen公司;YPDA液体和固体培养基以及DO Supplement系列酵母培养基均购于上海Genomics公司;X-gal、X-α-gal、DMSO均购自Sigma公司;PCR特异性引物由Sangon公司合成;EcoRⅠ、PstⅠ、T4 DNA连接酶、DNA Marker、AMV cDNA 第一链合成试剂盒均购于大连TaKaRa公司;质粒提取试剂盒、DNA凝胶回收试剂盒购自Axygen公司;紫外分光光度仪购于美国Thermo公司;PCR仪购于Biometra公司;凝胶成像仪购于Synopticsltd公司;DYY-8C型电泳仪购于北京六一实验仪器厂。
1.2 杜氏盐藻RBX1开放阅读框的扩增 根据pGBKT7载体上的多克隆位点和杜氏盐藻RBX1 cDNA序列,设计上下游分别含有EcoRⅠ与PstⅠ位点的特异性引物。RBX1-ORF-F-S1:5’-GGAAT TCATGAGTGCTGCTGCTGAGG-3’(EcoRⅠ);RBX1-ORF-R-S2:5’-AACTGCAGCTAGTCCAGCCCAACAGC C-3’(PstⅠ)。杜氏盐藻总RNA的提取方法根据Trizol试剂说明书进行,10 g/L的琼脂糖凝胶电泳后检测RNA的完整性和纯度,然后根据AMV cDNA 第一链合成试剂盒说明书将RNA逆转录成cDNA,以cDNA为模版,PCR扩增RBX1开放阅读框。PCR反应体系:上、下游引物(100 μmol/L)各1 μL,dNTP(10 nmol/L) 8 μL,LA Taq酶0.5 μL,模版cDNA 1 μL,10×LA PCR Buffer 10 μL,加ddH2O补至100 μL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环;72 ℃延伸10 min,4 ℃终止反应。产物经琼脂糖凝胶电泳检测。
1.3 pMD19-T-RBX1的获得与鉴定 PCR产物胶回收后的目的片段与克隆载体pMD19-T simple于4 ℃连接12 h,获得载体pMD19-T-RBX1。将连接产物转化到DH5α感受态细胞中,将菌液均匀涂布于LB固体培养基(含有氨苄青霉素、IPTG和X-gal)上进行蓝白斑筛选,37 ℃恒温培养箱中过夜培养。挑取白色饱满的单克隆于LB液体培养基中,37 ℃振荡培养7~9 h后提取质粒,用EcoRⅠ与PstⅠ进行酶切鉴定,酶切鉴定正确后回收目的片段,同时将菌液送至测序公司测序。
1.4 酵母双杂交诱饵载体pGBKT7-RBX1的构建
将鉴定正确的pMD19-T-RBX1与诱饵载体pGBKT7用EcoRⅠ和PstⅠ分别过夜双酶切,回收RBX1片段和pGBKT7片段,用T4 DNA连接酶连接(4 ℃连接12 h)并转化至DH5α感受态细胞中,涂布于LB固体培养基(含有卡那霉素)上,37 ℃过夜培养后挑取白色饱满的阳性克隆,提取质粒pGBKT7-RBX1,经双酶切鉴定正确后送至测序公司测序。
1.5 诱饵载体pGBKT7-RBX1的转化
1.5.1 酵母感受态细胞的制备 采用醋酸锂法分别制备酵母Y187和AH109的感受态细胞,划线于YPDA固体培养基至长出2 mm克隆后,挑取单克隆接种于3 mL YPDA液体培养基中,30 ℃、230~250 r/min恒温摇床振荡培养16~20 h至光密度值(OD)600 nm达到0.15~0.30,然后接种于50 mL YPDA液体培养基中,30 ℃、250 r/min恒温摇床振荡培养至OD600 nm达到0.40~0.50(约4 h)。室温、2 500 r/min将菌液离心5 min,弃上清,加30 mL去离子水轻轻重悬沉淀,再次离心弃上清,用3 mL 1.1×TE/LiAc溶液重悬沉淀。将酵母细胞分装于1.5 mL的EP管中,11 000 r/min离心20 s,弃上清,加600 μL 1.1×TE/LiAc溶液重悬细胞,所得细胞悬浮液即为酵母感受态细胞。
1.5.2 诱饵载体转化酵母菌及阳性克隆的鉴定 在1.5 mL的EP管中加入50 μL酵母感受态细胞、500 μL PEG/LiAc溶液、0.5 μL pGBKT7-RBX1和5 μL鲑鱼精DNA(10 g/L),涡旋混匀。将EP管置于30 ℃水浴锅中孵育30 min。向EP管中加入20 μL DMSO,混匀,42 ℃水浴15 min(每5 min涡旋1次),然后迅速放冰上2 min。将混合液13 000 r/min离心15 s,弃上清,用1 mL YPDA液体培养基重悬沉淀,30 ℃温浴90 min,13 000 r/min离心15 s,弃上清,用生理盐水溶液重悬。将菌液均匀涂布于相应的SD/-Trp固体培养基上,30 ℃恒温倒置培养2~4 d,直至长出单菌落。挑取直径大于2 mm的单克隆进行菌落PCR,检测诱饵载体是否成功转入酵母菌中。
1.6 毒性鉴定 将含有pGBKT7-RBX1的Y187和AH109分别划线于SD/-Trp固体培养基上,30 ℃恒温倒置培养至长出白色单克隆,挑取单克隆分别接种于5 mL SD/-Trp液体培养基中,30 ℃、250 r/min恒温振荡培养16 h后测OD600 nm,若酵母OD600 nm低于0.8,说明诱饵蛋白对酵母菌株的生长有毒性作用,不适用于酵母双杂交系统。
1.7 自激活检测 将含有pGBKT7-RBX1和空载体pGBKT7的Y187和AH109分别划线于营养缺陷型(SD/-Trp、SD/-Trp/X-α-gal、SD/-Trp/-Ade/X-α-gal、SD/-Trp/-His/X-α-gal)固体培养基上,30 ℃恒温倒置培养2~4 d后观察酵母细胞的生长情况。若酵母菌能够在SD/-Trp/-His/X-α-gal固体培养基上生长,则需要在酵母双杂交过程中加入His抑制剂3-AT。若菌株能够在SD/-Trp/-Ade/X-α-gal固体培养基上生长,则诱饵蛋白具有自激活作用,不适用于酵母双杂交系统。
1.8 酵母双杂交 取1 mL文库菌(AH109)在冰上融化后与转化pGBKT7-RBX1的Y187共同转接于5 mL 2×YPDA/Kanr液体培养基中,30℃、30~50 r/min温和旋转孵育,22 h后取少量菌液进行镜检,观察是否有三叶草形状的合子形成。杂交后的菌液涂布在SD/-Trp/-Leu/-His/-Ade固体培养基上,30 ℃倒置培养6~8 d至克隆出现。挑取直径大于2 mm的单克隆划线于SD/-Trp/-Leu/-His/-Ade/X-α-gal固体培养基上,转接5代后,仍正常生长且为蓝色克隆则认为是筛选得到的阳性克隆。挑取阳性克隆作为模板进行菌落PCR,扩增得到的片段胶回收后与pUCm-T载体连接,转化DH5α,酶切鉴定,并将菌液送上海生工生物工程股份有限公司测序和进行同源性分析。
2 结果
2.1 杜氏盐藻RBX1的扩增及鉴定 用引物S1和S2、以盐藻cDNA为模板进行PCR扩增,产物大小约为400 bp(图1),测序证实为420 bp,与预期大小一致。胶回收后将目的片段连接到pMD19-T simple载体,pMD19-T-RBX1质粒经EcoRⅠ与PstⅠ双酶切,琼脂糖凝胶电泳检测结果(图2)显示,一条带约为3 000 bp(为线性pMD19-T simple载体),另一条带约为420 bp(为插入的RBX1片段);测序结果证实插入的RBX1没有发生突变。
2.2 诱饵载体pGBKT7-RBX1的鉴定 pGBKT7-RBX1双酶切后琼脂糖凝胶电泳(图3)显示为两条带,一条约为7 300 bp(为线性pGBKT7载体),另一条约为420 bp(为插入的RBX1 cDNA片段)。对pGBKT7-RBX1进行测序,结果显示RBX1片段已插入到pGBKT7载体的多克隆位点中,且序列正确,无有义突变,酵母双杂交诱饵载体构建成功。
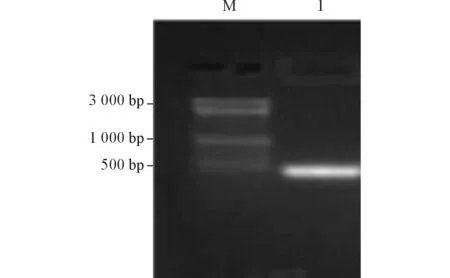
图1 RBX1开放阅读框的PCR结果

图2 pMD19-T-RBX1质粒双酶切
M:Marker;1:pMD19-T-RBX1;2:pMD19-T-RBX1经EcoRⅠ和PstⅠ双酶切。

图3 pGBKT7-RBX1酶切鉴定结果
M:Marker;1:pGBKT7-RBX1;2:pGBKT7-RBX1经EcoRⅠ和PstⅠ双酶切。
2.3 pGBKT7-RBX1的转化 用引物S1和S2对转化后的酵母细胞进行菌落PCR,电泳结果(图4)显示产物大小约为400 bp,经测序证实产物大小为420 bp,与预期大小一致,说明诱饵载体pGBKT7-RBX1已经成功转入到酵母细胞中。
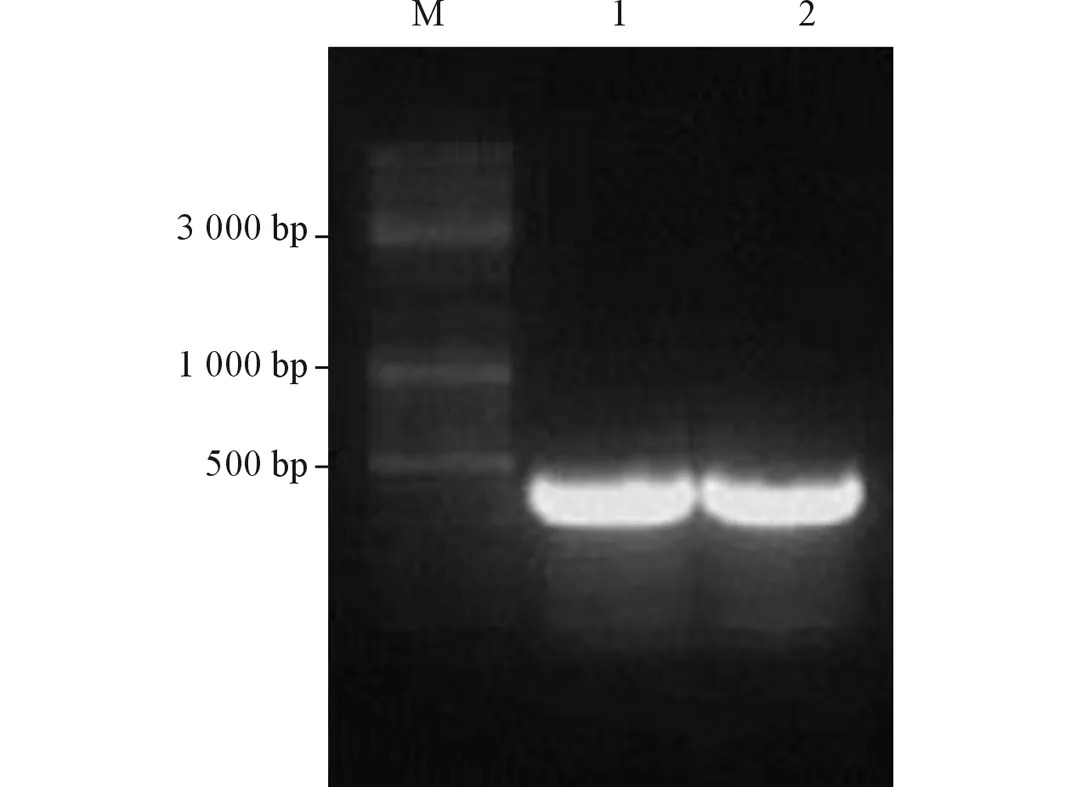
图4 pGBKT7-RBX1转化酵母菌菌落PCR结果
M:Marker;1:pGBKT7-RBX1转化Y187;2:pGBKT7-RBX1转化AH109。
2.4 毒性鉴定及自激活检测结果
2.4.1 诱饵蛋白的毒性检测 将转化pGBKT7-RBX1的Y187和AH109分别接种于SD/-Trp液体培养基16 h后,测得OD600 nm分别为1.156和1.149,说明诱饵蛋白RBX1对酵母菌均无毒性作用。
2.4.2 自激活检测 将转化诱饵载体和空载体的Y187和AH109分别划线于各种营养缺陷型固体培养基上,培养结果(图5)显示:在SD/-Trp、SD/-Trp/X-α-gal培养基上可以长出白色单菌落;在SD/-Trp/-His/X-α-gal以及SD/-Trp/-Ade/X-α-gal培养基上酵母菌不能生长。说明所构建的诱饵载体pGBKT7-RBX1对酵母菌无自激活作用,可用于酵母双杂交系统。

图5 自激活实验
2.5 酵母双杂交结果
2.5.1 双杂交配子形成检测 诱饵菌Y187与文库菌AH109杂交,振荡培养22 h后,取少量菌液进行镜检,能够观察到大量的三叶草形状的合子出现,说明酵母双杂交成功,可以进行下一步的筛选。
2.5.2 酵母双杂交阳性克隆的鉴定 杂交菌液在SD/-Trp/-Leu/-His/-Ade/X-α-gal固体培养基上转接5代后,仍有两个菌落为蓝色,即为筛选得到的阳性克隆(图6)。对阳性克隆进行菌落PCR,分别得到约900和600 bp大小的片段(图7),两者分别命名为阳性克隆1和阳性克隆2。经测序鉴定和同源性比对分析,阳性克隆1与莱茵衣藻和拟南芥中氧化还原酶铁硫蛋白亚基同源性分别为38%和39%,阳性克隆2与莱茵衣藻中转化抑制剂蛋白同源性为57%。
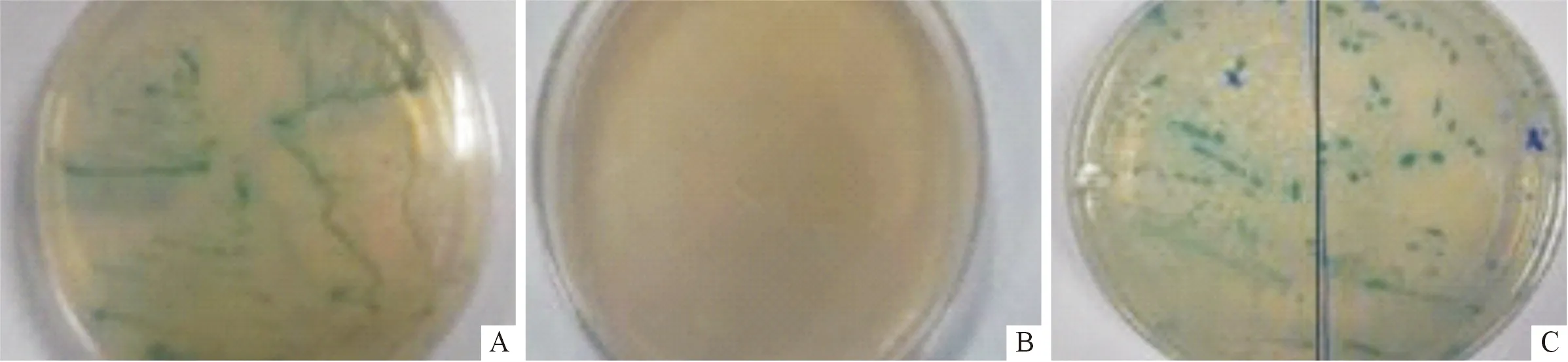
图6 酵母双杂交阳性克隆的筛选

图7 阳性克隆菌落PCR扩增结果
3 讨论
酵母双杂交系统是将目的蛋白的cDNA序列克隆至含转录激活因子(例如GAL4)DNA结合结构域基因的酵母表达载体中,获得融合诱饵表达载体,将待测cDNA文库克隆至含转录激活结构域的表达载体中,二者共转化酵母菌,通过对报告基因的表达分析,筛选目的蛋白的互作蛋白[9]。酵母双杂交技术在应用过程中存在的主要问题是假阳性较多,即当两个蛋白之间没有发生相互作用时,报告基因也被激活。造成假阳性的原因主要是诱饵蛋白本身可以激活下游报告基因的转录,所以必须通过自激活验证诱饵蛋白是否可用于酵母双杂交实验[10]。此外,在实验过程中必须严格设置对照,运用营养缺陷型培养基筛选并连续传代以增强筛选能力,从而尽量排除假阳性结果。
该研究成功构建了含有RBX1基因开放阅读框的酵母诱饵载体pGBKT7-RBX1,并将诱饵载体分别转入到酵母菌Y187和AH109中,毒性检测结果显示转化诱饵载体的AH109和Y187培养后OD600 nm均大于0.8,说明RBX1对两种酵母菌均无毒性作用。另外,为排除假阳性结果,该研究检测了诱饵载体pGBKT7-RBX1的自激活作用,结果表明RBX1对AH109与Y187均无自激活作用,可以用于酵母双杂交实验。转化诱饵载体的Y187与文库菌AH109杂交,待三叶草形状的合子形成后用营养缺陷型培养基和α-半乳糖苷酶活性实验筛选阳性克隆并测序,成功筛选到两个阳性克隆,经测序鉴定和同源性分析,阳性克隆1与莱茵衣藻和拟南芥中氧化还原酶铁硫蛋白亚基同源性分别为38%和39%,阳性克隆2与莱茵衣藻中转化抑制剂蛋白同源性为57%。
作者初步获得了可能与RBX1相互作用的两个蛋白,后续研究需要通过体外和体内实验免疫共沉淀进一步验证。
[1]Ciechanover A.The ubiquitin-proteasome pathway: on protein death and cell life[J].EMBO J,1998,17(24):7151
[2]Hershko A,Ciechanover A,Varshavsky A.Basic medical research award:The ubiquitin system[J].Nat Med,2000,6(10):1073
[3]Inoue Y,Imamura T.Regulation of TGF-beta family signaling by E3 ubiquitin ligases[J].Cancer Sci,2008,99(11):2107
[4]Petroski MD,Deshaies RJ.Function and regulation of cullin-RING ubiquitin ligases[J].Nat Rev Mol Cell Biol,2005,6(1):9
[5]Jia L,Sun Y.SCF E3 ubiquitin ligases as anticancer targets[J].Curr Cancer Drug Targets,2011,11(3):347
[6]Tan M,Davis SW,Saunders TL,et al.RBX1/ROC1 disruption results in early embryonic lethality due to proliferation failure, partially rescued by simultaneous loss of p27[J].Proc Natl Acad Sci U S A,2009,106(15):6203
[7]Singla V,Reiter JF.The primary cilium as the cell's antenna: signaling at a sensory organelle[J].Science,2006,313(5787):629
[8]Fields S,Song O.A novel genetic system to detect protein-protein interactions[J].Nature,1989,340(6230):245
[9]阎赟梦,李庆华,李杰,等.杜氏盐藻S腺苷高半胱氨酸水解酶基因的克隆及功能分析[J].郑州大学学报:医学版,2011,46(4):517
[10]Ratushny V,Golemis E.Resolving the network of cell signaling pathways using the evolving yeast two-hybrid system[J].Biotechniques,2008,44(5):655
(2014-07-28收稿 责任编辑李沛寰)
Screening of proteins that interact with RBX1 from Dunaliella salina using yeast two-hybrid system
XUYao1),ZHANGNannan2),ZHANGYanting1),LIQinghua1),YANGLu1),ZHUXiangzhan1)XUE Lexun1)#,GUANFangxia1,2)
1)SchoolofLifeSciences,ZhengzhouUniversity,Zhengzhou450001 2)TheFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
yeast two-hybrid;Dunaliella salina;bait vector;self-activation;ring-box 1
Aim: To screen the proteins that could interact with ring-box 1(RBX1) in Dunaliella salina, a bait vector pGBKT7-RBX1 for RBX1 from Dunaliella salina was constructed. Methods: As a model organism, the ORF of RBX1 from Dunaliella salina was obtained by PCR amplification and confirmed by sequencing, and then inserted into the yeast expression plasmid pGBKT7 to construct a recombinant bait vector pGBKT7-RBX1. After being identified by double digestion, the constructed bait vector was respectively transformed into the yeast strains Y187 and AH109 using PEG/LiAc method. Subsequently, the self-activation and toxicity were respectively examined by phenotype assay.Y187 transformed with bait vector was hybridized with AH109 transformed with the Dunaliella salina cDNA expression library.After the formation of the clover shaped zygote, positive clones were screened in auxotrophic medium by the active experiment of alpha galactosidase. Then the screened clones were sequenced. Results: The constructed bait vector of pGBKT7-RBX1 was successfully transformed into yeast strains Y187 and AH109. The expression products of the recombinant bait vector had no self-activation or toxic effects on neither Y187 nor AH109 strains. Sequence analysis on screened positive colonies showed that they were respectively homologous with ferredoxin thioredoxin reductase subunit from chlamydomonas reinhardtii and arabidopsis thaliana(38% and 39%) and translational inhibitor protein from chlamydomonas reinhardtii(51%).Conclusion: The bait vector pGBKT7-RBX1 could be used for yeast two-hybrid system, and two positive colonies were obtained.
10.13705/j.issn.1671-6825.2015.03.005
*国家自然科学基金资助项目 30700014;科技部国际科技合作基金资助项目 2007DFA01240
Q782