BMP4、VEGF、sFlt1多基因逆转录病毒转染肌源性细胞对小鼠体内成骨过程的影响*
2015-04-18刘冠磊唐豪杰袁洪涛许建中李广恒
李 毅,刘冠磊,唐豪杰,张 宝,袁洪涛,许建中,李广恒
郑州大学第一附属医院骨科 郑州 450052
BMP4、VEGF、sFlt1多基因逆转录病毒转染肌源性细胞对小鼠体内成骨过程的影响*
李 毅,刘冠磊,唐豪杰,张 宝,袁洪涛,许建中#,李广恒#
郑州大学第一附属医院骨科 郑州 450052
#通信作者:李广恒,男,1973年6月生,博士,教授,研究方向:骨与软骨再生,E-mail:liguangheng@hotmail.com;许建中,男,1964年9月生,博士,教授,研究方向:关节与运动医学,E-mail:13937133786@163.com
肌源性细胞;基因治疗;骨形态发生蛋白4;血管内皮生长因子;小鼠
目的:研究以肌源性细胞为基础的BMP4、VEGF、sFlt1多基因治疗在小鼠体内对成骨过程的影响。方法:分别以2种肌源性细胞C2C12 和PM为细胞载体,用BMP4、VEGF、sFlt1逆转录病毒进行重复转染。2种肌源性细胞分别重复转染后,产生6组实验细胞,分别是C2C12-B-sFlt1、C2C12-B、C2C12-B-VEGF、PM-B-sFlt1、PM-B、PM-B-VEGF。6组细胞在体外复合明胶海绵后分别植入小鼠的股肌袋内。术后不同时间应用组织学、X线检查观察各组的成骨量以及软骨化骨的组织学演变过程。结果:C2C12-B-sFlt1和C2C12-B 2组细胞在体内可引发软骨化骨过程,2组的成骨量在特定的时间段内无明显区别,但X线检查显示2组的成骨空间方向不尽相同。C2C12-B-VEGF在体内没有诱发软骨化骨的过程,其所诱发的组织学过程类似血管瘤。PM-B-sFlt1、PM-B、PM-B-VEGF 3组细胞在体内诱发软骨化骨的过程较为类似,3组的成骨量在35 d的观察期内无明显区别。结论:骨骼肌源性细胞可作为BMP4基因治疗的基础细胞,而在增加了VEGF 和sFlt1基因的复合基因转染后,其软骨化骨的表现具有细胞种群的特异性。
骨形态发生蛋白(bone morphogenetic protein, BMP)植入骨骼肌后可诱导产生异位软骨化骨,该过程的细胞分化机制为BMP诱导骨骼肌内的肌源性细胞向成骨细胞分化,随后血管内皮细胞趋化、积聚导致新生血管形成,从而在特定的时间内形成异位骨化[1-2]。基于该基础研究而发展起来的以骨骼肌源性细胞为基础的成骨基因治疗也逐渐成为骨组织工程领域的研究重点[3]。该研究中采用多基因的逆转录病毒转染技术,观察肌源性细胞在促进骨形成基因BMP4和血管形成基因血管内皮生长因子(vascular endothelial growth factor, VEGF)以及VEGF受体拮抗剂soluble fms-like tyrosine kinase-1(sFlt-1)的共同作用下其成骨过程的变化。
1 材料与方法
1.1 细胞 C2C12 细胞购买于美国ATCC公司。PM细胞为应用多酶解技术从C57BL6J小鼠的股四头肌内分离出来的肌源性细胞[4]。2种细胞都在含有体积分数10%胎牛血清、体积分数10%马血清、100 U/mL青霉素和0.1 g/L链霉素的DMEM中培养,细胞培养的条件是体积分数5%CO2、37 ℃。细胞培养液2~3 d更换1次。细胞在约50%融合时开始传代。
1.2 实验动物 C57BL6J小鼠作为分离出原代肌源性细胞的宿主。SCID 小鼠作为各组细胞植入股肌袋内完成体内实验的小鼠。所有的动物实验都经郑州大学伦理委员会批准。
1.3 装载BMP4、VEGF、sFlt1逆转录病毒载体的构建 装载人BMP4基因质粒(pCLBMP4)、VEGF165 cDNA(pCLVEGF)、sFlt1基因的逆转录病毒载体的制备是应用经典三质粒共同转染293包装细胞,收集得到纯化的上清液[5]。根据上述方法得到的3种病毒分别表示为装载人BMP4基因的逆转录病毒载体(Retro-BMP4)、装载人VEGF165基因的逆转录病毒载体(Retro-VEGF)、装载sFlt-1基因的逆转录病毒载体(Retro-sFlt1)。
1.4 病毒细胞转染 分别在体外培养细胞至50%融合时,从细胞培养瓶中吸出培养液,PBS清洗之后加入10 mL Retro-BMP4的病毒悬液(1×109~5×109cfu/L)和10 mL的含体积分数10%胎牛血清的DMEM以及溴化己二甲铵(8 mg/L),每隔16 h更换1次病毒悬液,3次共48 h完成病毒转染。C2C12-BMP4(转染过Retro-BMP4的C2C12细胞,C2C12-B)作为C2C12细胞组中的一个亚组。在C2C12-BMP4细胞的基础上再次分别应用Retro-VEGF和Retro-sFlt1进行病毒转染。按上述办法转染小鼠原代分离培养的肌源性细胞。经过这样的病毒转染共产生6组细胞,分别为C2C12-B-sFlt1、C2C12-B、C2C12-B-VEGF、PM-B-sFlt1、PM-B、PM-B-VEGF细胞组。这6组细胞产生后,分别应用相同的培养条件培养,并应用酶联免疫吸附试剂盒进行分泌蛋白检测,以确定细胞转染的有效性。
1.5 细胞植入小鼠体内 6组细胞在体外培养达到一定数目的时候,分别经胰蛋白酶消化,取100 μL含2×105个细胞的悬液滴入预先制备的6 mm×6 mm大小的无菌明胶海绵块上,然后将吸附有病毒的明胶海绵通过切开植入的方法植入SCID 小鼠的股肌袋内,并在术后的第7、10、14、20、27、35天对植入物进行各项检查。
1.6 X线放射学和新形成软骨、骨的组织学检查及镜下定量分析 所有经细胞植入的小鼠在术后第28天于麻醉下进行X线检查。部分PM细胞组的植入小鼠在术后6个月时也进行X线检查。分别在术后第7、10、14、20、27、35天处死小鼠,采集标本进行组织学检查,每个时间点每组小鼠采集3个标本。采集后的标本经快速冰冻切片,然后行Alcian蓝/伊红染色和Von Kossa/伊红染色并进行观察。Alcian蓝/伊红染色用于软骨组织的染色,正常的软骨组织在该染色的作用下为蓝色。Von Kossa/伊红用于骨组织的染色,正常的骨组织在该染色的作用下为黑色。应用Northern Eclipse成像系统对标本进行拍照,每个标本选择5张全景的组织学染色的片子(放大10倍)进行骨和软骨组织的定量分析。
2 结果
2.1 逆转录病毒转染2种细胞的有效性 6组转染过的细胞上清液中都检测出了对应蛋白质的存在,而未转染的细胞上清液中未检测到对应蛋白质。
2.2 植入体内的3组C2C12细胞的组织学特点 3组C2C12细胞(C2C12-B、C2C12-B-VEGF、C2C12-B-sFlt1)表现出不太相同的成骨特点。C2C12-B-VEGF细胞组的表现较为特殊,该组在植入术后的任何观察时间段均未见骨组织的形成;在观察的后期,即术后第27和35天可见该组在体内形成的组织具有多个管腔,管腔内有大量的红细胞,形成的整个组织具有类似血管瘤的组织学特点(图1)。经Alcian蓝/伊红染色后,C2C12-B组呈现出较为正常的软骨化骨过程,软骨组织在植入术后的第7~10天出现,第14天消失。C2C12-B-sFlt1组则表现出软骨化骨过程的异常,该组软骨组织在植入术后的第7~10天出现,14 d后消失,但术后第27天再次出现,并在第35天也可见到软骨组织。C2C12-B-VEGF组则未表现出软骨化骨的过程(图2)。
2.3 植入体内的3组PM细胞的组织学特点 3组PM细胞(PM-B、PM-B-VEGF、PM-B-sFlt1)表现出类似的成骨特点。骨组织在第10天左右出现,随着时间的推移逐渐增多(图3)。Alcian蓝/伊红染色后,3组细胞呈现出较为类似的软骨化骨的过程,软骨组织在植入术后的第7~10天出现,第14天消失(图4)。
2.4 不同细胞组植入股肌袋内术后的X线检查 术后第28天X线检查显示,C2C12-B-sFlt1和C2C12-B植入的小鼠股肌袋中均可见新生骨的形成,而C2C12-B-VEGF组未见任何新生骨组织(图5a)。3组PM细胞术后第28天的X线检查表现类似,在小鼠的股肌袋内均可见新生的骨组织形成(图5b)。然而术后6个月的X线检查显示PM-B-sFlt1组的成骨量明显多于PM-B和PM-B-VEGF组(图5b)。
2.5 6组细胞植入小鼠体内形成的新生骨与软骨组织的定量分析 C2C12-B-sFlt1和C2C12-B组的成骨和软骨量类似,而C2C12-B-VEGF组无骨组织形成;3组PM细胞在35 d的观察期内成骨和成软骨量类似(图6)。
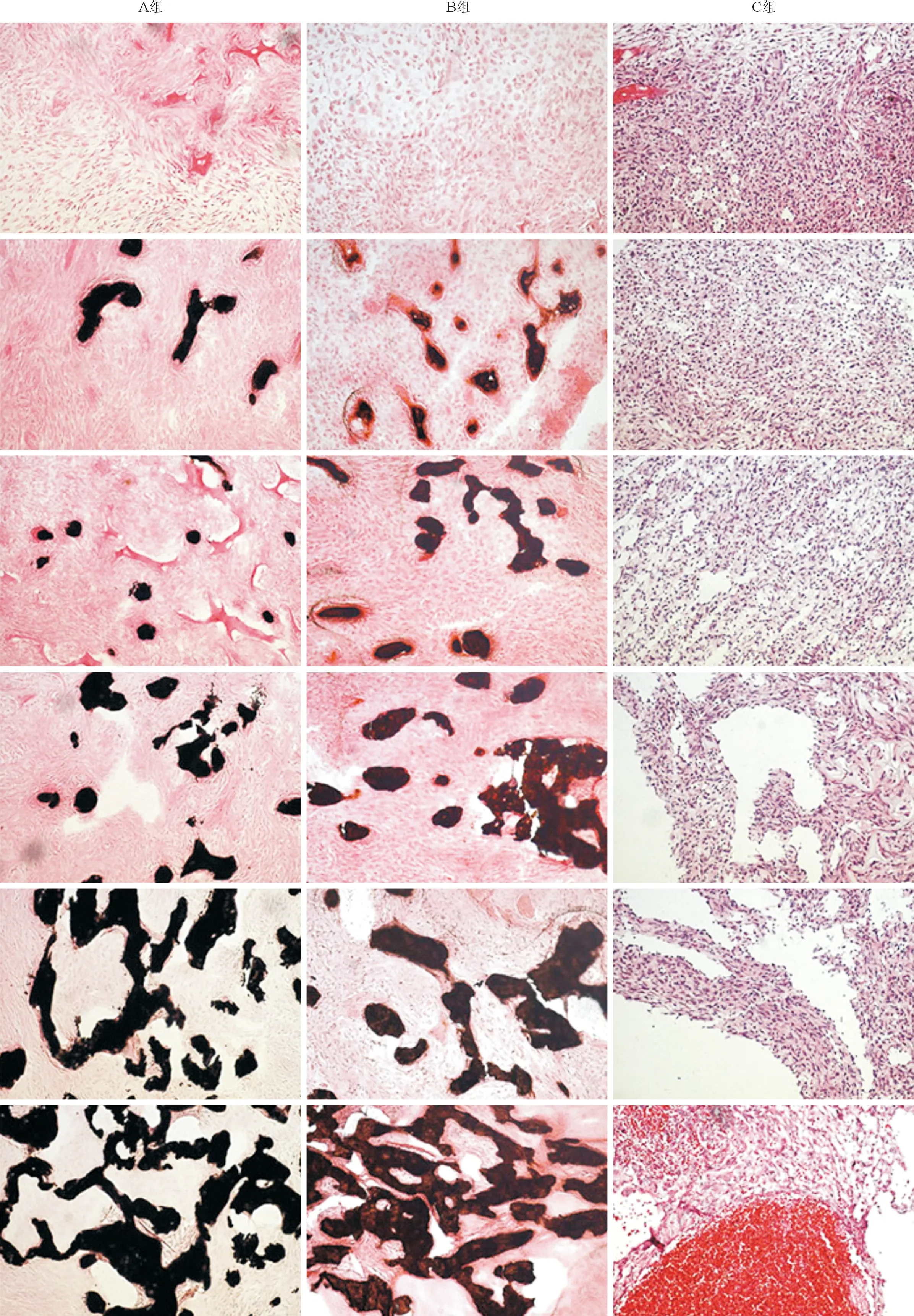
图1 3组C2C12细胞植入小鼠股肌袋内不同时间点的成骨组织学观察结果(Von Kossa/伊红染色,×400)
A组:C2C12-B-sFlt1细胞组; B组:C2C12-B细胞组;C组:C2C12-B-VEGF细胞组;从上至下分别为第7、10、14、20、27、35天。组织染色中黑色为阳性骨组织,红色为周围软组织,包括胶原、血管等。

图2 3组C2C12细胞植入小鼠股肌袋内不同时间点的成软骨组织学观察结果(Alcian蓝/伊红染色,×400)
A组:C2C12-B-sFlt1细胞组;B组:C2C12-B细胞组;C组:C2C12-B-VEGF 细胞组;从上至下分别为第7、10、14、20、27、35天。组织染色中蓝色为阳性软骨组织,红色为周围软组织,包括胶原、血管等。

图3 3组PM细胞植入小鼠股肌袋内不同时间点的成骨组织学观察结果(Von Kossa/伊红染色,×400)
A组:PM-B-sFlt1细胞组;B组:PM-B细胞组;C组:PM-B-VEGF 细胞组;从上至下分别为第7、10、14、20、27、35天。组织染色中黑色为阳性骨组织,红色为周围软组织,包括胶原、血管等。
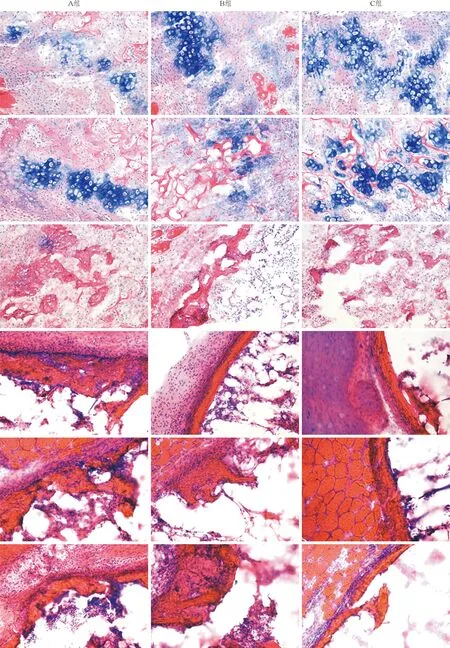
图4 3组PM细胞植入小鼠股肌袋内不同时间点的成软骨组织学观察结果(Alcian蓝/伊红染色,×400)
A组:PM-B-sFlt1细胞组;B组:PM-B细胞组;C组:PM-B-VEGF细胞组;从上至下分别为第7、10、14、20、27、35天。组织染色中蓝色为阳性软骨组织,红色为周围软组织,包括胶原、肌纤维和血管等。
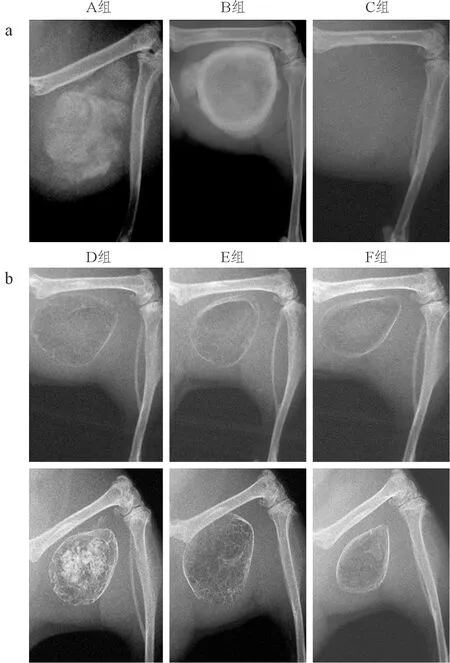
图5 6组细胞植入股肌袋内术后的X线检查结果
a:3组C2C12细胞植入小鼠股肌袋内第28天的X线检查结果。A组:C2C12-B-sFlt1细胞组;B组:C2C12-B细胞组;C组:C2C12-B-VEGF 细胞组。b:3组PM细胞植入小鼠股肌袋内第28天(上排)和6个月(下排)的X线检查结果。D组:PM-B-sFlt1细胞组;E组:PM-B细胞组;F组:PM-B-VEGF 细胞组。


图6 6组细胞植入体内后不同时间点的成骨、成软骨定量变化图
a、b:分别为C2C12-B-sFlt1(—◆—)、C2C12-B(—■—)、C2C12-B-VEGF(—▲—)组细胞植入小鼠股肌袋内后骨和软骨组织的定量变化图;c、d:分别为PM-B-sFlt1(—◆—)、PM-B(—■—)、PM-B-VEGF(—▲—)组细胞植入小鼠股肌袋内后骨和软骨组织的定量变化图。
3 讨论
关于肌源性细胞为基础的BMP4基因治疗可诱导新骨形成已经有很多报道,但在此基础上增加额外基因治疗对其成骨过程的影响还不十分清楚[6-8]。VEGF 作为软骨化骨过程中的一个重要生长因子,在软骨组织转变成骨组织的阶段起到了非常重要的作用[9-10]。在这个阶段,软骨组织中的软骨细胞随着时间的推移开始变得肥大。肥大的软骨细胞高度表达VEGF, 从而诱导新生血管的形成。而新生血管的形成又促进了新骨组织的形成和改建。为了保证实验结果的科学性、合理性,该研究同时采用了2种肌源性的细胞群。这样设计的目的是保证实验结果的代表性和实用性。
C2C12 肌源性细胞群与PM肌源性细胞群虽然都具有体外分化成肌母细胞的能力,但两者的区别也是非常明显的。C2C12细胞是从骨骼肌损伤修复的小鼠模型中分离出,在体外经过多代的培养,最后形成的一组相对比较纯的肌细胞群[11]。而PM细胞则是从小鼠骨骼肌内分离出的原代细胞群,其中主要包含成纤维细胞、成肌细胞两大细胞群[12]。这些区别可能是造成2组细胞经多基因转染而表现出不同的生物学行为的原因。
C2C12细胞经VEGF和BMP4的双重转染后丧失了体内成骨作用,而抑制VEGF作用的C2C12-B-sFlt1细胞在新骨形成的量上和C2C12-B组并没有很大区别。说明在成骨过程中对VEGF的需要量是非常小的,而且对其抑制后的成骨量也没有明显的减少。PM细胞的实验结果则和C2C12细胞略有不同,3组PM细胞的成骨过程在组织学、影像学和软骨、骨组织的定量方面未见明显的差异。该实验结果也说明,C2C12和PM虽然都是小鼠的肌源性细胞群,但经多基因转染后在体内表现出不同的生物学特性。所以,该结果也提示应用原代骨骼肌源性细胞作为BMP4基因治疗的细胞载体是可行的。
在该研究中也发现了几个非常有趣的现象。首先,如果仔细观察第28天的C2C12-B-sFlt1、PM-B-sFlt1组以及与之相对应的C2C12-B和PM-B组,可以发现转染sFlt1组的细胞在成骨的三维空间结构上与未转染sFlt1组的细胞明显不同。同样的发现也出现在组织学检查上。C2C12-B-sFlt1组在术后第28天仍可见软骨组织形成和新骨的改建,而C2C12-B组在术后第14天时软骨组织已经全部吸收了。所以,转染sFlt1组的细胞所引发的持续骨形成和改建过程很可能导致了新骨形成的空间排布不同。对这一点的进一步理解可能为将来控制干细胞基因治疗在体内成骨的形状提供线索。其次,C2C12-B-VEGF 组在植入小鼠的股肌袋内非但没有诱发成骨反应,反而是术后早期局部出现软组织肿块,后期该肿块出现了类似血管瘤的组织学表现。该现象的机制目前还不十分清楚,分析可能是植入细胞表达过多的VEGF和BMP4,两者的共同作用诱发体内的血管内皮细胞恶性增殖和分化而形成的血管瘤组织。
综上所述,骨骼肌源性细胞作为BMP4基因治疗的基础细胞,用来在体内诱导新生骨组织形成是可行的,而在增加了VEGF 和sFlt1基因的多基因治疗后,2组肌源性细胞的表现不尽相同。但是过多的VEGF会抑制新骨的形成,甚至产生不良的后果。
致谢:该课题在选题及研究过程中得到国家自然科学基金面上项目资助,实验设计及开展得到郑州大学第一附属医院重点实验室和骨科各位专家教授的指导与帮助。

[3]李广恒,金丹,郑波,等.骨骼肌来源的细胞在骨和软骨组织修复与再生中的应用[J].中华创伤骨科杂志,2013,15(3):266

[6]Peng H,Usas A,Hannallah D,et al.Noggin improves bone healing elicited by muscle stem cells expressing inducible BMP4[J].Mol Ther,2005,12(2):239

[8]迭小红,罗庆,陈聪,等.骨形态发生蛋白9、6双表达腺病毒载体的构建及其成骨诱导作用[J].南方医科大学学报,2013,33(9):1273
[9]Liu Y,Olsen BR.Distinct VEGF functions during bone development and homeostasis[J].Arch Immunol Ther Exp (Warsz),2014,62(5):363
[10]Maes C.Role and regulation of vascularization processes in endochondral bones[J].Calcif Tissue Int,2013,92(4):307
[11]Yaffe D,Saxel O.Serial passaging and differentiation of myogenic cells isolated from dystrophic mouse muscle[J].Nature,1977,270(5639):725
[12]Li G,Zheng B,Meszaros LB,et al.Identification and characterization of chondrogenic progenitor cells in the fascia of postnatal skeletal muscle[J].J Mol Cell Biol,2011,3(6):369
(2015-01-24 收稿 责任编辑姜春霞)
Investigation of endochondral bone formation induced by mouse myogenic cells based on retrovirus containing BMP4,VEGF, and sFlt1 genes therapy
LIYi,LIUGuanlei,TANGHaojie,ZHANGBao,YUANHongtao,XUJianzhong,LIGuangheng
DepartmentofOrthopaedicSurgery,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
myogenic cell;gene therapy;bone morphogenetic protein 4;vascular endothelial growth factor;mouse
Aim: To investigate the effect of VEGF and sFlt1 on the ectopic bone formation induced by myogenic cells based on Retro-BMP4 gene therapy. Methods: C2C12 and PM cells were used in this study. The cells were transduced with Retro-BMP4, combination of Retro-BMP4 and Retro-VEGF, combination of Retro-BMP4 and Retro-sFlt1, respectively. When transduced cells were ready, they were implanted into the skeletal muscle pocket of SCID mice hind leg with gelfoam. Histological and imaging examination which included X-ray were used to evaluate the process of ectopic bone formation.Results: Both C2C12-B-sFlt1 and C2C12-B cells were able to induce the ectopic endochondral bone formation in the muscle pocket. There was no difference between the two groups regarding to the amount of bone tissues. The only difference between the two groups was the three dimensional orientation of new bone tissues under the examination of X-ray. C2C12-B-VEGF group did not induce any bone formation in the muscle pocket. Histological results showed that this group produced the neoplasm which was more like hemangioma tissue. Three groups including PM-B-sFlt1,PM-B,PM-B-VEGF induced similar process of ectopic endochondral bone formation. There was no difference among three cell groups regarding to the amount of bone tissues during the 35 days observation. Conclusion: Myogenic cells isolated from skeletal muscle could be used as the cell source for BMP4 gene therapy. When the VEGF and sFlt1 genes are added in the process, the process of ectopic endochondral bone formation displays individual cell-based characteristics.
10.13705/j.issn.1671-6825.2015.03.002
*国家自然科学基金面上项目 81472136
R34
