小鼠牙胚在肾包膜及口腔黏膜环境下成牙能力的比较研究*
2015-04-17刘朋飞朴正根蔡景蕾
何 颖, 刘朋飞, 刘 晓, 朴正根△, 蔡景蕾
(1暨南大学医学院口腔医学系,广东 广州 510632; 2吉林大学药学院再生医学系,吉林 长春 130021; 3中国科学院广州生物医药与健康研究院再生生物学重点实验室,广东 广州 510530)
小鼠牙胚在肾包膜及口腔黏膜环境下成牙能力的比较研究*
何 颖1, 刘朋飞2, 刘 晓1, 朴正根1△, 蔡景蕾3△
(1暨南大学医学院口腔医学系,广东 广州 510632;2吉林大学药学院再生医学系,吉林 长春 130021;3中国科学院广州生物医药与健康研究院再生生物学重点实验室,广东 广州 510530)
目的: 通过对比分析肾包膜和口腔黏膜环境对小鼠牙胚成牙的适宜度,期望为牙齿再生技术探寻较为理想的培养环境。方法: 构建小鼠牙胚肾包膜下及口腔黏膜下移植模型,将14.5 d胚龄(ED14.5)的胚鼠下颌第1磨牙牙胚分别移入肾包膜及口腔黏膜下,于植入后3、4周取材,进行大体标本观察、组织学切片分析、硬度、弹性模量测定及拉曼光谱分析等,以观察牙胚的成牙情况。结果: (1)牙胚在肾包膜下及口腔黏膜下均可发育成牙齿状结构,但口腔黏膜组在各时点牙冠体积均小于肾包膜组,且牙齿尖窝发育状态不如肾包膜组明显。(2)组织切片染色显示:在口腔黏膜下形成的牙釉质层和牙本质层比肾包膜组薄,成釉细胞及成牙本质细胞分化不明显。(3)在釉质的硬度比较上,仅口腔黏膜4周组的釉质硬度比正常鼠牙低(P<0.05);在釉质的弹性模量比较上,肾包膜下3周后的移植物釉质弹性模量比成年鼠牙略低,但差别无统计学意义(P>0.05),肾包膜下4周和口腔黏膜下4周后的移植物釉质弹性模量均低于正常鼠牙和肾包膜3周的釉质弹性模量(P<0.01);各组间牙本质的硬度及弹性模量无显著差异(P>0.05)。(4)拉曼光谱分析结果显示:2组的拉曼光谱趋势基本一致,在961 cm-1处有最大峰值,但是在2 947 cm-1处,口腔黏膜3周组有明显的峰值,远高于其它各组。结论: (1)对于ED14.5的牙胚来说,相对口腔黏膜环境而言,肾包膜下环境培育3~4周更能发育成相对完整的牙齿。(2)口腔黏膜环境所形成牙齿的诸多性状与肾包膜环境下发育的牙齿相比虽有差异,但其对牙胚的生长发育还是具有一定的影响。
组织工程; 牙胚; 肾包膜; 口腔黏膜; 移植
近年来,基于牙齿发育和干细胞理论的牙齿再生技术逐渐受到重视[1],同时,建立一种适宜的器官培养模式也是该领域的重点问题,故探寻较为理想的牙胚培养环境对于该技术有着重要的意义。近几十年来,学者们对组织工程牙齿培养的有利环境进行了大量的研究,迄今为止,相对成熟的移植环境有肾包膜下、腹腔大网膜内、眼前房区、皮下组织等同种异体移植区。其中,肾包膜下环境被公认为较有利于移植牙胚的生长,在这一环境下,移植物能保持较好的生理学和形态学特性,并且移植物的位置相对固定不易移动,故在此部位能开展较多的重组实验;腹腔大网膜区域多用于研究牙胚及骨组织复合材料等相对较大的移植物,因腹腔内体积较大,对于较小的移植物,很可能因在动物腹腔中的位置不定而导致检测移植形成物时比较困难;而背部皮下移植环境也存在相似的问题[2]。前述这些牙齿异位移植的环境能为移植牙胚的生长提供一个良好的环境,但是在发育学上与生理学上与牙齿生长的真正环境相差较大,而且尚不知是否存在负面影响,如是否含有正常的血管和神经,是否具有正常牙齿的硬度等。另一方面,口腔环境才是其生长真正的生长环境,只有在口腔环境中萌出的牙齿才最具有临床意义。目前,口腔内移植环境研究得较多的是颌骨内移植和口腔黏膜下移植。对于小鼠颌骨内移植手术来说,由于两侧黏膜缝合较难而使得移植后创口封闭性差,易导致牙胚丢失,且牙槽窝内可能存在营养供应不足等而使得该部位移植实验也未能广泛开展。将出生后4 d小鼠的牙胚移植入口腔黏膜,能观察到牙齿的发育,但因出生后4 d小鼠的牙胚其结构接近发育完成,故不能完全评价口腔黏膜环境是否可以支持牙胚的发育[3-5]。
为进一步验证口腔黏膜环境对牙胚发育的作用,并比较牙胚在肾包膜下及口腔黏膜环境中的成牙能力,本实验拟通过将胚胎期(embronic day, ED)14.5 d的胚鼠牙胚分别移入肾包膜及口腔黏膜下(图1),并观察对比在这2种环境中牙胚发育的最终情况,从而评价口腔黏膜是否可以作为组织工程化牙胚的体内再生环境。
材 料 和 方 法
1 动物
SPF级ICR小鼠,雌雄不限,6~8周龄,体重约20 g,由中国科学院广州生物医药与健康研究院动物中心提供。
2 主要仪器设备与实验材料
常规手术器械购自上海医疗器械厂;体视显微镜及成像系统购自Zeiss;纳米压痕仪购自Hysitron;拉曼光谱仪购自JY;PBS溶液购自吉诺生物医药技术有限公司;DMEM培养基购自Gibco;胎牛血清购自PAA;EDTA及4%多聚甲醛缓冲液购自广州威佳科技有限公司;水合氯醛购自上海化学试剂采购供应五联化工厂;苏木素-伊红染液购自武汉博士德生物工程有限公司。
3 主要方法
3.1 牙胚的获取与培养 用健康ICR小鼠,体重约20 g,怀孕14.5 d后断颈处死,浸入75 %的乙醇中消毒10 min,于超净工作台内剖开其子宫取出胎鼠,放入1×PBS液中反复漂洗,取胎鼠头部,进而在体视镜下分离上、下颌,剥离下颌第一磨牙牙胚,组织块大小约1 mm×1 mm×1 mm,将其置于含10%胎牛血清的DMEM培养基,37 ℃、5 % CO2温箱中培养。
3.2 牙胚体内移植
3.2.1 牙胚肾包膜下移植 以5%水合氯醛腹腔注射麻醉ICR小鼠后,切开其腰背部皮肤,暴露右侧肾脏,用显微外科镊轻轻挑起肾囊膜,并用钝头玻璃针轻轻刺破肾囊膜形成一直径约0.2 mm的小孔,将牙胚从小孔中推进肾囊膜下,1个肾大约可移植约12~14个牙胚,移植完后缝合关闭创口,见图1。
3.2.2 牙胚口腔黏膜下移植 ICR小鼠以腹腔注射5%水合氯醛麻醉后,仰卧位固定,常规外科消毒,选取下颌两切牙左、右侧前庭沟附近颊黏膜为移植部位,用手术刀沿矢状方向切开黏膜表层约2 mm长,细弯剪向切口两边潜行分离,未见明显出血,生理盐水冲洗3次,随机选取牙胚植入后缝合,一侧颊黏膜可移植约1~2个牙胚,见图1。

Figure 1.Schematic diagram of transplantation of tooth germs in subrenal capsule and oral submucosa environments.
3.3 组织学观察 分别于术后3、4周脱颈处死小鼠后暴露移植区域,取出移植物,将移植物固定于4%的中性缓冲多聚甲醛液中,10% EDTA低温脱钙,常规梯度脱水,包埋剂包埋后制作5 μm连续冰冻切片,HE染色。
3.4 硬度及弹性模量的测定 样品于4 ℃保存在麝香草酚溶液中,实验前用蒸馏水冲洗并在空气中晾干,使用硬组织切片机切取样品,应用纳米压痕技术,对硬度和弹性模量进行测量,使用扫描电子显微镜对标本进行形貌观察,进行压痕测量时,为了明确区分和确定所测量的部位,基本都是选中层测量,实验选择恒载荷模式,连续测量最大加载力及加载后的位移,得到载荷-位移曲线,用经典的Oliver-Pharr方法[6]计算硬度及弹性模量。
3.5 拉曼光谱测定 样品于4 ℃保存在麝香草酚溶液中,实验前用蒸馏水冲洗并在空气中晾干,表面打磨光滑,选取釉质及牙本质表层进行测量,使用硅片,用50倍物镜,20 s曝光时间,100%激光功率取谱,检查峰位,并设置实验条件后,执行采谱命令,应用Labspec软件分析数据。
4 统计学处理
用SPSS 13.0统计软件进行分析,数据均采用均数±标准差(mean±SD)表示,多组间比较采用完全随机设计的单因素方差分析,组间两两比较采用Bonferroni检验方法。以P<0.05为差异有统计学意义
结 果
1 移植物的形态学观察
肾包膜组:牙胚移植后整体情况生长良好,分离取出小鼠肾脏,可见囊泡包裹的移植物,生长于肾囊膜下层,体积约为3.0 mm×1.5 mm×1.0 mm(图2A)。3周后,牙冠部呈现未被磨损的小鼠磨牙的典型形态,牙尖发育完好,牙体外感坚硬,色白且有光泽。4周后,牙胚的发育状态大体与3周的状态相同,牙冠发育完好,体积较3周略大,牙冠与牙根交界处平坦,见图3。
口腔黏膜组:在牙胚移植后的一段时间内,口腔黏膜下的伤口即可完全愈合,可见移植牙胚生长于表面黏膜层与颊肌之间(图2B),体积约为2.0 mm×1.5 mm×1.0 mm,组织相容性好,表面无明显的炎症反应。牙胚在移植3周和移植4周后所形成的牙齿结构形态基本相同。但是,牙胚的发育与同时期肾包膜下相比,牙体形态较小,牙尖发育不如肾包膜组完整,质感稍软,在牙冠与牙根交界处平坦,尚未见牙根形成,见图3。
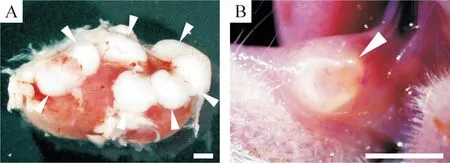
Figure 2.The structure of 3 weeks after transplantation of tooth germs in subrenal capsule (A) and oral submucosa (B) environments, as indicated by the arrows. Scale bar=1 mm.
2 移植物的组织学观察
肾包膜组:3~4周后移植物组织学HE染色可见明显的釉质空白区(脱钙后)、牙本质、牙本质小管、牙髓内组织以及分化良好的成釉细胞、成牙本质细胞等结构,其中成釉细胞呈高柱状,整齐地排列在脱钙的釉质层外侧,随着牙本质细胞体积增大,细胞外间隙逐渐变小,细胞向基底膜一侧伸出的短粗突起结构清楚,牙髓细胞密集,牙冠周围被类似骨样组织包裹,见图3。
口腔黏膜组:3~4周后移植物组织学HE染色同样可见正常组织等结构,此外,上皮根鞘延伸,离开牙冠向牙髓方向弯曲,形成一盘状结构,和肾包膜组相比,在黏膜下形成的牙釉质层和牙本质层较薄,成釉细胞及成牙本质细胞分化不明显,牙髓内细胞较少,呈现纤维组织交织成网状,见图3。
3 移植物硬度和弹性模量分析
选取硬度测试分析的实验组有正常鼠牙、肾包膜3周组和口腔黏膜4周组,口腔黏膜生长3周的牙冠质感较软,硬度明显弱于肾包膜组,4周的质感较3周略硬,所以选取此阶段样品进行对比分析。

Figure 3.Tooth structure after transplantation of tooth germs in subrenal capsule and oral submucosa, and the images of the sections with HE staining. n=9~12. Scale bar=0.5 mm. K-3wks: 3 weeks after tooth germ transplantation in subrenal capsule; M-3wks: 3 weeks after tooth germ transplantation in oral submucosa; K-4wks: 4 weeks after tooth germ transplantation in subrenal capsule; M-4wks: 4 weeks after tooth germ transplantation in oral submucosa; Am: ameloblast; dp: dental pulp; od: odontoblast; d: dentin; es: enamel.
各实验组的纳米压痕扫描电镜观察如图4所示,结果表明:经过人为的打磨抛光,牙齿界面破坏后,已未能见到典型的釉质与牙本质结构。在各实验组中,均能见到大小不一的三角形压痕,正常鼠牙中釉质与牙本质三角压痕较小且较少,肾包膜下3~4周、口腔黏膜下4周的标本三角压痕较大。

Figure 4.The images of enamel and dentin by scanning electron microscopy. Scale bar=0.1 mm.
牙釉质及牙本质硬度和弹性模量的改变如图5、6所示:在釉质的硬度比较上,仅口腔黏膜4周组的釉质硬度和正常鼠牙比较差异有统计学意义(P<0.05)。在釉质的弹性模量比较上,肾包膜下3周后的移植物釉质弹性模量比正常鼠牙略低,但差别无统计学意义(P>0.05),肾包膜下4周和口腔黏膜下4周后的移植物釉质弹性模量均低于正常鼠牙组和肾包膜3周的釉质弹性模量,差异有统计学意义(P<0.01),但是这两组之间的差异无统计学意义(P>0.05)。各组间牙本质的硬度及弹性模量无显著差异(P>0.05)。
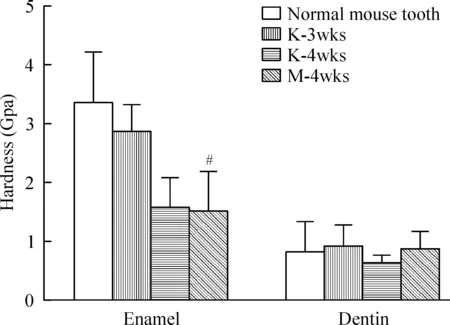
Figure 5.The results of hardness test about enamel and dentin. Mean±SD. n=3. # P<0.05 vs normal mouse tooth.

Figure 6.The results of elastic modulus test about enamel and dentin. Mean±SD.n=3. **P<0.01 vs normal mouse tooth; ##P<0.01 vs K-3wks.
4 拉曼光谱分析
选取拉曼光谱测试分析的实验组有正常鼠牙、肾包膜3周组、肾包膜4周组、口腔黏膜3周组和口腔黏膜4周组。结果显示:各组的拉曼光谱趋势基本一致,在961 cm-1处有最大峰值,但是在2 947 cm-1处,口腔黏膜3周组有明显的峰值,远高于其它各组,见图7。

Figure 7.The results of Raman spectroscopy tests. Each group of the Raman spectra went consistent. They all had the largest peak at 961 cm-1, but in 2 947 cm-1, the group of K-3wks had an obvious peak, which was far higher than other groups.
讨 论
肾包膜下环境移植后因运动少,能给移植物提供一个相对稳定的生物环境,在这一环境下,移植物能保持较好的生理学和形态学特性,而肾动脉分支形成血管球,分布于肾小球内,故血供相对丰富,可提供肾包膜内移植物生长所需要的营养,相对来说移植物发育不会延迟。口腔颊黏膜由上皮及结缔组织所构成,并由基底膜所分隔,固有层结缔组织较致密,黏膜下层较厚,脂肪较多,颊黏膜借黏膜下层附着于颊肌上,有一定张力,相对于肾包膜,口腔颊黏膜中血供没那么丰富,且口腔黏膜在受到刺激时容易引起炎症反应,血管收缩,影响颊黏膜的微循环,造成低氧的微环境[7-8],这可能是导致口腔黏膜环境与肾包膜环境差异的一个因素。
当牙冠发育完成时,牙根即开始形成。研究表明,与牙根发育相关的组织有:上皮根鞘(Hertvig’s epithelial root sheath, HERS)、牙囊(dental follicle, DF)以及牙乳头(dental papilla, DP),这3种组织对于构建完整的牙根-牙周复合体是必须的,被称作发育期根端复合体(developing apical complex, DAC)[9]。DF可为牙根的发育提供营养,最终发育成牙根部的组织结构[10],其不仅在支持牙齿萌出方面有着重要的作用,还对牙根向正确的方向生长有引导作用[11]。DP内多是由未分化的间充质细胞所构成,故其在一定程度上显示出干细胞特性,能够持续地为牙根的生长提供新生的细胞[12]。在这3种组织中,HERS对牙根的发育尤其重要,相关研究认为,颈环形成HERS是牙根发育的先决条件,HERS的形成是牙根发育启动的组织学标志,当HERS形成后,牙根的发育是独立的[13]。另外,诸多信号分子也参与到牙根发育的调控机制上来[14-16]。
肾包膜和口腔黏膜这两个环境与牙槽骨环境有一定的区别,在这两个环境中,没有牙齿萌出的过程,故在以往的研究中,大多数肾包膜环境下都不能看到成型的牙根,即便有一定的发育,也是不完善的。在本实验中,极少数肾包膜下移植3周后的牙胚有类似牙根形成,而口腔黏膜下移植后所生成的牙齿均未出现牙根形成。分析可能原因如下:(1)可能是由于牙根的发育信号还未启动;(2)某种环境下破坏了牙胚的DAC,致使其中某一部分细胞不能正常分化而影响牙根形成;(3) 牙冠在密闭的环境中无法萌出,使牙根的生长发育受限;(4) 剔除牙胚时破坏了帽状期颈环的生长环境,使各种发育信号传导受阻或不能传导;(5)某种环境下抑制了牙根表达的某种重要因子,从而使牙根不能正常萌出或萌出滞后。
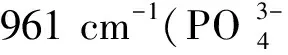
肾包膜环境可以支持牙齿的形成,但是,在形成的牙齿结构中,未检测到有神经的生成,神经除了有感知作用外,其分泌的营养因子对牙齿的生命活力也有重要的影响,所以,在牙齿发育成型后,由于缺乏相关的营养因子维系,在某些特性方面可能会有所改变,从而影响了弹性和硬度。但是,这只是本研究得到的初步结论,该结论的准确性还需要进一步的探索,用更多的实验数据和统计学原理加以验证。
综上所述,本实验从发育角度,比对了牙胚在不同环境下发育的组织学特点、物理学特性及化学组分,结果表明牙胚移植至肾包膜及口腔黏膜下均能进一步发育矿化形成牙齿样结构,尽管在口腔黏膜环境下形成牙齿的诸多性状与肾包膜环境(非口腔环境)下发育的牙齿相比有差异,但口腔黏膜环境对牙胚的生长发育还是具有一定的影响。当然,如何进一步优化和开发适合牙齿发育的口腔环境,为将来临床牙齿再生技术探寻较为理想的培养环境,也需进一步探索和研究。
[1] Cai J, Zhang Y, Liu P, et al. Generation of tooth-like structures from integration-free human urine induced pluripotent stem cells[J]. Cell Regen(Lond), 2013, 2: 6.
[2] 于金华,史俊南,金 岩. 牙齿再生的研究[J]. 牙体牙髓牙周病学杂志, 2007, 17(7):367-371.
[3] Ikeda E, Morita R, Nakao K, et al. Fully functional bioengineered tooth replacement as an organ replacement therapy[J]. Proc Natl Acad Sci U S A, 2009, 106(32): 13475-13480.
[4] Oshima M, Mizuno M, Imamura A, et al. Functional tooth regeneration using a bioengineered tooth unit as a mature organ replacement regenerative therapy[J]. PLoS One, 2011, 6(7): e21531.
[5] 李 恒, 阙国鹰, 张 磊. 近交系小鼠牙胚同种异体移植至口腔黏膜下成牙能力的研究[J]. 中南大学学报:医学版, 2010, 35(5): 524-528.
[6] Oliver WC, Pharr GM. An improved technique for determining hardness and elastic modulus using load and displacement sensing indentation experiments[J]. J Mater Res,1992, 7(6):1564-1583.
[7] 冯崇锦, 郭俊兵, 蒋宏伟,等. 缺氧诱导因子-1α在大鼠放射性口腔黏膜炎中的表达及意义[J]. 中国病理生理杂志, 2007, 23(6): 1223-1227.
[8] 平飞云, 孙 钢, 何 虹. SELDI-TOF-MS技术在口腔黏膜癌前病变和口腔鳞癌的唾液诊断模型中的应用[J]. 中国病理生理杂志, 2010, 26(1): 203-208.
[9] 金 岩,徐 琳. 发育期根端复合体是牙根牙周发育的生长调控中心[J]. 华西口腔医学杂志, 2009, 27(5):468-478.
[10]谢瑞阅,杨丕山,李 纾. 牙囊在牙根发育中作用的实验研究[J]. 华西口腔医学杂志, 2006, 24(4): 343-345.
[11]Larson EK, Cahill DR, Gorski JP, et al. The effect of removing the true dental follicle on premolar eruption in the dog[J]. Arch Oral Biol, 1994, 39(4):271-275.
[12]Tziafas D, Kodonas K. Differentiation potential of dental papilla, dental pulp, and apical papilla progenitor cells[J]. J Endod, 2010, 36(5):781-789.
[13]刘晓辉,苑 芳,金 岩,等. 牙胚颈部组织肾被膜下种植实验[J]. 临床口腔医学杂志, 2009, 25(8):456-458.
[14]Yamashiro T, Tummers M, Thesleff I. Expression of bone morphogenetic proteins andMsxgenes during root formation[J]. J Dent Res, 2003, 82(3):172-176.
[15] Yokohama-Tamaki T, Ohshima H, Fujiwara N, et al. Cessation of Fgf10 signaling, resulting in a defective den-tal epithelial stem cell compartment, leads to the transition from crown to root formation[J]. Development, 2006, 133(7):1359-1366.
[16]Aberg T, Wozney J, Thesleff I. Expression patterns of bone morphogenetic proteins (Bmps) in the developing mouse tooth suggest roles in morphogenesis and cell differentiation[J]. Dev Dyn, 1997, 210(4):383-396.
[17]Diekwisch TG, Berman BJ, Gentner S, et al. Initialenamel crystals are not spatially associated with minera-lized dentine[J]. Cell Tissue Res, 1995, 279(1):149-167.
[18]于世凤,孙宏晨,何志秀,等. 口腔组织病理学[M].第6版.北京:人民卫生出版社, 2007:22-45.
[19] 杨南如,岳文海,方永浩,等. 无机非金属材料图谱手册[M]. 武汉: 武汉工业大学出版社, 2000:371.
[20] 吴从亮,梁晓峰,赖元明,等. 水热合成铝掺杂羟基磷灰石分析[J]. 实验科学与技术, 2011,9(6):186-188.
[21] Lin-Vien D, Colthup NB, Fateley WG, et al. The handbook of infrared and Raman characteristic frequencies of organic molecules[M]. Boston: Academic Press,1991:263-276.
[22] 杨序纲, 吴琪琳. 拉曼光谱的分析与应用[M]. 北京:国防工业出社, 2008:1-29.
Comparative development of mouse tooth germs transplanted in subrenal capsule and oral submucosa
HE Ying1, LIU Peng-fei2, LIU Xiao1, PIAO Zheng-gen1, CAI Jing-lei3
(1DepartmentofStomatology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China;2DepartmentofRegenerationMedicine,SchoolofPharmaceuticalScience,JilinUniversity,Changchun130021,China;3KeyLaboratoryofRegene-rativeBiology,GuangzhouInstitutesofBiomedicineandHealth,ChineseAcademyofSciences,Guangzhou510530,China.E-mail:pzg430@126.com;cai_jinglei@gibh.ac.cn)
AIM: To compare 2 environments, the subrenal capsule and oral submucosa, for producing well-formed teeth from mouse tooth germs and for exploring the ideal environment for tooth regeneration. METHODS: Two groups were set up. Group A was transplanted with the mouse embronic day (ED) 14.5 first mandibular molar tooth germs into the subrenal capsule, while group B was transplanted with the ED14.5 first mandibular molar tooth germs into the oral submucosa. After 3 weeks and 4 weeks, the host mice were sacrificed, and the transplanted explants were evaluated with morphologic observation, histological structures, hardness and elastictic modulus tests, and chemical compositions. RESULTS: (1) The explants isolated from both environments showed the tooth-like structures, but as to the group B, the crown was smaller, and the shape of the cusps was not significant. (2) HE staining showed that the dentin and enamel in group A were thicker than those in group B in which the ameloblasts and odontoblasts were differentiated not very well. (3) In the test of enamel hardness, only the hardness of 4 weeks in group B was lower than normal mouse tooth. In the test of enamel modulus, the elastic modulus of enamel in 3 weeks of group A was slightly lower than normal mouse tooth, but the difference was not significant.The elastic modulus of enamel in 4 weeks of group A and group B was significantly lower than normal mouse tooth and 3 weeks of group B. The hardness and elastic modulus of dentin in 3 groups was not significant. (4) Raman spectroscopy showed 2 groups grew in harmony in general, they all had the largest peak in the point of 961 cm-1, but the 3 weeks of group B had an obvious peak in the point of 2 947 cm-1. CONCLUSION: For the development of ED14.5 tooth germs, we obtain almost the whole tooth in subrenal capsule transplantation after 3 or 4 weeks. The buccal submucosa environment still has a certain influence on the tooth germ development, although there are some differences about the tooth development between this environment and subrenal capsule environment.
Tissue engineering; Tooth germ; Renal capsule; Oral mucosa; Transplantation
1000- 4718(2015)01- 0141- 07
2014- 06- 20
2014- 12- 01
中国科学院广州生物医药与健康研究院再生生物学重点实验室开放课题资助项目(No. KLRB201217)
△通讯作者 朴正根 Tel: 020-85220266; E-mail: pzg430@126.com; 蔡景蕾 Tel: 020-32015236; E-mail: cai_jinglei@gibh.ac.cn
R78; Q813
A
10.3969/j.issn.1000- 4718.2015.01.027
