GCS通过MEK/ERK通路调控白血病多药耐药细胞凋亡相关基因bcl-2的表达*
2015-04-17张秀芬穆会君
王 倩, 邹 健, 张秀芬, 穆会君, 殷 莹, 谢 平
(南京医科大学附属无锡人民医院中心实验室,江苏 无锡 214023)
GCS通过MEK/ERK通路调控白血病多药耐药细胞凋亡相关基因bcl-2的表达*
王 倩, 邹 健, 张秀芬, 穆会君, 殷 莹, 谢 平△
(南京医科大学附属无锡人民医院中心实验室,江苏 无锡 214023)
目的: 探讨葡萄糖神经酰胺合成酶(GCS)是否通过MEK/ERK信号通路调控凋亡相关基因bcl-2的表达,从而诱导人白血病K562/A02细胞多药耐药。方法: 用小干扰RNA(siRNA)靶向干扰K562/A02细胞中GCS的表达,real-time PCR、Western blotting检测Bcl-2 、磷酸化及总ERK水平;用MEK特异性化学抑制剂U0126抑制MEK/ERK信号通路的活化,real-time PCR与Western blotting技术分别检测Bcl-2 mRNA与蛋白水平;CCK-8试剂盒检测细胞存活情况。结果: 与阴性对照组比较,GCSsiRNA明显抑制K562/A02细胞GCS和Bcl-2的表达,并抑制MEK/ERK信号通路的活化;U0126使Bcl-2 mRNA及蛋白水平呈浓度依赖性下降,并使K562/A02细胞ADM敏感性增加。结论: GCS通过MEK/ERK信号通路调控K562/A02细胞株中凋亡相关基因bcl-2的表达,从而诱导白血病细胞多药耐药。
葡萄糖神经酰胺合成酶; MEK/ERK信号通路; 基因,bcl-2; 抗药性, 多药
抗肿瘤效应有赖于细胞内完整的凋亡信号通路,若凋亡通路受阻,肿瘤对药物的促凋亡作用不敏感,肿瘤即表现为多药耐药(multidrug resistance, MDR)[1]。研究表明葡萄糖神经酰胺合成酶(glucosylceramide synthase, GCS)在白血病、皮肤癌、乳腺癌、恶性黑色素瘤和神经母细胞瘤等耐药细胞中表达增高[2],从而抑制细胞凋亡,调控肿瘤多药耐药[3]。胞外信号调节激酶(extracellular signal-regulated kinase, ERK)是丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)家族的重要成员。MEK/ERK信号转导通路是调节细胞生长、发育及凋亡信号网络的核心部分[4-5]。本课题组前期研究证明:特异性下调GCS可抑制凋亡相关基因bcl-2的表达[6],但其作用机制仍不十分清楚。在此基础上,本实验进一步探讨GCS是否通过MEK/ERK信号通路调控K562/A02细胞bcl-2的表达,从而抑制凋亡、诱导肿瘤细胞耐药。
材 料 和 方 法
1 主要试剂和仪器
人红白血病多药耐药细胞株K562/A02购自中国医学科学院天津血液研究所;RPMI-1640培养液、Trizol、Opti-MEM、LipofectamineTM2000试剂购自Invitrogen;胎牛血清购自杭州四季青生物工程有限公司;RNA逆转录试剂盒购自Promega;实时荧光定量PCR仪购自Roche;阿霉素(adriamycin,ADM)购自上海华联制药有限公司;CCK-8试剂盒购自Donjindo;兔抗人p-ERK、ERK单抗及MEK特异性抑制剂U0126购自Cell Signaling;兔抗人Bcl-2单抗、鼠抗人GAPDH单抗购自Santa Cruz。
2 方法
2.1 细胞培养 细胞于RPMI-1640完全培养基(含10 %灭活胎牛血清)中,37 ℃、5% CO2饱和湿度的条件下常规培养。K562/A02细胞培养基中加入1 mg/L ADM维持细胞耐药性,实验前脱药培养2周。细胞每3 d 传代1次,取对数生长期细胞进行实验。
2.2 siRNA瞬时转染 根据GenBank中人GCS核苷酸序列设计siRNA,并在Blast中对靶序列进行同源性分析排除非特异性作用于其它基因片段的可能,交由上海吉玛制药技术有限公司合成。经本室筛选,最终确定GCS siRNA 的正义链为5′-GGAUUAUCCCAAAUAUGAATT-3′,反义链为5′-UUCAUAUUUGGGAUAAUCCAA-3′;阴性对照正义链为5′-UUCUCCGAACGUGUCACGUTT-3′,反义链为5′-ACUUGACACGUUCGGAGAATT-3′。参照LipofectamineTM2000试剂说明书及相关文献报道[7]方法将对数生长期细胞以5×105每孔接种至6孔板,待细胞生长至70%时进行转染,转染前更换Opti-MEM无血清培养基。细胞分为3组:(1)siRNA干扰组(GCSsiRNA),即Opti-MEM中含有脂质体包埋的GCSsiRNA(100 nmol/L);(2)阴性对照组(negative control,NC),即Opti-MEM中含有脂质体包埋的阴性对照siRNA(100 nmol/L);(3)空白对照组(blank),即Opti-MEM中只加入转染试剂。转染48 h后检测GCSsiRNA的干扰效率。2.3 Real-time PCR检测 收集细胞,用Trizol提取细胞总RNA。Eppendorf BioPhotometer plus核酸蛋白仪测定RNA浓度。取1 μg RNA进行逆转录。1 μL cDNA模板于25 μL 反应体系中进行real-time PCR,其中GAPDH为内参照,引物和探针序列如下:GCS的上游引物为5′-TGCTCAGTACATTGCCGA AGA-3′,下游引物为5′-TGGACATTGCAAACCTCCAA-3′,Taqman探针为5′-TTATGGCCAAAGCGATAGCTGACCGAG-3′;Bcl-2的上游引物为5′-GGATCATGCTGTACTTAA-3′,下游引物为5′-TGAGGCACGTTATTATTAG-3′,Taqman探针为5′-CAGTCTACTTCCTCTGTGATGTTGT-3′;GAPDH的上游引物为5′-CCCATGTTCGTCATGGGTGT-3′,下游引物为5′-TGGTCATGAGTCCTTCCACGATA-3′,Taqman探针为5′-CTGCACCACCAACTGCTTAGCACCC-3′。扩增条件如下为95 ℃ 10 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共35个循环。独立重复实验3次,采集数据,2-ΔΔCt相对定量法计算基因抑制效率。
2.4 Western blotting检测 收集各组细胞,用含1%蛋白酶抑制剂PMSF的RIPA裂解液裂解细胞提取蛋白,BCA法检测蛋白浓度。取等量蛋白进行SDS-PAGE分离后转至PVDF膜。以5% 脱脂奶粉-TBST封闭液封闭1 h,I抗4 ℃孵育过夜,其中GAPDH为内参照蛋白,TBST洗3遍,HRP标记的II抗室温孵育1 h,TBST洗4遍,ECL检测蛋白印迹。
2.5 CCK-8法检测 按5×103每孔的密度将细胞接种于96孔板,加入不同浓度ADM孵育72 h。每孔加入10 μL CCK-8试剂,37 ℃继续孵育2 h,多功能酶标仪检测各孔450 nm波长下的吸光度(A)值。
3 统计学处理
数据以均数±标准差(mean ± SD)表示。应用SPSS 11.0软件进行统计分析,多组间比较采用单因素方差分析(one-way ANOVA),两组间比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 GCS抑制后对细胞耐药性的影响
siRNA转染细胞48 h后,real-time PCR检测细胞GCS的表达。结果显示GCS siRNA组GCS mRNA的抑制率为56.27%±10.82%,与NC组(9.51%±7.03%)比较,差异有统计学意义(P<0.01),见图1A。
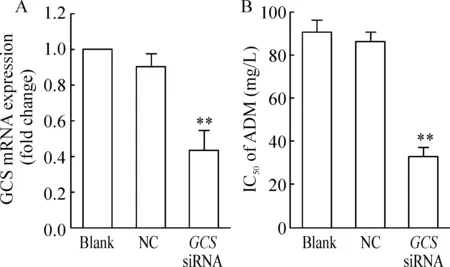
Figure 1.The effects of GCS knockdown on drug resistance of K562/A02 cells. A: GCS mRNA expression; B: IC50 values of ADM in K562/A02. Mean±SD.n=3.**P<0.01 vs NC group.
GCS表达抑制后,于培养基中加入不同浓度的ADM继续培养72 h,CCK-8检测细胞存活率,计算抗肿瘤药物的IC50。检测结果显示,GCSsiRNA组细胞的IC50与NC组比较,差异有统计学意义(P<0.01),见图1B。
2GCSsiRNA抑制MEK/ERK信号通路的活化并降低Bcl-2的表达
为明确细胞凋亡在GCS介导肿瘤多药耐药中的作用关系,本实验应用siRNA沉默GCS基因后,观察凋亡相关基因bcl-2的表达以及MEK/ERK信号通路的活化情况,结果如图2所示:GCS siRNA转染细胞48 h后,K562/A02细胞Bcl-2 mRNA与蛋白水平明显降低(P<0.01);且可显著抑制K562/A02细胞中磷酸化的表达(P<0.01),但对总的ERK作用不明显。

Figure 2.The effects of GCS knockdown on Bcl-2,p-ERK and ERK expression. A: Bcl-2 mRNA expression; B: protein expressions of Bcl-2, p-ERK and ERK. Mean±SD. n=4.**P<0.01 vs NC group.
3 U0126下调K562/A02细胞中Bcl-2的表达
为研究MEK/ERK信号通路在GCS调控Bcl-2表达中的作用,本实验通过MEK特异性抑制剂U0126抑制MEK/ERK通路的激活,观察耐药细胞Bcl-2的变化情况。5、10、20和40 μmol/L U0126作用K562/A02细胞48 h检测结果显示,当作用浓度为5 μmol/L时,p-ERK的表达无明显变化;随着药物浓度的增加,p-ERK呈剂量依赖性降低;但总ERK水平不变。随着U0126作用浓度逐渐加大,Bcl-2 mRNA与蛋白水平亦逐渐下降。同时,CCK-8法检测U0126对肿瘤耐药的影响,结果表明U0126组细胞ADM 的IC50与对照组比较明显降低(P<0.01),表明U0126可增加K562/A02细胞对抗肿瘤药物的敏感性,见图3。
讨 论
MDR使肿瘤细胞逃避抗肿瘤药物的杀伤作用,使细胞凋亡受抑并对药物选择性耐受[8-9]。在探索MDR分子机制以期促进细胞凋亡、逆转肿瘤耐药的研究中,我们发现肿瘤耐药与GCS密切相关,几乎所有耐药细胞株均过表达GCS[8-10],以白血病、皮肤癌、乳腺癌、恶性黑色素瘤和神经母细胞瘤等耐药细胞中GCS升高尤为显著[1]。外源基因导入构建GCS高表达细胞株,使MCF-7乳腺癌细胞对阿霉素和神经酰胺(ceramide,Cer)耐药指数可分别增加11和5倍;再行GCS反义转染,该耐药可被逆转[11]。本研究中转染GCSsiRNA的K562/A02细胞ADM的IC50与阴性对照组和空白组比较均显著降低,即该细胞对ADM的毒性作用更为敏感,亦证明GCS是诱导K562/A02细胞耐药的重要分子。

Figure 3.The effects of U0126 treatment on Bcl-2 expression and drug resistance of K562/A02 cells. A: Bcl-2 mRNA expression; B: protein expression of Bcl-2, p-ERK and ERK; C: IC50 values of ADM in K562/A02 after U0126 treatment. Mean±SD. n=3. *P<0.05,**P<0.01 vs 0 μmol/L group.
细胞凋亡是抗肿瘤药物杀伤肿瘤细胞的终末共同通路,受凋亡相关基因的调控。Bcl-2作为重要的凋亡调控家族,通过促、抑2类凋亡基因共同调节细胞凋亡[12]:抑凋亡分子Bcl-2阻碍环境应激引发的细胞凋亡;促凋亡分子Bax则与抑凋亡蛋白结合,解除其凋亡抑制,从而启动细胞凋亡[13]。简而言之,Bcl-2/Bax比值是决定细胞生存与否的重要因素[14]。若凋亡通路受阻,肿瘤对抗癌药物的促凋亡作用不敏感,肿瘤就表现为MDR。为研究GCS与凋亡通路的关系,本课题组前期通过GCS活性抑制剂苯基棕榈酰胺吗啡丙醇(phenyl palmitoylamino morpholino propanol,PPMP)抑制GCS活性,观察细胞Bcl-2与Bax的变化情况,结果发现PPMP可明显降低K562/A02细胞中Bcl-2的表达,对Bax的表达作用甚微[6]。鉴于PPMP并非GCS特异性抑制剂,除GCS外,PPMP还能抑制鞘糖脂代谢中其它酶的活性[15]并影响细胞钙稳态及膜的流动性[16]。故本实验采用siRNA靶向干扰GCS,结果发现Bcl-2水平亦明显降低,再次证实GCS可能通过上调Bcl-2抑制细胞凋亡从而介导K562/A02细胞耐药。
MEK/ERK信号转导通路在肿瘤发生发展中发挥重要作用。该通路的异常活化可导致细胞丧失凋亡和分化的能力、促进肿瘤的形成与恶性增殖。研究发现K562/A02较之其敏感野生细胞株K562的p-ERK水平增高[17];本研究通过siRNA干扰GCS后,p-ERK亦降低。将不同浓度U0126作用于细胞,结果发现Bcl-2 mRNA与蛋白水平均呈浓度依赖性降低。这与Yu等[17]报道的K562细胞Bcl-2的表达有赖于MEK/ERK通路的激活相一致。且U0126可明显增加K562/A02对ADM的敏感性。由此,进一步证明MEK/ERK通路参与GCS对凋亡相关基因bcl-2的调控,从而诱导白血病K562/A02细胞耐药。
MDR是多基因、多靶点、多环节综合作用的结果,本研究证明GCS可通过MEK/ERK信号通路调控Bcl-2的表达为研究白血病多药耐药以及以GCS为靶点治疗白血病提供了一定的实验依据和理论基础。但GCS抑凋亡效应是否还通过其它信号通路以及GCS诱导白血病多药耐药是否涉及其它分子机制还有待进一步研究。
[1] Ponnusamy S, Meyers-Needham M, Senkal CE, et al. Sphingolipids and cancer: ceramide and sphingosine-1-phosphate in the regulation of cell death and drug resistance[J]. Future Oncol, 2010, 6(10):1603-1624.
[2] Ryland LK, Fox TE, Liu X, et al. Dysregulation of sphingolipid metabolism in cancer[J]. Cancer Biol Ther, 2011, 11(2):138-149.
[3] Liu YY, Hill RA,Li YT. Ceramide glycosylation catalyzed by glucosylceramide synthase and cancer drug resistance[J]. Adv Cancer Res, 2013, 117:59-89.
[4] Junttila MR, Li SP,Westermarck J. Phosphatase-mediated crosstalk between MAPK signaling pathways in the regulation of cell survival[J]. FASEB J, 2008, 22(4):954-965.
[5] Andresen BT, Rizzo MA, Shome K, et al. The role of phosphatidic acid in the regulation of the Ras/MEK/Erk signaling cascade[J]. FEBS Lett, 2002, 531(1):65-68.
[6] Liu Y, Xie KM, Yang GQ, et al. GCS induces multidrug resistance by regulating apoptosis-related genes in K562/AO2 cell line[J]. Cancer Chemother Pharmacol, 2010, 66(3):433-439.
[7] 郭 欣, 胡爱玲, 方霖楷, 等. RICTOR对类风湿关节炎成纤维样滑膜细胞活力的影响[J]. 中国病理生理杂志, 2013,29(03):526-530.
[8] Liu YY, Gupta V, Patwardhan GA, et al. Glucosylceramide synthase upregulates MDR1 expression in the regulation of cancer drug resistance through cSrc and beta-catenin signaling [J]. Mol Cancer, 2010, 9:145.
[9] 王慧涵, 胡 荣, 李迎春, 等.SFRP5基因甲基通过激活Wnt/β-catenin通路调节白血病细胞MDR1/P-gp的表达[J]. 中国病理生理杂志, 2013, 29(2):278-283.
[10]Kartal Yandim M, Apohan E,Baran Y. Therapeutic potential of targeting ceramide/glucosylceramide pathway in cancer[J]. Cancer Chemother Pharmacol, 2013, 71(1):13-20.
[11]Messner MC,Cabot MC. Glucosylceramide in humans[J]. Adv Exp Med Biol, 2010, 688:156-164.
[12]李 军, 王国荣, 张秀芹, 等. 二苯乙烯苷对同型半胱氨酸诱导血管内皮细胞凋亡及bcl-2、bax、caspase-3表达的影响[J]. 中国病理生理杂志, 2013, 29(4):743-747.
[13]Harris MH,Thompson CB. The role of the Bcl-2 family in the regulation of outer mitochondrial membrane permeability[J]. Cell Death Differentiation, 2000, 7(12):1182-1191.
[14]Lalazar G, Preston S, Zigmond E, et al. Glycolipids as immune modulatory tools[J]. Mini Rev Med Chem, 2006, 6(11):1249-1253.
[15]Liour SS,Yu RK. Differential effects of three inhibitors of glycosphingolipid biosynthesis on neuronal differentiation of embryonal carcinoma stem cells[J]. Neurochem Res, 2002, 27(11):1507-1512.
[16]Kok JW, Babia T, Filipeanu CM, et al. PDMP blocks brefeldin A-induced retrograde membrane transport from golgi to ER: evidence for involvement of calcium homeostasis and dissociation from sphingolipid metabolism[J]. J Cell Biol, 1998, 142(1):25-38.
[17]Yu C, Krystal G, Varticovksi L, et al. Pharmacologic mitogen-activated protein/extracellular signal-regulated kinase kinase/mitogen-activated protein kinase inhibitors interact synergistically with STI571 to induce apoptosis in Bcr/Abl-expressing human leukemia cells[J]. Cancer Res, 2002, 62(1):188-199.
Glucosylceramide synthase upregulates apoptosis-related genebcl-2 expressionviaMEK/ERK signaling pathway in leukemia multidrug-resis-tant cell line
WANG Qian, ZOU Jian, ZHANG Xiu-fen, MU Hui-jun, YIN Ying, XIE Ping
(CentralLaboratory,TheAffiliatedWuxiPeople’sHospital,NanjingMedicalUniversity,Wuxi214023,China.E-mail:xieping1115@163.com)
AIM: To investigate whether glucosylceramide synthase (GCS) regulates apoptosis-related genebcl-2 expressionviaMEK/ERK signaling pathway, thus enhancing drug resistance of K562/A02 human leukemia multidrug resistant cell line. METHODS: siRNA targeting GCS was transfected into K562/A02 cells. Bcl-2, p-ERK and total ERK expression at mRNA and protein levels afterGCSknockdown were detected by real-time PCR and Western blotting. After exposed to MEK-ERK pathway inhibitor U0126, the expression of Bcl-2 at mRNA and protein levels also was analyzed by real-time PCR and Western blotting, respectively. The viability of the cells was evaluated by CCK-8 assay. RESULTS: The expression of GCS and Bcl-2, as well as MEK/ERK signaling were significantly inhibited in K562/A02 cells byGCSsiRNA transfection compared with negative control group. Inactivation of MEK/ERK signaling due to U0126 treatment decreased Bcl-2 mRNA and protein levels in a concentration-dependent manner, and sensitized K562/A02 cells to adriamycin. CONCLUSION: GCS may affect the expression of apoptosis-related genebcl-2 by MEK/ERK signaling pathway, thus regulating multidrug resistance of human leukemia K562/A02 cells. [KEY WORDS] Glucosylceramide synthase; MEK/ERK signaling pathway; Genes,bcl-2; Drug resistance, multiple
1000- 4718(2015)01- 0114- 05
2014- 08- 14
2014- 09- 25
无锡市科技发展指令性计划(No. CSEY1N1101)
△通讯作者 Tel: 0510-85350363; E-mail: xieping1115@163.com
R363; R733.72
A
10.3969/j.issn.1000- 4718.2015.01.022
