亚溶量C5b-9可诱导足细胞的保护性自噬应答*
2015-04-17吕倩影周建华杨凤杰蒲金赟
吕倩影, 周建华, 杨凤杰, 蒲金赟, 张 瑜
(华中科技大学同济医学院附属同济医院儿科,湖北 武汉 430030)
亚溶量C5b-9可诱导足细胞的保护性自噬应答*
吕倩影, 周建华, 杨凤杰, 蒲金赟, 张 瑜△
(华中科技大学同济医学院附属同济医院儿科,湖北 武汉 430030)
目的: 通过亚溶量补体C5b-9(sC5b-9)攻击足细胞的离体模型,探讨自噬在免疫介导足细胞损伤过程中的作用。方法: 建立sC5b-9攻击足细胞体外模型,采用单丹磺酰尸胺(MDC)染色标记自噬泡,瑞氏-吉姆萨染色光镜下观察细胞形态,免疫荧光检测nephrin的表达及分布,Western blotting检测LC3-II和LC3-I的表达,MTT法检测细胞存活率,Annexin V/PI双染法流式细胞术检测细胞凋亡。结果: 成功建立sC5b-9攻击足细胞体外模型,将细胞溶破率≤5%定义为亚溶量攻击。MDC染色和自噬标志LC3-II的检测均显示造模后48 h足细胞的自噬活动明显活跃。抑制自噬可明显加重sC5b-9所致的足细胞形态异常。sC5b-9攻击可使足细胞nephrin的表达量明显减少,并且异常分布,而抑制自噬可进一步下调nephrin的表达。抑制自噬可促进sC5b-9所诱导的足细胞凋亡。结论: sC5b-9可直接诱导足细胞自噬活动增强,而自噬则在sC5b-9介导的足细胞损伤过程中发挥着保护作用。
自噬; 足细胞; 亚溶量C5b-9
足细胞是肾小球滤过膜的重要屏障,常常遭受细菌毒素、炎症因子、免疫复合物、病理代谢产物等多种损伤性打击,其作为一种高度分化细胞,在体内分裂增殖能力有限,一旦受损很难通过再生修复。近年研究表明,足细胞损伤和缺失是慢性肾脏病进展的主要决定因素之一[1-2]。因此,对足细胞修复机制的探讨可能为延缓肾小球疾病的进展提供新的突破口。以往,我们对大鼠被动Heymann肾炎(passive Heymann nephritis, PHN)模型的研究发现,适当增强自噬可减少PHN大鼠的足细胞凋亡,减轻肾脏病变和蛋白尿程度,提示在此病变过程中自噬可能发挥保护性作用[3]。本研究通过建立亚溶量补体C5b-9(sublytic C5b-9, sC5b-9)攻击足细胞的离体模型,从细胞水平观察自噬在sC5b-9介导的足细胞损伤过程中的作用。
材 料 和 方 法
1 细胞培养、sC5b-9攻击足细胞模型的建立及实验分组
培养小鼠足细胞系MPC5(Peter Mundel 教授惠赠,北京大学第一医院丁洁教授转赠)。以含有10% FBS、1×105U/L 青霉素和100 mg/L链霉素的RPMI-1640培养基,在5% CO2培养箱内培养。33 ℃下,加入小鼠重组IFN-γ(PeproTech)维持细胞增殖传代,37 ℃下,去IFN-γ培养14 d诱导其分化。后续实验均采用分化态足细胞。
sC5b-9攻击模型的建立:参照文献[4]的方法制备兔抗MPC5细胞多克隆抗体。以正常人血清作为补体源,建立sC5b-9攻击足细胞体外模型,取分化态MPC5细胞,无血清RPMI-1640培养基润洗2次,以兔抗MPC5细胞多克隆抗体(1∶50)致敏足细胞,37 ℃孵育1 h,用无血清RPMI-1640培养基洗涤2次,加入不同稀释比例的正常人血清(normal human serum,NHS),37 ℃孵育1 h,收集培养上清,测定其中LDH含量以确定细胞溶破率,将溶破率≤5%定义为亚溶量攻击。以灭活补体的NHS作对照。
实验分空白对照(control)组、补体灭活(complement inactivation,complement-I)组、sC5b-9组和3-甲基腺嘌呤(3-methyladenosine,3-MA)组。其中,补体灭活组和sC5b-9组,是指在兔抗MPC5细胞多克隆抗体致敏足细胞后分别予灭活补体的NHS和亚溶量的NHS干预;而3-MA组,则指在制备sC5b-9攻击模型前以自噬抑制剂3-MA 5 mmol/L(Sigma)预处理1 h。
2 主要实验方法
2.1 单丹磺酰尸胺(monodansylcadaverine,MDC)染色标记自噬泡 各组足细胞弃培养液后,以无血清RPMI-1640稀释的MDC(0.05 mmol/L,Sigma)37 ℃孵育10 min,PBS洗涤3次,立即于激光共聚焦显微镜下观察、摄像。
2.2 Western blotting检测 各组足细胞经PBS洗涤,裂解液裂解,离心取上清,热变性处理,以考马斯亮蓝法测定蛋白浓度。等量蛋白样品(30 μg)以十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后转移至PVDF膜上,室温下5%脱脂奶粉封闭1 h,加Ⅰ抗4 ℃孵育过夜,PBST洗涤后,加HRP标记Ⅱ抗室温孵育1 h,PBST洗膜,电化学发光(ECL)显影,用UVP-2000凝胶图像分析系统进行定量分析。以GAPDH为内参照。Ⅰ抗包括兔抗鼠LC3(Cell Signaling)和兔抗鼠GAPDH(武汉谷歌公司)。
2.3 瑞氏-吉姆萨染色 取出各组足细胞爬片,PBS洗涤2次,95%乙醇室温固定30 min,0.05%瑞氏-吉姆萨复合染液孵育10 min,冲洗晾干,置于清洁载玻片上,光学显微镜下观察、摄像。
2.4 细胞免疫荧光染色 取各组足细胞爬片,4%多聚甲醛固定15 min,0.25% Triton X-100 PBS冰上破膜5 min,PBS洗涤,5% BSA封闭30 min,滴加Ⅰ抗:兔抗小鼠nephrin抗体,4 ℃湿盒内孵育过夜,PBS洗涤,滴加FITC标记的Ⅱ抗,于湿盒内37 ℃避光孵育60 min,PBS洗涤,50%缓冲甘油封片,激光共聚焦显微镜下观察、摄像。
2.5 MTT实验 向96孔板中的各组足细胞,每孔滴加MTT溶液(5 g/L,Sigma)20 μL,继续培养4 h,弃上清,每孔加入DMSO 150 μL,振荡10 min,用酶标仪测定吸光度(A490)值,每组设3个复孔计取平均值。重复实验3次。
2.6 细胞凋亡检测 胰酶消化收集各组足细胞,PBS重悬制备单细胞悬液,PBS洗涤2次,加500 μL binding buffer重悬细胞,加5 μL Annexin V-FITC混匀,加5 μL PI混匀,室温下避光孵育10 min,立即上流式细胞仪检测。
3 统计学处理
采用SPSS 13.0软件进行统计分析。计量资料以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 成功建立sC5b-9攻击足细胞的体外模型
如图1所示,在足量兔抗小鼠足细胞抗血清致敏的基础上,以不同稀释倍数的NHS孵育足细胞,当1∶160稀释时测得足细胞溶破率为7.2%,减去静息溶破率2.5%,得到矫正的足细胞溶破率4.7%。因此,本研究中以1∶160稀释的NHS构建sCb-9攻击足细胞的体外模型。

Figure 1.The lysis rate of antibody-sensitized podocytes incubated with different dilution of NHS. Mean±SD. n=3.
2 sC5b-9可诱导足细胞自噬
MDC染色显示,sC5b-9干预后48 h足细胞内的嗜酸性囊泡数量明显增多(图2A);同时,足细胞LC3-Ⅱ的表达明显增高,而补体灭活组和空白对照组之间无显著差异(图2B)。
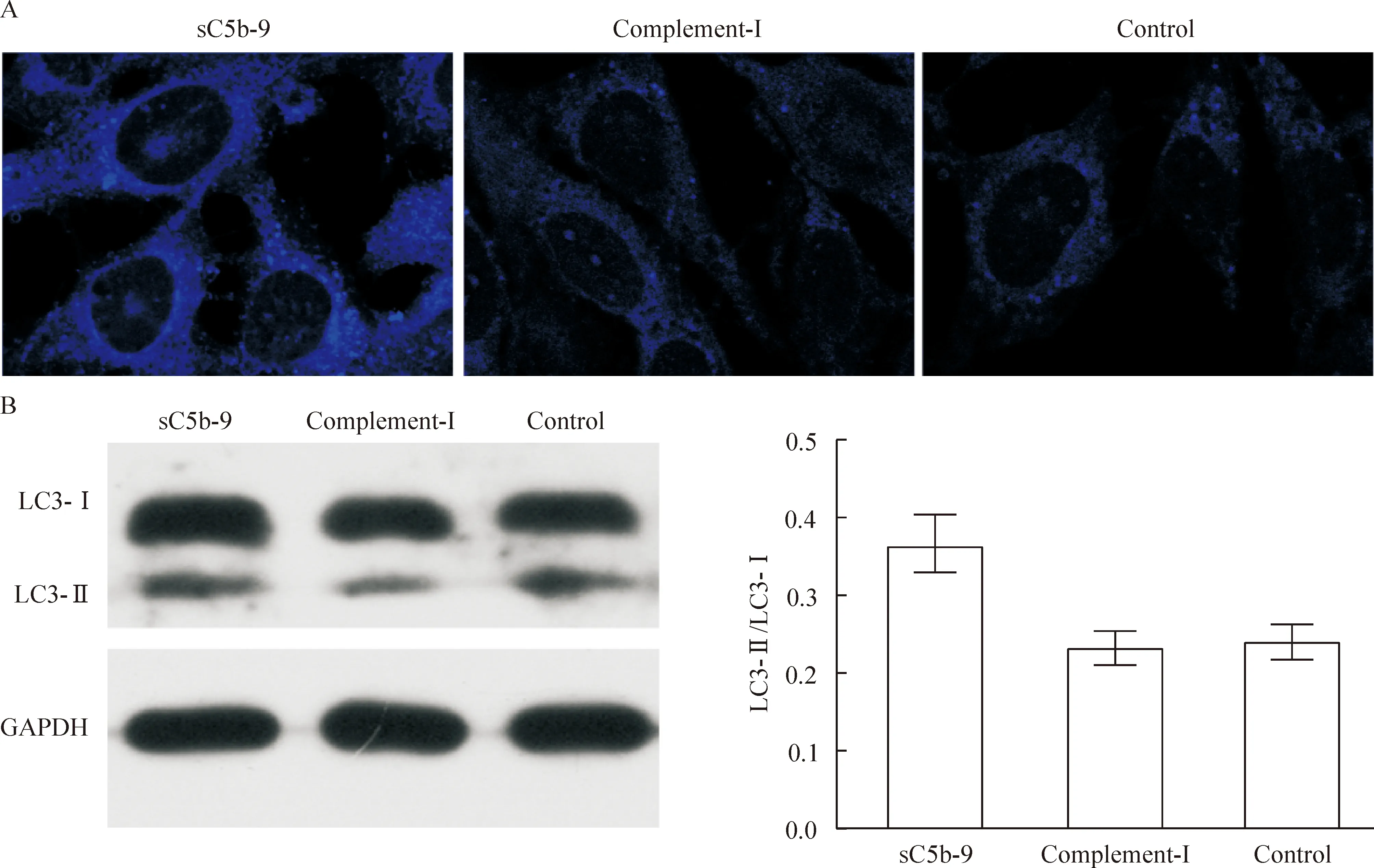
Figure 2.Evaluation of autophagy in differentiated conditionally immortalized murine podocytes. A: autophagic vacuoles detected by MDC staining (×1 000); B: examination of LC3 protein level by Western blotting. Mean±SD. n=3. *P<0.05 vs complement -I group.
3 抑制自噬明显加重sC5b-9所致的足细胞形态异常
sC5b-9干预后48 h足细胞呈现异常形态,表现为胞体回缩,细胞呈细长形,胞浆面积减少,胞膜皱褶增多,足突形成减少,失去典型的“树枝状”表型,出现板状伪足,细胞间连接减少。以3-MA预处理抑制自噬,可使上述病变显著加重,见图3。

Figure 3.Cell morphology of differentiated conditionally immortalized murine podocytes (Wright-Giemsa staining, ×400).
4 抑制自噬进一步加重足细胞裂孔膜病变
造模后48 h,与补体灭活组相比,sC5b-9组足细胞裂孔膜蛋白nephrin表达明显下调,并呈现沿核周聚集的异常分布;与sC5b-9组相比,给予3-MA预处理抑制自噬,可使足细胞nephrin的表达量进一步减少,见图4。

Figure 4.Nephrin expression in differentiated conditionally immortalized murine podocytes (immunofluorescence staining, ×400).
5 抑制自噬可促进sC5b-9所诱导的足细胞凋亡
如图5所示,sC5b-9干预后48h足细胞的生存率明显下降,同时,AnnexinⅤ/PI染色结果显示,sC5b-9组足细胞凋亡率较补体灭活组增高;与sC5b-9组相比,给予3-MA预处理抑制自噬,可使足细胞生存率进一步减低,凋亡率显著增高。

Figure 5.Survival rate and early apoptotic rate of the podoctes. A: podocyte viability was measured by MTT; B: podocyte apoptosis was measured by Annexin V/PI staining. Mean±SD. n=3. *P<0.05 vs complement-I group; △P<0.05 vs sC5b-9 group.
讨 论
膜性肾病(membranous nephropathy, MN)是一类非炎症性、器官特异性的自身免疫病,约30%的患者可出现严重的肾功能受损,而现有的免疫抑制治疗疗效十分有限,因此,需要深入探究其进展和修复机制,以寻找新的治疗靶点。虽然,在过去的十年中,随着一系列抗原成分和易感基因的发现,人们对于MN分子机制的认识有了实质性进展,但迄今为止其复杂的免疫发病机理尚未完全阐明[5]。以往研究已证实sC5b-9攻击足细胞是导致MN发生的核心环节[6]。sC5b-9攻击可激活一系列信号转导通路,如蛋白激酶、磷脂酶、活性氧自由基、转录因子、生长因子、蛋白酶、内质网应激通路等等,最终这些信号将影响细胞代谢、脂质和细胞骨架的结构及功能、裂孔膜形成等足细胞生物学行为[7]。正如本研究所示,sC5b-9可直接导致离体培养的足细胞失去典型的“树枝状”表型,而呈现胞体细长、胞膜皱缩、板状伪足等异常形态,同时伴有足突减少以及裂孔膜蛋白nephrin的表达下调和分布异常。
足细胞是一类类似于神经元的高度分化细胞,其外部形态呈多突状,由胞体、主突起和足突三部分构成:漂浮在肾小球Bowman’s的巨大胞体上,向肾小球毛细血管袢伸出长的主突起,而主突起则通过其分出的足突黏附于肾小球基底膜;相邻的足突规则有序地相嵌形成指状交叉,其间由裂孔膜桥接,后者完全覆盖足突间25~55 nm的滤过间隙,构成肾小球滤过的最后一道屏障。因此,足细胞时常面临免疫攻击、血流动力学异常、蛋白尿、药物、感染等诸多损伤因素的干扰,然而作为一种终末分化细胞,在体内其不能以有丝分裂的方式有效应对损伤,故而当损伤性刺激超过了足细胞自我防御能力时,将出现足细胞丢失,如若细胞数目减少10~20%,将导致基底膜裸露及肾小球硬化[8]。凋亡是肾小球足细胞丢失的主要途径。与以往研究[9]相符,本研究也观察到sC5b-9可直接诱导足细胞凋亡,在干预后48 h,离体培养的足细胞生存率明显下降,凋亡率明显升高。
sC5b-9在激活多条损伤信号通路导致足细胞病变的同时,往往也激活一系列防御机制以限制损伤、促进修复。作为长寿命细胞,“形成自噬体,清除多余或受损的蛋白质及细胞器”是足细胞赖以生存的至关重要的损伤应答机制[10]。自噬是广泛存在于真核细胞的一种溶酶体依赖的降解途径,主要调节细胞内废弃的长寿命蛋白及细胞器的降解,使降解产物被细胞再利用,因此,其在细胞发育、损伤修复、组织重塑及适应性应答等方面发挥着极为关键的作用。哺乳动物细胞的自噬反应可分为巨自噬、微自噬、分子伴侣介导的自噬3种,其中巨自噬即通常所指的自噬,其所介导的批量降解是一个严格调控的程序性过程。首先,在胞浆中形成一个来源于粗面内质网或高尔基体的扁平双层膜结构,而后不断扩张,称之为“前自噬泡”;前自噬泡不断延伸,将胞浆中废弃组分揽入其中,而后边缘融合,形成密闭的球形双层膜结构,称之为“自噬体”;随后,在细胞骨架蛋白驱动下自噬体与溶酶体融合,形成“自噬溶酶体”,以降解其内容物及双层膜结构[11]。多数情况下,自噬作为细胞自我修复和对抗死亡的一种保护性应答反应而存在[12-14]。本研究观察到,以3-MA抑制自噬不仅可明显加重sC5b-9所致的足细胞形态异常,使裂孔膜蛋白nephrin的表达进一步下降,而且还可促进sC5b-9所诱导的足细胞凋亡。
综上所述,我们认为,sC5b-9作为损伤因素在致足细胞病变的过程中,同时也诱导足细胞自噬活性增强,而自噬在此过程中发挥着重要的保护性作用。本研究提示增强自噬有望成为治疗免疫介导性足细胞病变的措施之一。
[1] Wanner N, Hartleben B, Herbach N, et al. Unraveling the role of podocyte turnover in glomerular aging and injury[J]. J Am Soc Nephrol, 2014, 25(4): 707-716.
[2] 杨凤杰,周建华,吕倩影,等. 雷帕霉素减缓大鼠被动Heymann肾炎的进展[J]. 中国病理生理杂志, 2014, 30(9):1661-1665.
[3] Reiser J, Sever S. Podocyte biology and pathogenesis of kidney disease[J]. Annu Rev Med, 2013, 64(10): 357-366.
[4] Meyer-Schwesinger C, Dehde S, Klug P, et al. Nephrotic syndrome and subepithelial deposits in a mouse model of immune-mediated anti-podocyte glomerulonephritis[J]. J Immunol, 2011, 187(6): 3218-3229.
[5] Debiec H, Ronco P. Immunopathogenesis of membranous nephropathy: an update[J]. Semin Immunopathol, 2014, 36(4):381-397.
[6] Nangaku M, Shankland SJ, Couser WG. Cellular response to injury in membranous nephropathy[J]. J Am Soc Nephrol, 2005, 16(5): 1195-1204.
[7] Takano T, Elimam H, Cybulsky AV. Complement-mediated cellular injury[J]. Semin Nephrol, 2013, 33(6): 586-601.
[8] Mundel P, Shankland SJ. Podocyte biology and response to injury[J]. J Am Soc Nephrol, 2002, 13(12): 3005-3015.
[9] Couser WG, Nangaku M. Cellular and molecular biology of membranous nephropathy[J]. J Nephrol, 2006, 19(6): 699-705.
[10]Asanuma K, Tanida I, Shirato I, et al. MAP-LC3, a promising autophagosomal marker, is processed during the differentiation and recovery of podocytes from PAN nephrosis[J]. FASEB J, 2003, 17(9): 1165-1167.
[11]Yang Z, Klionsky DJ. Eaten alive: a history of macroautophagy[J]. Nat Cell Biol, 2010, 12(9): 814-822.
[12]Tharaux PL, Huber TB. How many ways can a podocyte die? [J]. Semin Nephrol, 2012, 32(4):394-404.
[13]Huber TB, Edelstein CL, Hartleben B, et al. Emerging role of autophagy in kidney function, diseases and aging[J]. Autophagy, 2012, 8(7): 1009-1031.
[14]Livingston MJ, Dong Z. Autophagy in acute kidney injury[J]. Semin Nephrol, 2014, 34(4): 17-26.
Sublytic C5b-9 induces protective autophagy in cultured podocytes
LÜ Qian-ying, ZHOU Jian-hua, YANG Feng-jie, PU Jin-yun, ZHANG Yu
(DepartmentofPediatrics,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China.E-mail:yuzhang497@163.com)
AIM: In podocytes, autophagy occurs at a high basal level and dysregulated autophagy is associa-ted with a variety of podocytopathies. This paper is to investigate the role of autophagy in sublytic C5b-9-induced podocyte injury. METHODS: Sublytic complement C5b-9 stimulation was used as aninvitromodel. Autophagosomes were confirmed using monodansylcadaverine (MDC) staining. Immunoblotting was used to measure the change of autophagy-related markers. Cellular morphological changes were observed by Wright-Giemsa staining. Immunofluorescence staining and confocal microscopy were used to detect the expression and distribution of nephrin. The cell viability was assessed by methylthiazol tetrazolium (MTT) assay. The cell apoptosis was assessed by Annexin V-fluorescein isothiocyanate/PI staining. RESULTS: For ensuring sublytic complement injury, the maximal amounts of anti-podocyte antiserum and 160×-diluted normal human serum were used without inducing cell lysis (defined as >5% LDH release). Sublytic C5b-9 promoted autophagy of podocytesinvitro. The proautophagic effect of sublytic C5b-9 manifested in the form of accumulated MDC-labeled vesicles and enhanced the expression of LC3-Ⅱ. Autophagy inhibitor 3-methyladenosine (3-MA) promoted sublytic C5b-9-induced podocyte morphological abnormalities. Compared with the sublytic C5b-9-injured podocytes, 3-MA exposure further decreased the expression of nephrin. 3-MA enhanced sublytic C5b-9-induced podocyte apoptosis. CONCLUSION: Sublytic C5b-9 attack induces autophagy, which may play a protective role against complement-mediated podocyte injury.
Autophagy; Podocytes; Sublytic C5b-9
1000- 4718(2015)01- 0059- 05
2014- 06- 17
2014- 11- 05
国家自然科学基金资助项目(No. 81100514); 教育部博士点基金(新教师类)(No. 20110142120017); 华中科技大学自主创新研究基金(No. 2013QN192)
△通讯作者 Tel: 027-83663297; E-mail: yuzhang497@163.com
R363
A
10.3969/j.issn.1000- 4718.2015.01.012
