Ac-SDKP经HSP27调节锌指蛋白而抑制肺上皮细胞-间质转化*
2015-04-17邓海静李世峰张丽娟薛新新杜世璞
邓海静, 李世峰, 张丽娟, 薛新新, 杜世璞, 孙 月, 徐 洪, 杨 方
(河北联合大学医学实验研究中心, 老年医学国际科技合作基地, 河北 唐山 063000)
·论 著·
Ac-SDKP经HSP27调节锌指蛋白而抑制肺上皮细胞-间质转化*
邓海静, 李世峰, 张丽娟, 薛新新, 杜世璞, 孙 月, 徐 洪, 杨 方△
(河北联合大学医学实验研究中心, 老年医学国际科技合作基地, 河北 唐山 063000)
目的: 探讨N-乙酰基-丝氨酰-天门冬酰-赖氨酰-脯氨酸(Ac-SDKP)是否通过抑制热休克蛋白27(heat-shock protein 27,HSP 27)的表达,进而抑制锌指蛋白SNAI1、SNAI2的表达,而发挥阻抑转化生长因子(TGF)-β1诱导的人肺泡Ⅱ型上皮细胞向间质细胞(肌成纤维细胞)的转化以及Ⅰ型、Ⅲ型胶原蛋白的表达。方法: 激光共聚焦检测TGF-β1诱导的人肺泡Ⅱ型上皮细胞向肌成纤维细胞转化中HSP27及SNAI1、SNAI2蛋白的共定位表达;real-time PCR法检测HSP27、SNAI1和SNAI2 mRNA的表达;Western blotting法检测HSP27、SNAI1、SNAI2和Ⅰ型、Ⅲ型胶原蛋白的表达,以及转染HSP27干扰质粒后SNAI1、SNAI2蛋白及Ⅰ型、Ⅲ型胶原蛋白表达的变化。结果: 与对照组相比,TGF-β1刺激组HSP27、SNAI1、SNAI2及Ⅰ型、Ⅲ型胶原蛋白表达增强;给予Ac-SDKP干预后,HSP27、SNAI1、SNAI2及Ⅰ型、Ⅲ型胶原蛋白表达明显降低,差异有统计学意义。用HSP27的干扰质粒转扰细胞后,SNAI1、SNAI2及Ⅰ型、Ⅲ型胶原蛋白表达降低,其中SNAI1和Ⅰ型、Ⅲ型胶原蛋白的表达与TGF-β1刺激组比较差异有统计学意义。这与Ac-SDKP干预的结果相似。结论: Ac-SDKP能够通过对HSP27表达的调节,降低锌指蛋白SNAI1和SNAI2的表达,进而抑制肺泡Ⅱ型上皮细胞向肌成纤维细胞的转化及胶原蛋白的合成。
N-乙酰基-丝氨酰-天门冬酰-赖氨酰-脯氨酸; 肺泡Ⅱ型上皮细胞; 肌成纤维细胞; 热休克蛋白27; 锌指蛋白SNAI1; 锌指蛋白SNAI2
在矽肺纤维化时,肌成纤维细胞可由肺间质的成纤维细胞转变而来[1]。肌成纤维细胞的另一个重要来源是支气管和肺泡上皮细胞[2]。因此上皮细胞向间质细胞的转化(epithelial-mesenchymal transitiont, EMT),包括向肌成纤维细胞的转化,与(矽)肺纤维化的形成密切相关[3]。最近我们采用蛋白质组学方法在大鼠矽肺模型中筛选出了33个与矽肺发生密切相关的差异蛋白,其中热休克蛋白27(heat shock protine 27,HSP27)是比较典型的差异蛋白之一。HSP27蛋白是分子量为27 kD的小分子量热休克蛋白,隶属于小分子量的热休克蛋白家族,它们都含有1个保守的C末端结构域,即α-晶状体蛋白结构域,通过与核转录因子锌指蛋白SNAI1的相互调节参与了器官纤维化的上皮-间质转化过程[4]。锌指蛋白家族的另一个转录因子锌指蛋白SNAI2参与了肿瘤细胞的上皮-间质转化过程,使肿瘤细胞侵袭和转移能力增强[5]。
N-乙酰基-丝氨酰-天门冬氨酰-赖氨酰-脯氨酸(N-acetyl-seryl-aspartly-lysyl-proline, Ac-SDKP)是近年来发现的一种抗器官纤维化的短肽,在心、肝、肾和肺纤维化中均能够抑制致病因素引起的器官纤维化[6]。本课题组的前期研究发现Ac-SDKP具有拮抗大鼠矽肺纤维化的作用,能够通过抑制肺成纤维细胞向肌成纤维细胞的转化和胶原合成,从而发挥抗矽肺纤维化的作用[7]。然而,Ac-SDKP能否通过对HSP27表达的调节阻抑锌指蛋白SNAI1和SNAI2的表达,进而抑制肺泡Ⅱ型上皮细胞向肌成纤维细胞的转化及胶原蛋白的合成,目前国内外尚无文献报道。本实验拟采用体外人肺泡Ⅱ型上皮细胞培养结合特异性沉默HSP27基因的实验方法,观察Ac-SDKP是否通过对HSP27与锌指蛋白SNAI1、SNAI2调节途径,阻抑了TGF-β1诱导的肺泡Ⅱ型上皮细胞向肌成纤维细胞的转化,进而抑制Ⅰ型、Ⅲ型胶原蛋白的表达,以阐明Ac-SDKP抑制(矽)肺纤维化作用的可能机制。
材 料 和 方 法
1 主要试剂与材料
A549人肺泡Ⅱ型上皮细胞株(中科院上海细胞库);高糖DMEM培养基(Gibco);胎牛血清(PAA);TGF-β1(Peprotech);Ac-SDKP(Bachem);兔多克隆抗体I型、III型胶原(Gene Tex);鼠HSP27单克隆抗体(Abcam);兔多克隆SNAI1抗体(Anbobio);兔多克隆SNAI2抗体(Aviva);兔多克隆抗体GAPDH和鼠单克隆抗体β-actin(Santa Cruz);SP免疫组织化学试剂盒(北京中杉);real-time PCR试剂盒及Lepo 2000转染试剂(Invitrogen);羊抗鼠、兔免疫荧光Ⅱ抗(KPL)。
2 细胞培养及实验分组
人肺泡Ⅱ型上皮细胞株A549,用含10%胎牛血清的高糖DMEM培养基在37 ℃、5% CO2孵育箱中培养。待细胞生长达次融合状态时以0.25%胰蛋白酶消化,根据实验需要接种于不同的培养板(皿)中。分组诱导前无血清同步化24 h。实验分组为:(1)对照组(control组),无血清DMEM培养72 h;(2)TGF-β1诱导组(TGF-β1组),无血清DMEM培养条件下,给予TGF-β1(5 μg/L)诱导刺激72 h;(3)Ac-SDKP药物干预组(TGF-β1+Ac-SDKP组),无血清DMEM培养条件下给予Ac-SDKP(10-8mol/L)1 h后,再给予TGF-β1(5 μg/L)共同孵育细胞72 h。
3 方法
3.1 免疫印迹检测 按照实验设计进行诱导干预后,提取细胞蛋白,用BCA法测定蛋白浓度后,以每个泳道50 μg蛋白上样,电泳并转膜。将膜放入配好的不同浓度的抗体中(E-cad、α-SMA、HSP27、SNAI1、SNAI2、Ⅰ型胶原及Ⅲ型胶原1∶200稀释;GAPDH和β-actin 1∶100稀释),4 ℃孵育过夜,Ⅱ抗羊抗兔IgG、羊抗鼠IgG(1∶5 000)37 ℃孵育2 h,BCIP/NBT显色剂显色1 min。用ImageJ软件对蛋白条带测量光密度值,目的蛋白条带与相应内参照光密度值之比为该蛋白的相对表达量。
3.2 Real-time PCR检测 提取细胞总RNA,测定纯度及浓度,对目的基因进行引物设计合成。HSP27 sense:5’-GCTTCACGCGGAAATACACG-3’, antisense:5’-GTGATCTCGTTGGACTGCGT-3’;SNAI1 sense:5’-TAGCGAGTGGTTCTTCTGCG-3’,antisense:5’-GGGCTGCTGGAAGGTAAACT-3’;SNAI2 sense:5’-ACGCCTCCAAAAAGCCAAAC-3’, antisense:5’-ACAGTGATGGGGCTGTATGC-3’; β-actin sense:5’-GTCACCTTCACCGTTCCAGTTTT-3’,antisense:5’-CTTAGTTGCGTTACACCCTTTCTT-3’。使用M-MLV逆转录酶进行cDNA的合成,取目的RNA样本2~4 μL (20 mg/L),依次加入引物、合成缓冲液等共20 μL反应体系,37 ℃孵育50 min,70 ℃加热15 min以终止反应。Platinum SYBR Green实时荧光定量PCR试剂盒用于DNA的扩增与检测。将正反引物和对应cDNA加入蒸馏水和SYBR,混匀置于SLAN荧光定量PCR仪中,按照预先设定程序进行扩增,共40循环。用2-ΔΔCt法分析基因表达变化,与内参照比较后分析数据。
3.3 激光共聚焦扫描显微镜检测 以6×103每孔的密度制备细胞爬片,按照细胞培养实验分组进行诱导干预。取出爬片后4%多聚甲醛固定30 min,滴加0.2% Triton X-100破膜30 min,后高压修复90 s。切片擦拭干净,滴加HSP27、SNAI1和SNAI2抗体(1∶100比例)、湿盒内避光4 ℃冰箱孵育过夜。次日取出PBS冲洗Ⅰ抗30 min,后加入TRITC和FITC标记的羊抗兔和羊抗鼠免疫荧光Ⅱ抗于37 ℃湿盒避光孵育2 h。Hoechst 33258复染胞核5 min。于激光共聚焦显微镜扫描(Olympus FV1000)视野下,每张切片随机选取5个视野进行观察与拍照(×800)。
3.4HSP27 shRNA质粒的构建与筛选 以6×103每孔的密度在6孔板里孵育细胞。待细胞长满密度达90%~100%时,开始做细胞转染。用转染效率最高的转染条件即Lepo 2000∶HSP27 shRNA质粒为5 μL∶2 μg的比例进行转染48 h。用real-time PCR 检测,分析数据,筛选出干扰效果最好的HSP27 shRNA片段。
4 统计学处理
使用SPSS 17.0软件进行统计学分析。数据采用均数±标准差(mean±SD)表示,采用单因素方差分析进行组间均数比较,以P<0.05为差异有统计意义。
结 果
1 Ac-SDKP对TGF-β1诱导刺激肺泡Ⅱ型上皮细胞的HSP27、SNAI1、 SNAI2表达的调节作用
对照组细胞呈单个圆形,HSP27蛋白主要在胞浆内有少量绿色微弱荧光表达,SNAI1蛋白在胞核内有少量红色荧光表达,SNAI2蛋白亦在胞核内有少量红色荧光表达;经TGF-β1诱导刺激后,细胞呈长梭形改变,胞浆内HSP27蛋白绿色荧光强度明显加强,胞核内SNAI1蛋白表达红色荧光强度增强,而SNAI2蛋白除了在胞核内有红色荧光表达外,在胞浆内也出现了红色荧光表达;给予Ac-SDKP干预后,细胞长梭形变化不甚明显,胞浆内HSP27蛋白绿色荧光强度明显减弱,胞核内SNAI1蛋白表达红色荧光强度亦随之减弱,SNAI2蛋白胞核和胞浆的红色荧光表达亦减弱,见图1、2。

Figure 1.The colocalization of HSP27 and SNAI1 on A549 alveolar epithelial cells induced by TGF-β1 observed under confocal laser scanning microscope.
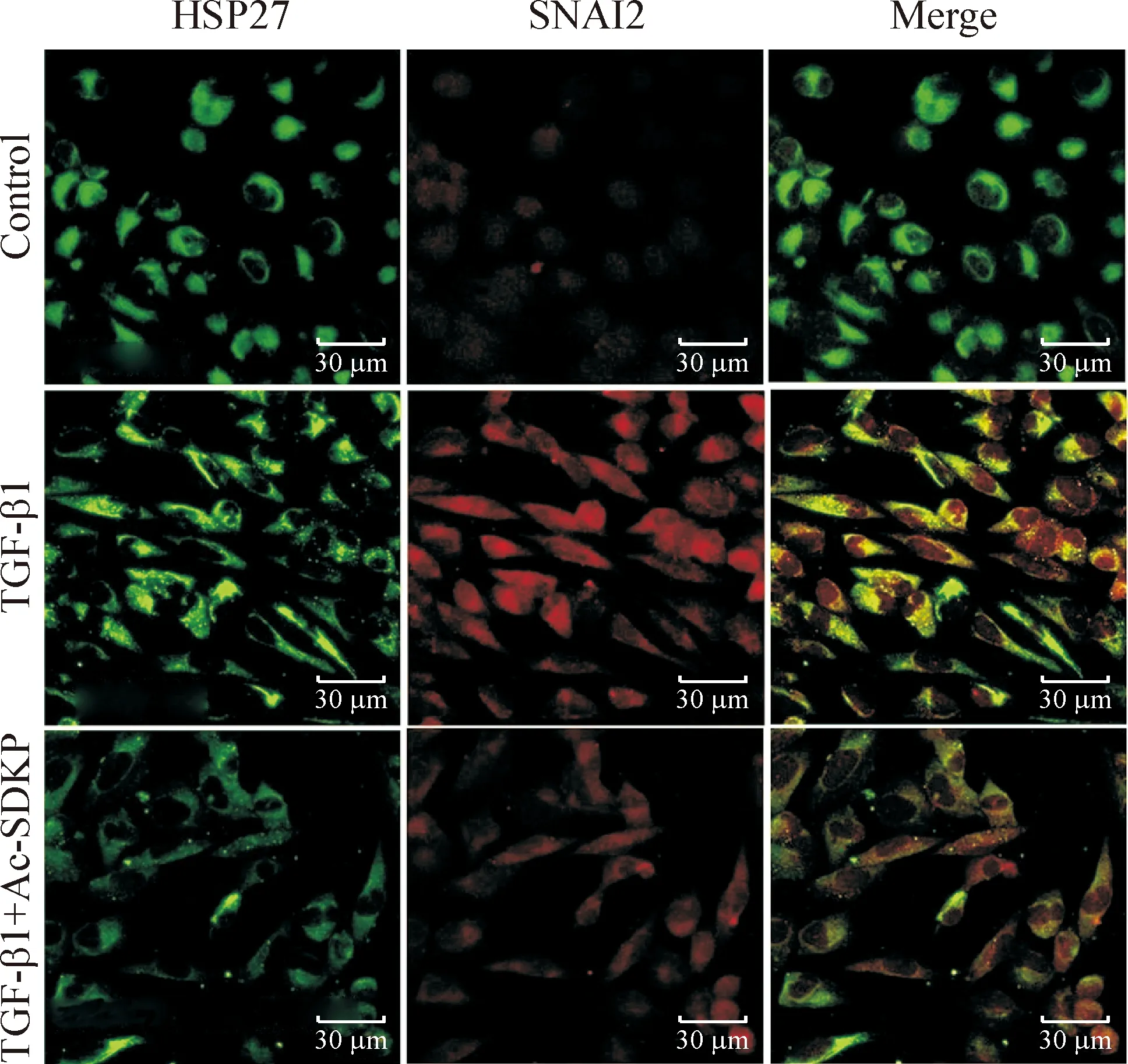
Figure 2.The colocalization of HSP27 and SNAI2 on A549 alveolar epithelial cells induced by TGF-β1 observed under confocal laser scanning microscope.
Real-time PCR结果显示,经TGF-β1诱导72 h后,HSP27、SNAI1和SNAI2 的mRNA表达上调,HSP27的 mRNA表达是对照组的1.9倍,SNAI1 的mRNA表达是对照组的3.1倍,SNAI2的mRNA表达是对照组的2.3倍。给予Ac-SDKP干预后, HSP27、SNAI1和SNAI2 的mRNA表达水平下调,HSP27的mRNA表达下调到TGF-β1组的64%,SNAI1的 mRNA表达下调到TGF-β1组的38%,SNAI2 的mRNA表达下调到TGF-β1组的79%,差异均有统计学意义(P<0.05),见表1。

表1 Real-time PCR检测Ac-SDKP 对TGF-β1诱导肺泡上皮细胞发生上皮-间质转化时HSP27、SNAI1和 SNAI2 mRNA表达的影响
*P<0.05vscontrol group;#P<0.05vsTGF-β1 group.
Western blotting的结果显示,经TGF-β1诱导刺激72 h后,HSP27、SNAI1和SNAI2的蛋白表达上调,其中HSP27的表达是对照组的1.9倍。SNAI1蛋白的表达是对照组的1.3倍;SNAI2蛋白的表达是对照组的1.9倍,差异均有统计学意义(P<0.05)。而给予Ac-SDKP干预后,再给予TGF-β1诱导72 h,HSP27、SNAI1和SNAI2蛋白表达下调。其中HSP27的表达是TGF-β1诱导组的74%;SNAI1蛋白的表达是TGF-β1诱导组的75%,SNAI2蛋白表达是TGF-β1诱导组的66%,差异均有统计学意义(P<0.05),见图3。
2 Ac-SDKP对TGF-β1诱导刺激肺泡Ⅱ型上皮细胞的Ⅰ型和Ⅲ型胶原蛋白表达的调节作用
Western blotting结果显示,经TGF-β1诱导刺激72 h后,Ⅰ型和Ⅲ型胶原蛋白的表达上调,其中Ⅰ型胶原蛋白的表达是对照组的2.2倍,Ⅲ型胶原蛋白的表达是对照组的2.5倍,差异均有统计学意义(P<0.05);而给予Ac-SDKP干预后,Ⅰ型胶原蛋白的表达是TGF-β1诱导组的66%,Ⅲ型胶原蛋白的表达是TGF-β1诱导组的44%,差异均有统计学意义(P<0.05),见图4。
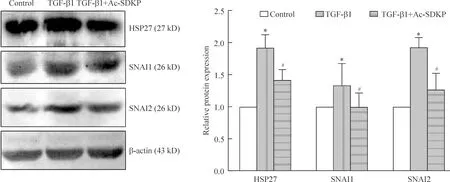
Figure 3.The effect of Ac-SDKP on the expression of HSP27, SNAI1, SNAI2 in A549 alveolar epithelial cells induced by TGF-β1.Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs TGF-β1 group
3 Ac-SDKP对体外转染HSP27细胞上皮细胞钙黏蛋白(E-cadherin,E-cad)、HSP27、SNAI1、SNAI2、α平滑肌肌动蛋白(α-smooth muscle altin,α-SMA)、Ⅰ型胶原及Ⅲ型胶原蛋白表达的变化
Western blotting的结果同时显示,与转染空质粒组对比,经TGF-β1诱导的转染空质粒组,上皮标志蛋白E-cad表达明显降低,E-cad表达是转染空质粒组的48%,HSP27、SNAI1、SNAI2、α-SMA、Ⅰ型胶原及Ⅲ型胶原蛋白表达增高,HSP27的表达是转染空质粒组的1.5倍,SNAI1的表达是转染空质粒组的1.7倍,SNAI2的表达是转染空质粒组的1.5倍,间质标志蛋白α-SMA的表达是转染空质粒组的1.5倍,Ⅰ型胶原的表达是转染空质粒组的1.7倍,Ⅲ型胶原蛋白的表达是转染空质粒组的1.7倍,差异均有统计学意义(P<0.05)。转染HSP27的干扰质粒后,给予TGF-β1诱导,与TGF-β1诱导的转染空质粒组对比,E-cad表达明显上调,是TGF-β1诱导的转染空质粒组的2.2倍,HSP27、SNAI1、α-SMA、Ⅰ型胶原及Ⅲ型胶原蛋白表达降低,HSP27的表达是TGF-β1诱导的转染空质粒组的53%,SNAI1的表达是TGF-β1诱导的转染空质粒组的63%,α-SMA的表达是TGF-β1诱导的转染空质粒组的51%,Ⅰ型胶原的表达是TGF-β1诱导的转染空质粒组的50%,Ⅲ型胶原的表达是TGF-β1诱导的转染空质粒组的60%,差异均有统计学意义(P<0.05),SNAI2蛋白表达亦降低,是TGF-β1诱导的转染空质粒组的78%,但差异无统计学意义(P>0.05)。与TGF-β1诱导的转染空质粒组对比,给予Ac-SDKP干预后,E-cad表达明显增加,是TGF-β1诱导的转染空质粒组的2.1倍,HSP27、SNAI1、SNAI2、α-SMA、Ⅰ型胶原及Ⅲ型胶原蛋白表达明显降低,HSP27的表达是TGF-β1诱导的转染空质粒组的46%,SNAI1的表达是TGF-β1诱导的转染空质粒组的57%,SNAI2的表达是TGF-β1诱导的转染空质粒组的51%,α-SMA的表达是TGF-β1诱导的转染空质粒组的47%,Ⅰ型胶原的表达是TGF-β1诱导的转染空质粒组的32%,Ⅲ型胶原的表达是TGF-β1诱导的转染空质粒组的50%,差异均有统计学意义(P<0.05),这一结果与转染HSP27的干扰质粒后的干预结果相似,见图5。
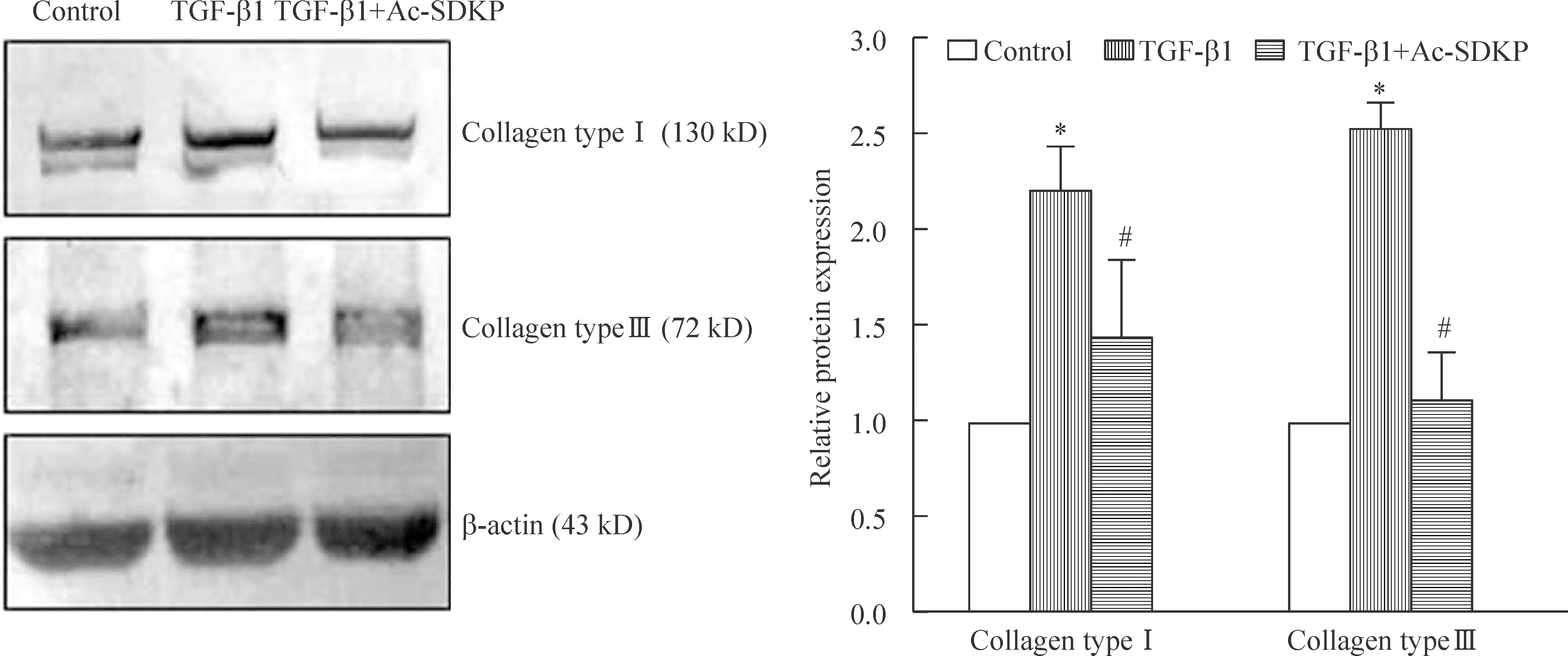
Figure 4.The effect of Ac-SDKP on the expression of collagen type Ⅰ and collagen type Ⅲ in A549 alveolar epithelial cells induced by TGF-β1.Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs TGF-β1 group.
讨 论
我们前期的实验结果显示在TGF-β1诱导刺激下,肺成纤维细胞和A549肺泡Ⅱ型上皮细胞都能够向成肌纤维细胞转化,进一步证实了TGF-β1这个重要的细胞因子能够促进肺成纤维细胞和上皮细胞向间质细胞的转化[8-9]。
HSP27是热休克蛋白家族成员中的一个小分量的蛋白,较多文献报道了HSP27调控上皮-间质转化过程依赖于HSP27与锌指蛋白SNAI1的相互作用[10]。SNAI1蛋白为细胞的核转录因子,是锌指蛋白SNAIL超家族成员,是胚胎发育中促进中胚层和神经嵴形成的非常重要的转录因子[11]。在人特发性肺纤维化疾病中,SNAI1蛋白与E-cad近端启动子上的E盒结合,而抑制E-cad的表达,从而促进细胞表型的变化。SNAI1可以被蛋白体酶降解而失去活性和其调节功能。而HSP27可以通过抑制蛋白体酶对SNAI1蛋白的降解,使SNAI1在细胞核内聚集并增加了SNAI1转录因子的活性,诱导了上皮-间质转化的过程[4]。在单侧输尿管梗阻所致的肾小管间质纤维化模型中,HSP27表达增高。肾小管上皮细胞过表达HSP27后,SNAI1蛋白表达反而降低,E-cad表达增高。HSP27通过对SNAI1的负向调节,阻抑了肾小管上皮细胞向间质的转变[12]。将人HSP27基因片段插入的质粒转染肾小管上皮细胞株(NRK52E),能明显降低由TGF-β1刺激诱导的上皮-间质转化过程中SNAI1蛋白的表达,而增加E-cad的表达。这些结果提示,HSP27通过对SNAI1的负向调节,阻抑了上皮-间质转化的过程,对肾脏纤维化的形成起到了保护作用,这与上述特发性肺纤维化过程中,HSP27与SNAI1作用后的调控结果正好相反[10]。SNAI1和SNAI2蛋白的N末端区有高度的同源性,在C末端区有4~5个锌指结构域(两者又称为锌指因子)。在食管癌、胃癌、结直肠癌、乳腺癌和肺癌中SNAI2蛋白的表达与E-cad的表达呈负相关,目前作为肿瘤预后、转化程度的一个检测指标[13]。然而,HSP27以及SNAI1和SNAI2是否通过相互的调节,参与了在肺纤维化的形成?目前尚未见相关文献报道。在我们的实验中发现,当用TGF-β1诱导刺激A549肺泡Ⅱ型上皮细胞时,HSP27在蛋白水平和mRNA水平表达均增强,并伴有SNAI1和SNAI2蛋白和mRNA表达的上调,蛋白表达水平与mRNA表达水平的变化趋势相一致。我们又应用荧光抗体标记法在激光共聚焦扫描显微镜下观察,发现HSP27和SNAI1、SNAI2蛋白在肺泡Ⅱ型上皮细胞胞浆内有共同的定位与表达。提示HSP27蛋白可能是通过与SNAI1和SNAI2蛋白的表达参与了TGF-β1诱导肺泡Ⅱ型上皮细胞向肌成纤维细胞转化的调节过程。
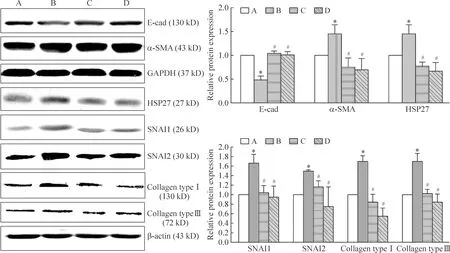
Figure 5.The effect of Ac-SDKP on transfected cultured A549 cells induced by TGF-β1. A: empty vector; B: empty vector+TGF-β1; C: HSP27 shRNA+TGF-β1; D: empty vector +TGF-β1+Ac-SDKP. Mean±SD. n=3. *P<0.05 vs empty vector; #P<0.05 vs TGF-β1+empty vector.
为进一步探讨HSP27与锌指蛋白SNAI1、SNAI2蛋白的相互调节在上皮-间质转化中的作用,我们应用脂质体体外转染细胞的方法将HSP27干扰质粒转染A549肺泡Ⅱ型上皮细胞,结果发现,将HSP27干扰质粒转染A549肺泡Ⅱ型上皮细胞后,再给予TGF-β1诱导刺激,与转染空质粒组相比较,HSP27蛋白表达明显下调,并伴随SNAI1和SNAI2蛋白表达的下调,其中SNAI1蛋白的下调有统计学意义,而SNAI2蛋白的下调无统计学意义。同时α-SMA蛋白的表达下调,E-cad蛋白表达上调。进一步印证了HSP27蛋白能够通过对锌指蛋白SNAI1和SNAI2的调节,在TGF-β1诱导肺泡Ⅱ型上皮细胞向肌成纤维细胞转化过程中发挥了重要的调控作用。
Ac-SDKP是具有抗纤维化作用的四肽,在体外大鼠肺成纤维细胞的培养中,Ac-SDKP能显著抑制p38介导的肺成纤维细胞的增殖以及胶原的合成;并且Ac-SDKP能通过对TGF-β1及其受体介导的血清反应因子(serum response factor,SRF)和α-SMA的调控,抑制TGF-β1诱导的成纤维细胞向肌成纤维细胞的转化,进而抑制胶原蛋白的合成与表达,发挥其抗(矽)肺纤维化的作用[14]。在我们这项研究中,当给予Ac-SDKP对 TGF-β1诱导A549肺泡Ⅱ型上皮细胞进行干预时,能显著下调HSP27蛋白的表达,并伴随锌指因子SNAI1、SNAI2表达的下调,同时细胞的Ⅰ型胶原及Ⅲ胶原蛋白表达也显著下降;在mRNA表达水平检测时也发现,Ac-SDKP干预后能显著下调HSP27和SNAI1、SNAI2 mRNA的表达,这与蛋白水平的表达趋势相一致。这一结果证实了,Ac-SDKP能够通过对HSP27与锌指因子SNAI1、SNAI2蛋白表达的调节,抑制了TGF-β1诱导A549肺泡Ⅱ型上皮细胞向成肌纤维细胞转化并阻抑了细胞胶原蛋白的表达与产生。这一调控的过程与规律与体外应用脂质体将HSP27干扰质粒转染A549肺泡Ⅱ型上皮细胞后所得到的实验结果相一致。提示,Ac-SDKP通过对HSP27和锌指因子SNAI1、SNAI2蛋白表达的调控,抑制了肺泡Ⅱ型上皮细胞向肌成纤维细胞的转化,进而抑制胶原蛋白的合成,而发挥其抗(矽)肺纤维化的作用。
[1] Xu H, Yang F, Sun Y, et al. A new antifibrotic target of Ac-SDKP: inhibition of myofibroblast differentiation in rat lung with silicosis[J]. PLoS One, 2012, 7(7):e40301.
[2] Liang H, Gu Y, Li T, et al. Integrated analyses identify the involvement of microRNA-26a in epithelial-mesenchymal transition during idiopathic pulmonary fibrosis[J]. Cell Death Dis,2014, 2(5):e1238.
[3] Zhao H, Wu QQ, Cao LF, et al. Melatonin inhibits endoplasmic reticulum stress and epithelial-mesenchymal transition during bleomycin-induced pulmonary fibrosis in mice[J]. PLoS One,2014, 9(5):e97266.
[4] Wettstein G, Bellaye PS, Kolb M, et al. Inhibition of HSP27 blocks fibrosis development and EMT features by promoting Snail degradation[J]. FASEB J,2013, 27(4):1549-1560.
[5] Krohn A, Ahrens T, Yalcin A, et al. Tumor cell heterogeneity in Small Cell Lung Cancer (SCLC): phenotypical and functional differences associated with Epithelial-Mesenchymal Transition (EMT) and DNA methylation changes[J]. PLoS One,2014, 9(6):e100249.
[6] Danilov SM, Wade MS, Schwager SL, et al. A novel angiotensin I-converting enzyme mutation (S333W) impairs N-domain enzymatic cleavage of the anti-fibrotic peptide, AcSDKP[J]. PLoS One,2014, 9(2):e88001.
[7] 李淑钰,徐 洪,孙 月,等. Ac-SDKP对ROCK通路介导矽肺大鼠成肌纤维细胞转化抑制作用[J]. 中国职业医学, 2013, 40(2):95-99.
[8] 马文东,袁 媛,杨 奕,等. TGF-β1介导的RhoA/ROCK通路在肺成肌纤维细胞分化中的调节作用[J]. 中国病理生理杂志,2013,29(10):1758-1763.
[9] 于婉莹,徐 洪,邓海静,等. N-乙酰基-丝氨酰-天门冬氨酰-赖氨酰-脯氨酸对人肺泡Ⅱ型上皮细胞向成肌纤维细胞转化的调节作用[J]. 解剖学杂志, 2013, 36(4):711-715.
[10]Vidyasagar A, Reese S, Acun Z, et al. HSP27 is involved in the pathogenesis of kidney tubulointerstitial fibrosis[J]. Am J Physiol Renal Physiol, 2008, 295(3):F707-F716.
[11]Park YM,Lee YH, Kim SH, et al. Snail, a transcriptional regulator, represses adiponectin expression by directly binding to an E-box motif in the promoter[J]. Metabolism, 2012, 61(11):1622-1632.
[12]Vidyasagar A, Reese SR, Hafez O, et al. Tubular expression of heat-shock protein 27 inhibits fibrogenesis in obstructive nephropathy[J]. Kidney Int, 2013, 83(1):84-92.
[13]Phillips S,Prat A, Sedic M, et al. Cell-state transitions regulated by slug are critical for tissue regeneration and tumor initiation[J]. Stem Cell Reports,2014, 2(5):633-647.
[14]袁 媛,杨 方,徐 洪,等. Ac-SDKP对ROCK通路介导的肺成纤维细胞向成肌纤维细胞转化的调节作用[J]. 中华劳动卫生职业病杂志, 2013, 31(9):654-660.
Inhibitory effect of N-acetyl-seryl-aspartyl-lysyl-proline on epithelial-mesenchymal transition by heat-shock protein 27/zinc finger proteins
DENG Hai-jing, LI Shi-feng, ZHANG Li-juan, XUE Xin-xin, DU Shi-pu, SUN Yue, XU Hong, YANG Fang
(ExperimentalandResearchCenter,HebeiUnitedUniversity,GerontologyInternationalScienceandTechnologyCooperationBase,Tangshan063000,China.E-mail:fangyang1955@163.com)
AIM: To detect whether N-acetyl-seryl-aspartyl-lysyl-proline (Ac-SDKP) inhibits epithelial-mesenchymal transition in A549 cells induced by TGF-β1 through suppressing the expression of heat shock protein 27 (HSP27) and zinc finger proteins Snail (including SNAI1and SNAI2) which ultimately inhibited the deposition of type I and type III collagens. METHODS: The colocalizations of HSP27 and SNAI1/SNAI2 respectively on A549 alveolar epithelial cells induced by TGF-β1 were measured by confocal microscopy. The expression of HSP27, SNAI1 and SNAI2 at mRNA level was detected by real-time PCR. Western blotting analysis was used to detect the expression of HSP27, SNAI1 and SNAI2 on epithelial-mesenchymal transition in A549 cells induced by TGF-β1 and also the deposition of type I and type III collagens in A549 cells transfected with HSP27shRNA prior to TGF-β1 stimulation.RESULTS: Compared with control group, TGF-β1 increased the expression of HSP27, SNAI1, SNAI2, type I and type III collagen, which decreased significantly followed by Ac-SDKP intervention. The expression of SNAI1, type I and type III collagen decreased significantly after transfected with HSP27shRNA in A549 cells, which had the similar effect on Ac-SDKP intervention.CONCLUSION: Ac-SDKP inhibits the transition of cultured A549 cells to myofibroblasts and attenuates collagen synthesis by suppressing the expression of HSP27 and zinc finger proteins SNAI1 and SNAI2.
N-acetyl-seryl-aspartyl-lysyl-proline; TypeⅡalveolar epithelial cells; Myofibroblasts; Heat shock protein 27; Zinc finger protein SNAI1; Zinc finger protein SNAI2
1000- 4718(2015)01- 0001- 07
2014- 08- 04
2014- 09- 19
国家自然科学基金资助项目(No. 81072254; No. 81302395); 河北省高等学校科学技术研究重点项目(No. ZD20131035); 唐山市科技计划项目(No. 13130299z)
△通讯作者 Tel: 0315-3725495; E-mail: fangyang1955@163.com
R329.2+1
A
10.3969/j.issn.1000- 4718.2015.01.001
