钙激活氯通道ANO1在小鼠心肌细胞的表达及其功能鉴定*
2015-04-17侯毅鞠许会静张雲乔扈昕虹
侯毅鞠, 许会静, 张雲乔, 扈昕虹, 郝 峰
(吉林医药学院临床生物化学检验教研室,吉林 吉林 132013)
钙激活氯通道ANO1在小鼠心肌细胞的表达及其功能鉴定*
侯毅鞠, 许会静, 张雲乔, 扈昕虹, 郝 峰△
(吉林医药学院临床生物化学检验教研室,吉林 吉林 132013)
目的: 探讨钙激活氯通道蛋白anoctamin 1 (ANO1)在小鼠原代培养心肌细胞中的表达及其功能特性。方法: 采用胰酶与胶原酶共同消化,联合2次差速贴壁法获得C57BL/6小鼠原代心肌细胞;并用免疫荧光染色法检测α-横纹肌肌动蛋白,以鉴定心肌细胞纯度;应用RT-PCR检测小鼠心肌细胞ANO1 mRNA的表达;免疫印迹检测ANO1蛋白在小鼠心肌细胞的表达情况;应用荧光淬灭动力学实验检测ANO1钙激活氯通道的功能特性。结果: RT-PCR结果表明原代培养的小鼠心肌细胞表达ANO1 mRNA。免疫印迹实验结果显示原代培养的小鼠心肌细胞表达ANO1蛋白。 荧光淬灭动力学实验证实表达于小鼠心肌细胞的ANO1具有钙激活氯通道典型的阴离子转运功能特性。结论: ANO1在小鼠心肌细胞中有明确表达,并具有钙激活氯离子通道特性,提示ANO1是钙激活氯通道的分子基础。
Anoctamin 1; 钙激活氯离子通道; 心肌细胞
钙激活氯通道(calcium-activated chloride channels,CaCCs)是心肌主要的氯离子通道之一,与心肌细胞的电活动关系密切。CaCCs不仅参与心肌静息电位的形成及动作电位的复极化过程,并且在急性心肌缺血、再灌注、心力衰竭等病理状态下,CaCCs异常激活,形成瞬间内向电流,产生异常冲动,从而导致心律失常发生。由此,推测CaCCs可能成为治疗心律失常的新靶点。目前研究发现,anoctamin 1 (ANO1) 能够是CaCCs的分子基础,通过ANO1能够产生Ca2+激活的Cl-电流,进一步证实ANO1 蛋白是重要的CaCCs之一[1]。但是ANOl 蛋白是否在心肌表达,尤其是它是否作为心肌内源性CaCCs发挥作用,目前还没有明确研究结论。因此,在本研究中,我们以小鼠原代培养心肌细胞作为研究对象,应用分子生物学、免疫荧光化学方法以及荧光淬灭动力学实验,明确ANO1 在心肌细胞的表达,为深入研究该通道功能、明确与该通道相关各类疾病的机制、相关靶向治疗药物的研发提供实验依据。
材 料 和 方 法
1 实验动物
SPF级C57BL/6 新生乳鼠,雌雄不限,1~3日龄,1.2~1.5 g,由吉林大学第二医院实验动物中心提供。
2 主要试剂
DMEM/F12基本培养基、胰蛋白酶、胶原酶、α-横纹肌肌动蛋白单克隆抗体、Cy3标记的羊抗小鼠 II 抗以及焦碳酸二乙酯(diethylpyrocarbonate,DEPC)均购自Sigma;anti-ANO1单克隆抗体及HRP 标记羊抗兔 IgG 购自 Santa Cruz;T16Ainh-A01购自Millipore;新生牛血清购自 Gibco; TRIzol、转染试剂 Lipofectamine LTX 为 Invitrogen产品;逆转录试剂盒为 Fermentas产品;DL1000 DNA marker、dNTP、Taq DNA聚合酶是 TaKaRa产品;谷氨酰胺是武汉天源生物技术有限公司产品;异丙醇、氯仿是北京化学试剂公司产品;真核表达载体 pcDNA 3.1 YFP H148Q / I152 L 为本实验室前期构建,所用引物由上海生工合成。
3 主要方法
3.1 心肌细胞培养 取新生乳鼠心脏,剥离出心房部分组织,剪成 0.5~1 mm×1 mm×1 mm 的组织块,加入0.125%胰酶与胶原酶,37 ℃水浴。10 min后弃上清液,再次加入消化酶继续消化。15 min后终止消化,收集细胞接种于培养皿进行2次差速贴壁,尽可能除去非心肌细胞。2~3 d后细胞稳定贴壁,此时换培养液,细胞备用。
3.2 心肌细胞形态学观察及纯度鉴定 倒置显微镜观察培养皿内心肌细胞形态并拍照。4% 多聚甲醛固定细胞,2% BSA溶液封闭后加入α-横纹肌肌动蛋白单克隆抗体(1 ∶ 100),湿盒4 ℃过夜。加入 Cy3 标记的羊抗小鼠Ⅱ抗(1∶500),倒置荧光显微镜下(Olympus)观察,计算心肌细胞纯度并拍照。
3.3 RT-PCR检测ANO1表达 第1次换液为3 d后,体外培养心肌细胞呈现单层贴壁生长并融合成片。倒出培养液,每一培养皿中加入1 mL TRIzol 试剂,按 TRIzol 总RNA分离试剂盒说明书提取RNA。以总RNA为模板,oligo ( dt )为逆转录引物,在Super ScriptTMⅢ逆转录酶的作用下进行逆转录反应,合成cDNA,并以此cDNA为模板,进行PCR扩增。参照文献[3]合成ANO1 引物序列,上游引物为5’-GGA CCT GGG CTA TGA GGT TCA G-3’,下游引物为5’-CAG CGC GTC CCC ATG GTA CTC-3’;内参照β-actin的上游引物为5’-CAT CCT GCG TCT GGA CCT G-3’,下游引物为5’-ATC TCC TTC TGC ATC CTG TC-3’。 基因扩增体系为94 ℃ 45 s, 60 ℃ 45 s, 72 ℃ 1 min,扩增40个循环。取RT-PCR产物10.0 μL,加上样缓冲液2.0 μL,在2%琼脂糖凝胶上(0.03% 溴化乙锭)电泳,70 V 40 min,凝胶图像成像系统拍摄实验结果。
3.4 免疫印迹检测ANO1蛋白的表达 收集状态良好的心肌细胞,PBS冲洗3次,加入100 μL蛋白裂解液充分裂解,12 000 r/min,4 ℃离心10 min,取上清,BCA蛋白质定量试剂盒测蛋白质浓度。加入上样缓冲液后煮沸变性,冷却后冻存备用。取变性蛋白样品进行SDS-PAGE分离蛋白,电泳结束后将分离好的蛋白条带转移至PVDF膜。用含5%脱脂奶粉的TBST对PVDF膜室温封闭2 h,以封闭非特异性结合位点。然后加入兔抗鼠ANO1单克隆抗体(1∶100)4 ℃过夜。TBST缓冲液漂洗,加入辣根过氧化物酶(HRP)标记的IgG II抗(1∶500),室温孵育1 h。免疫反应完成后继续用TBST洗膜,均匀加入化学发光底物到 PVDF 膜上,室温孵育 1 min。于暗室中去除发光液,压片,曝光 1 min,显影、定影,采集图像后分析ANO1蛋白的表达。
3.5 荧光淬灭动力学实验签定ANO1功能 将生长状态良好的细胞消化传代于黑壁透明的96孔板中,细胞数为每孔20 000,然后将细胞放入CO2培养箱中培养24 h,直到细胞长成单层。将 Lipofectamine LTX 和pcDNA 3.1 YFP H148Q/I152L滴加入含有心肌细胞的培养板中,36 h后于倒置荧光显微镜下观察YFP黄绿色荧光表达情况。以PBS洗涤细胞,加入含有 ionomycin(5 μmol/L)的高 I-溶液,利用钙激活氯通道对阴离子的转运功能以及YFP H148Q/I152L对 I-敏感的特点,在Ca2+激活CaCCs后,应用Fluostar 多功能酶标仪检测通过ANO1转运的I-,对小鼠心肌细胞内 YFP H148Q 蛋白黄绿色荧光的淬灭,并且按照每个点5 s的速度连续测定14 s,获取荧光强度动态曲线。实验设置ANO1特异抑制剂 T16Ainh-A01(10 μmol/L)溶液及不含ionomycin高 I-溶液作为对照,以此确定ANO1通道功能特性。
结 果
1 心肌细胞的分离与培养
采用胰酶与胶原酶共同消化,联合 2 次差速贴壁法获得较多 C57BL/6 小鼠原代心肌细胞,见图 1。
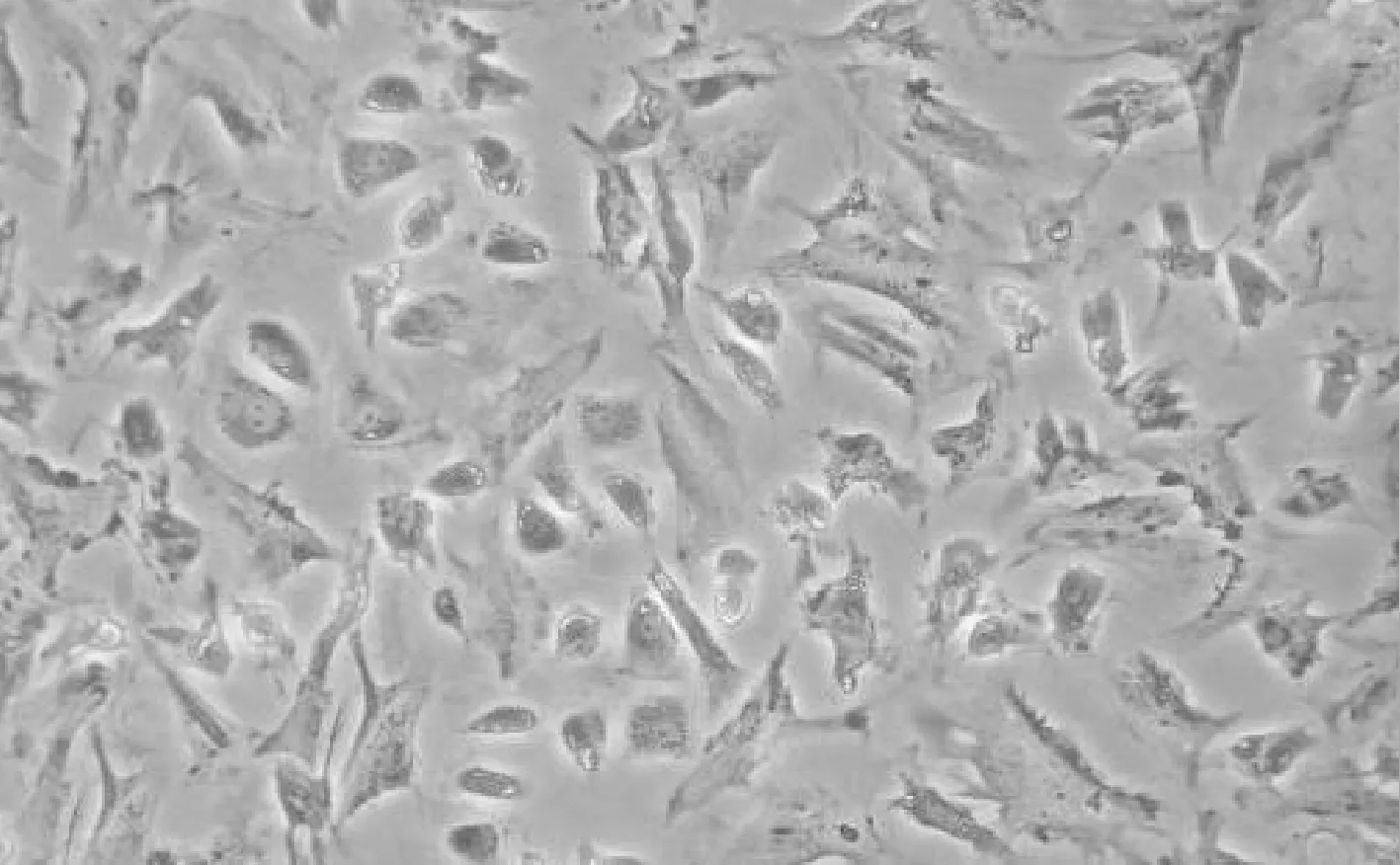
Figure 1.Mouse cardiomyocytes were isolated and cultured for 48 h (×200).
2 心肌细胞的纯度鉴定
α-横纹肌肌动蛋白染色阳性心肌细胞见图2,可观察到明显横纹肌结构。α-横纹肌肌动蛋白染色阳性率代表心肌细胞纯度,为 95.81%。
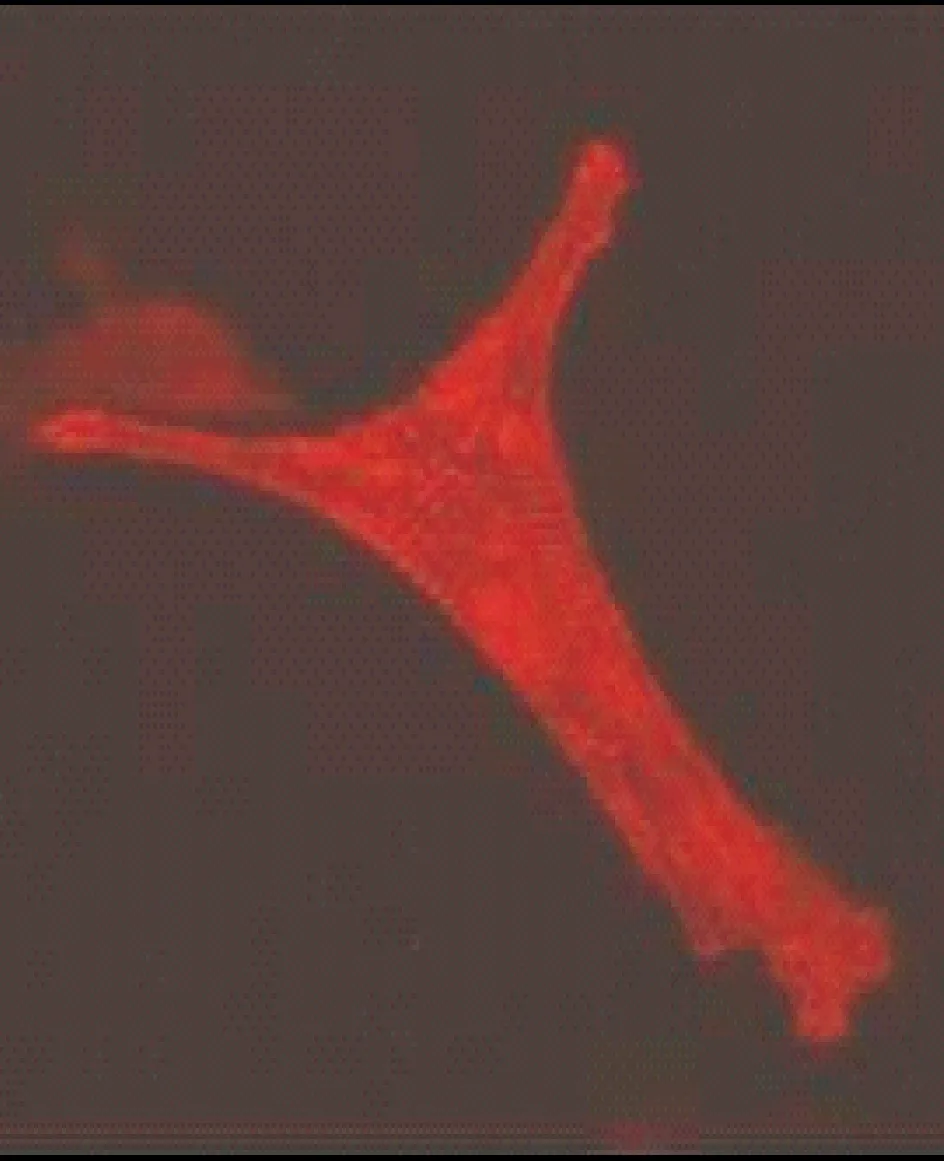
Figure 2.Immunofluorescent staining of α-sarcomeric actin antibody (×400).
3 心肌细胞ANO1的mRNA表达
RT-PCR 结果表明,在 400 bp 附近出现特异性条带,与预期的目的片段大小相符,见图3。证实经原代分离培养的小鼠心肌细胞在 mRNA 水平上有 ANO1 的表达,并且目的基因电泳条带的灰度值与 β-actin 近似,表明小鼠心肌细胞中 ANO1 在mRNA 水平表达稳定。
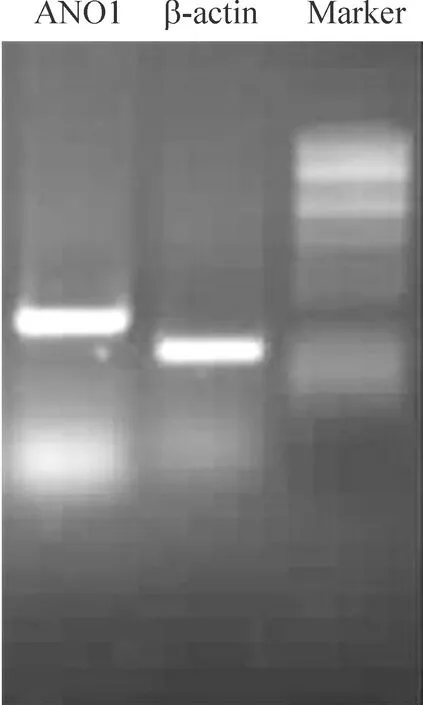
Figure 3.The mRNA expression of ANO1 in the mouse cardiomyocytes detected by RT-PCR.
4 ANO1 蛋白在小鼠心肌细胞的表达
小鼠 ANO1 蛋白大小为150 kD,根据 Western blotting 结果中蛋白marker 的位置,心肌细胞提取蛋白在分离胶相应的位置上可见预期大小的清晰条带, 证明小鼠心肌细胞在蛋白水平表达ANO1,见图4。
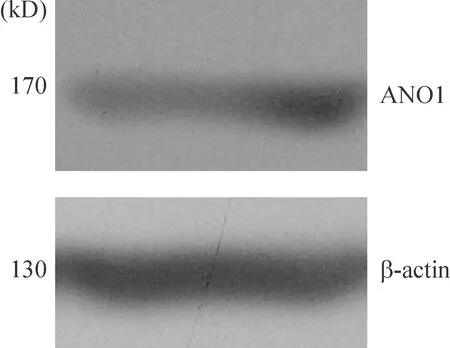
Figure 4.The protein expression of ANO1 in the mouse cardiomyocytes.
5 心肌细胞ANO1 的功能特性鉴定
YFP H148Q/I152L荧光淬灭实验结果显示,ionomycin 可使胞浆中钙离子浓度迅速升高,继而引起 CaCCs 开放,使细胞外溶液中高浓度的碘离子向胞内转运,导致 YFP 蛋白荧光强度迅速下降(图 5 A),表明 ANO1 具有内向转运 I-的功能,符合 CaCCs 功能特点。对照组由于缺乏 ionomycin,即没有Ca2+的激活作用,ANO1没有开放,所以YFP 蛋白荧光强度无明显变化,表明心肌细胞 ANO1 的激活的确与钙离子密切相关,加入 ANO1特异抑制剂 T16Ainh-A01,YFP 蛋白荧光强度同样无明显变化,更进一步明确心肌细胞内流的碘是通过 ANO1 实现的(图5B)。上述结果一致表明,表达于小鼠心肌细胞的 ANO1 具有钙激活和转运碘离子的特性,符合经典 CaCCs,提示ANO1是钙激活氯离子通道的分子基础。
讨 论
近年来,氯通道在心脏生理和病理过程中的作用已经受到越来越多国内外学者的重视。其中 CaCCs的动力学特性是依赖于细胞内Ca2+浓度变化,进而对心肌细胞电活动产生直接影响。尤其是当机体处于病理状态,如急性心肌缺血再灌注、心力衰竭、心肌肥厚等可以引起细胞内钙超载,CaCCs通道异常激活,形成异常冲动,导致心律失常[2]。2008年Nature[3]、Science[4]和Cell[5]同时报道,内源性CaCCs通道是由ANO1蛋白构成,这一发现为特定细胞和组织中研究氯离子通道的生理病理相关问题及其作用机制提供了新的研究平台。
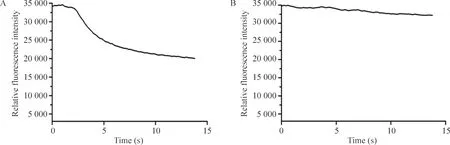
Figure 5.ANO1 assay based on the halide-sensitive YFP H148Q/I152L in the mouse cardiomyocytes. A: representative trace showed cell fluorescence quenching upon the addition of extracellular I plus ionomycin in the cells stably expressing ANO1; B: representative trace of control group.
ANO1是跨膜蛋白 anoctamin(也称作 TMEM 16)家族中的一员,其功能尚不明确。目前已证明,ANO1蛋白在各种分泌上皮(如气管上皮,唾液腺上皮)、视网膜和感觉神经元、胃肠道 Cajal 间质细胞、血管平滑肌等均有表达[6-7],且作为 CaCCs 通道发挥重要作用。此外亦有文献显示,ANO1 在头颈部及胃肠道等肿瘤中表达增加,而且与肿瘤的发生、转移、侵袭关系密切[8]。新近已有学者发表关于ANO1蛋白在心肌细胞表达的研究结论[9],为此我们通过本研究进一步验证该结论,以确定ANO1作为心肌内源性 CaCCs 所发挥的重要作用。我们以原代培养获得 C57BL/6 小鼠心肌细胞作为研究对象,应用 RT-PCR 检测到小鼠心肌细胞 ANO1 在mRNA 水平稳定表达,通过免疫印迹实验进一步证实小鼠心肌细胞存在 ANO1 蛋白的表达。利用荧光淬灭动力学实验,验证ANO1 蛋白的确具有 CaCCs 通道的功能特性。因此,我们认为小鼠心肌细胞中的 ANO1 是钙激活氯离子通道的分子基础。本研究所获得的结论能够为 CaCCs 通道功能研究、心脏相关疾病机制的进一步了解、抗心律失常及心肌保护药物研发提供新靶点、新途径和新方向。
目前,有关心脏氯通道的基因、分子结构、通道特性和生理功能,以及通道在心律失常等病理状态下作用的研究都取得了重大的进步。但是,我们也清楚地看到由于通道结构的复杂性,对于通道的调节机制仍存在很多的未知,都是目前亟待解决的问题。因此,我们后续将在 ANO1 通道的分子结构、调节机制和特异性调控药物等方面展开相应的研究。随着研究水平的深入和科技的进步,人类必将会逐步揭示氯通道在心律失常中的作用机制,并寻找到对疾病更为有意义的预防和治疗方法。
[1] Hartzell HC, Yu K, Xiao Q, et al. Anoctamin/TMEM16 family members are Ca2+-activated Cl-channels[J]. J Physiol, 2009, 587(Pt 10):2127-2139.
[2] 王 莉, 张海林. Ca2+激活Cl-通道功能及分子基础研究进展[J]. 中国细胞生物学学报, 2012, 34(5):477-484.
[3] Yang YD, Cho H, Koo JY, et al. TMEM16A confers receptor-activated calcium-dependent chloride conductance[J]. Nature, 2008, 455(7217): 1210-1215.
[4] Caputo A, Caci E, Ferrera L, et al. TMEM16A, a membrane protein associated with calcium-dependent chloride channel activity[J]. Science, 2008, 322(5901): 590-594.
[5] Schroeder BC, Cheng T, Jan YN, et al. Expression cloning of TMEM16A as a calcium-activated chloride channel subunit[J]. Cell, 2008, 134(6):1019-1029.
[6] Sheridan JT, Worthington EN, Yu K, et al. Characterization of the oligomeric structure of the Ca2+-activated Cl-channel Ano1/TMEM16A[J]. J Biol Chem, 2011, 286(2):1381-1388.
[7] Kunzelmann K, Kongsuphol P, Chootip K, et al. Role of the Ca2+-activated Cl-channels bestrophin and anoctamin in epithelial cells[J]. Biol Chem, 2011, 392(1-2):125-134.
[8] 柏志全, 李春英, 李 媛, 等. 氯通道在华蟾酥毒基诱导的鼻咽癌细胞凋亡中起重要作用[J]. 中国病理生理杂志, 2011, 27(5):833-837.
[9] Ye Z, Wu MM, Wang CY, et al. Characterization of car-diac anoctamin1 Ca2+-activated chloride channels and functional role in ischemia-induced arrhythmias [J]. J Cell Physiol, 2015, 230(2):337-346.
Expression and identification of ANO1 in mouse cardiomyocytes
HOU Yi-ju, XU Hui-jing, ZHANG Yun-qiao, HU Xi-hong, HAO Feng
(DepartmentofBiochemistryLaboratory,JilinMedicalCollege,Jilin132013,China.E-mail: 1208254922@qq.com)
AIM: To explore the expression of anoctamin 1 (ANO1), one of calcium-activated chloride channels (CaCCs), in mouse cardiomyocytes and its functional properties. METHODS: The cardiomyocytes from the myocardial tissues of C57BL/6 mice were isolated with enzyme and purified by the differential adherent method. The cells were stained with monoclonal anti-sarcomeric actin and Cy3 to evaluate the purity of the myocardial cells. RT-PCR was used to detect the mRNA expression of ANO1 in the mouse cardiomyocytes. The protein expression of ANO1 in the mouse cardiomyocytes was determined by Western blotting analysis. The fluorescence quenching kinetics experiment was used to identify the ion transport properties of ANO1 in the mouse cardiomyocytes. RESULTS: The results of RT-PCR confirmed that ANO1 was expressed in freshly isolated myocardial cells. The results of Western blotting clearly demonstrated the protein expression of ANO1 in primarily cultured myocardial cells. Fluorescence quenching kinetics experiment on freshly isolated single myocardial cell revealed a pronounced outward rectifying property of the ANO1. The functional properties were similar to the classic CaCCs. CONCLUSION: ANO1 expression was identified in the mouse myocardial cells. The function of CaCCs was generated by ANO1, suggesting that ANO1 is the molecular basis of CaCCs.
Anoctamin 1; Calcium-activated chloride channels; Cardiomyocytes
1000- 4718(2015)03- 0539- 04
2014- 10- 22
2014- 11- 18
国家自然科学基金资助项目(No. 81202031);吉林省教育厅基金资助课题(No. 2013351);2014年吉林省大学生创新创业训练计划;2013年吉林省大学生创新创业训练计划;吉林医药学院大学生科研基金资助课题(吉医学科字[2012]第12号)
△通讯作者 Tel: 0432-64560538; E-mail: 1208254922@qq.com
R337.5
A
10.3969/j.issn.1000- 4718.2015.03.027
