c-Met对三阴性乳腺癌细胞增殖及阿霉素耐药性的影响*
2015-04-17邓智平廖和和王周权宋张骏姚俊涛张明鑫
邓智平, 廖和和, 王周权, 杨 波, 宋张骏, 姚俊涛, 任 宏, 张明鑫
(1西安交通大学医学院第一附属医院胸外二科, 2陕西省肿瘤医院乳腺科,陕西 西安 710061;3第四军医大学唐都医院,陕西 西安 710000)
c-Met对三阴性乳腺癌细胞增殖及阿霉素耐药性的影响*
邓智平1,2△, 廖和和1, 王周权1, 杨 波1, 宋张骏1, 姚俊涛1, 任 宏1, 张明鑫3
(1西安交通大学医学院第一附属医院胸外二科,2陕西省肿瘤医院乳腺科,陕西 西安 710061;3第四军医大学唐都医院,陕西 西安 710000)
目的: 研究c-Met对三阴性乳腺癌细胞株MDA-MB-231活力及对阿霉素耐药性的影响。方法: 构建阿霉素耐药的MDA-MB-231/ADR细胞系,实时荧光定量PCR及Western blotting技术检测不同细胞系中c-Met mRNA及蛋白的表达。脂质体转染c-Met-siRNA及表达质粒或AKT-siRNA,Western blotting检测转染效率;四甲基偶氮唑法(MTT法)检测细胞的活力及对阿霉素的敏感性。结果: 对阿霉素耐药的MDA-MB-231/ADR细胞中c-Met的mRNA及蛋白表达均显著高于对照的MDA-MB-231细胞,转染高表达c-Met的质粒可增加MDA-MB-231细胞的活力并降低其对阿霉素的敏感性,而利用siRNA抑制耐药细胞株中c-Met的表达后,可以逆转MDA-MB-231/ADR细胞对阿霉素的耐药。此外,c-Met可以磷酸化激活细胞中的AKT,并通过该信号分子增加MDA-MB-231细胞活力并诱导耐药。结论: c-Met可作为一个重要的靶点应用于三阴性乳腺癌的治疗。
c-Met; 三阴性乳腺癌; 细胞增殖; 阿霉素; 耐药性
三阴性乳腺癌(triple negative breast cancer,TNBC)是一种不表达雌、孕激素受体和人类表皮生长因子受体2(human epidermal growth factor receptor 2, HER2)的乳腺癌亚型,临床上表现为发病年龄轻,肿块较大,组织学分化差,易发生远处转移[1]。由于缺少激素受体及HER2靶点,不能从内分泌治疗及靶向治疗中获益,故化疗仍为TNBC治疗的重要手段之一。对于早期TNBC,其对化疗药物的敏感性高于其它类型的乳腺癌,但随着疾病的进展,TNBC往往表现出一定的耐药性,使得晚期TNBC的预后极差[2]。因此,发现并阐明TNBC耐药的分子机制,寻求新的治疗靶标,有助于提高耐药TNBC的疗效,也是当前TNBC研究领域的重要方向。
肝细胞生长因子受体c-Met是原癌基因c-met的编码产物,其与配体结合后,发生自身磷酸化,并进一步活化细胞内多种不同的信号分子,经过瀑布式的磷酸化反应,将外界信号逐渐放大,最终传至细胞核内,诱导细胞发生一系列反应,包括细胞增殖、运动、迁移和形态改变等。研究证实,其可以促进多种恶性肿瘤的发生及发展,包括乳腺癌[3]。此外,c-Met诱导肿瘤细胞耐药的研究也多有报道。然而,对于c-Met促进TNBC细胞耐药的研究尚未见相关报道。因此,本文将通过研究c-Met在TNBC细胞阿霉素耐药中的作用及其相关机制,为其作为TNBC耐药后治疗的靶点提供理论依据。
材 料 和 方 法
1 实验试剂
c-Met抗体、AKT抗体、磷酸化AKT(p-AKT)抗体、GAPDH抗体及c-Met-siRNA、AKT-siRNA购于Santa Cruz;荧光标记 II 抗购于Li-Cor Biosciences;Lipofectamine 2000转染试剂购于Invitrogen;胎牛血清及DMEM培养基均购于Gibco;阿霉素(adriamycin,ADR)购于Sigma;能表达稳定活性c-Met蛋白的pBABE-puro TPR-Met质粒(Addgene plasmid 10902)[4]由Addgene提供。
2 细胞培养及耐药株构建
MDA-MB-231细胞系购于ATCC,使用含10%胎牛血清及100 mg/L青霉素/链霉素的DMEM培养基,置于5% CO2、37 ℃的恒温培养箱中培养。在构建阿霉耐药细胞株(MDA-MB-231/ADR)时,在培养基中加入终浓度为0.1 mg/L的阿霉素,10次传代后收集存活细胞,并继续在含有多柔比星的培养基中培养至少6个月的时间,以确保其耐药性[5-6]。
3 主要实验方法
3.1 siRNA及质粒转染 siRNA或质粒转染时,于6孔板中每孔接种105个细胞,加入2 mL培养基,当细胞密度达到80%~90%时使用Lipofectamine 2000作为转染试剂,按试剂说明书进行实验操作,并在转染48 h后检测转染效率或用于下一步实验。
3.2 实时荧光定量PCR 收集细胞加入Qiagen RLT裂解液,RNeasy mini kit (Qiagen)提取RNA,并使用M-MLV反转录酶进行反转录。实时荧光定量PCR使用SYBR Green I Master Mix 试剂盒及Light Cycler 480检测系统(Roche),GAPDH作为内参照,设置阴性、阳性对照,每个样本重复测量3次。使用引物序列如下:c-Met的上游引为5’-TCTTGGGACATCAGAGGGTC-3’,下游引物为5’-TGACTGCAGGACTGGAAATG-3’;GAPDH的上游引物为5’-GAAGGTGAAGGTCGGAGT-3’,下游引物为5’-GAAGATGGTGATGGGATTTC-3’。
3.3 Western blotting实验 收集细胞,RIPA缓冲液裂解细胞提取总蛋白并进行定量,行SDS-PAGE分离蛋白,计算50 ng蛋白溶液上样体积,常规电泳、转膜后孵育I抗及荧光标记的II抗,使用Odyssey 红外成像系统(Li-Cor Biosciences)检测膜上的荧光强度并进行分析。
3.4 MTT实验 96孔板每孔接种5×103细胞,180 μL全培养基,5% CO2、37 ℃的恒温培养箱中分别培养24 h、48 h及96 h。去上清,加入180 μL PBS及20 μL浓度为5 g/L的MTT溶液,37 ℃孵育4 h,弃上清加入DMSO 50 μL,室温放置15 min后,振荡混匀,用酶标仪于570 nm波长下测定吸光度值。实验设置对照组和干扰组,每组细胞均做5复孔。
4 统计学处理
数据分析使用SPSS 19.0统计软件,计量资料使用均数±标准差(mean±SD)表示,两组间差异的比较采用t检验。 以P<0.05为差异有统计学意义。
结 果
1 c-Met在MDA-MB-231细胞及MDA-MB-231/ADR细胞中的差异表达
MDA-MB-231/ADR细胞中c-Met的mRNA及蛋白表达均显著高于对照的MDA-MB-231细胞(P<0.01),见图1。
2 c-Met促进MDA-MB-231细胞的增殖及阿霉素耐药
利用pBABE-puro TPR-MET质粒转染乳腺癌细胞,使MDA-MB-231细胞高表达具有稳定活性的c-Met蛋白(P<0.01),见图2。与未转染或转染空载体质粒(MDA-MB-231/NC)的MDA-MB-231细胞相比,c-Met高表达的MDA-MB-231/c-Met细胞活力显著增强(P<0.01),见图3。此外,在培养基中加入终浓度为0.1 mg/L的阿霉素72 h后,发现阿霉素可以有效抑制MDA-MB-231及MDA-MB-231/NC细胞的活力(P<0.05),但对c-Met蛋白高表达的MDA-MB-231细胞影响较小,表明c-Met可以促进MDA-MB-231细胞对阿霉素的耐药,见图4。
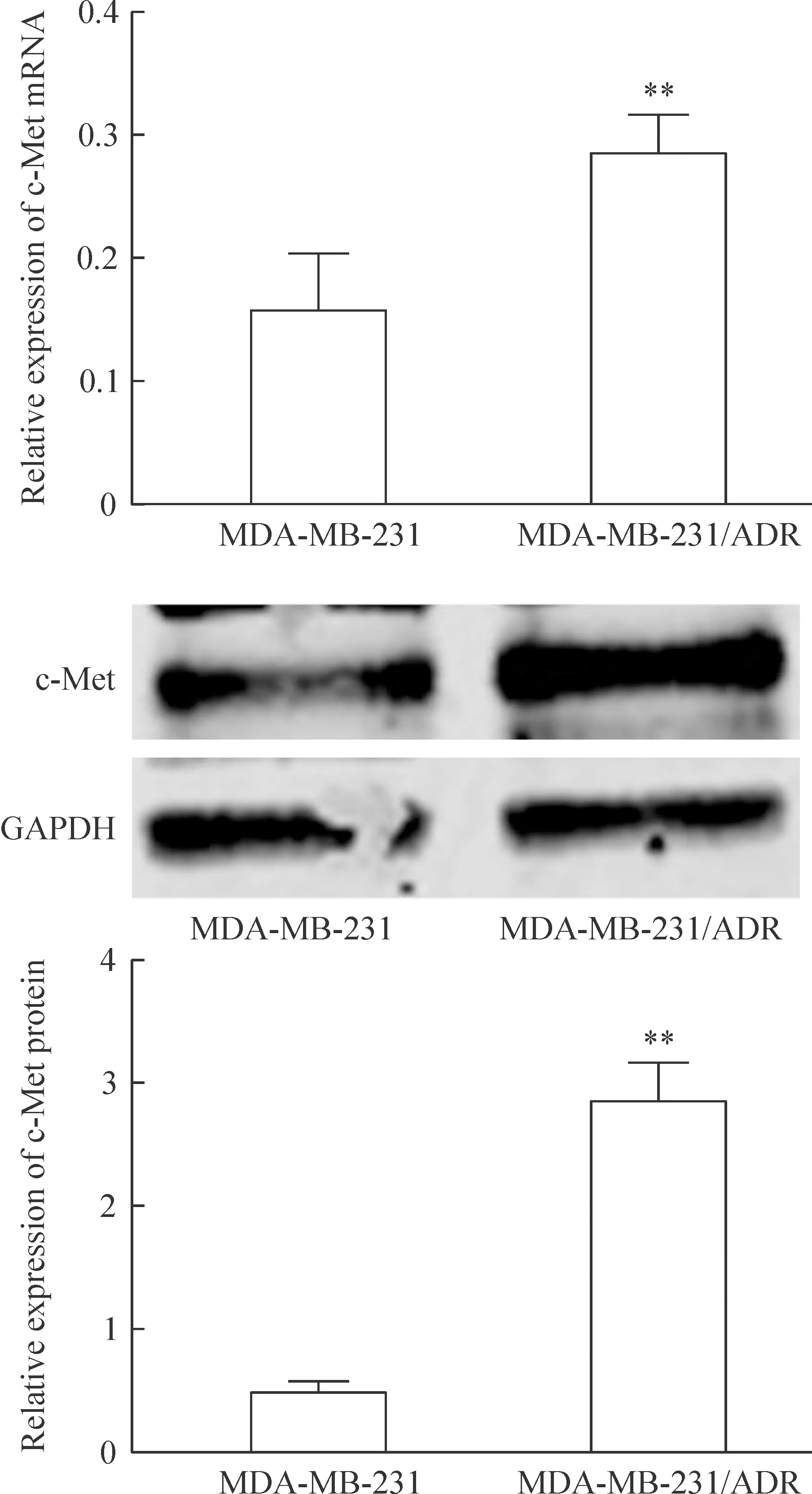
Figure 1.The differential expression of c-Met in MDA-MB-231 cells and MDA-MB-231/ADR cells.Mean±SD. n=3~5. ** P<0.01 vs MDA-MB-231 cells.
3 抑制c-Met表达逆转MDA-MB-231/ADR细胞的阿霉素耐药
阿霉素不影响MDA-MB-231/ADR的细胞活力,但当利用c-Met-siRNA抑制MDA-MB-231/ADR中的c-Met后,阿霉素可显著降低MDA-MB-231/ADR的细胞活力(P<0.05),表明降低细胞中c-Met的表达可以逆转乳腺癌细胞对阿霉素的耐药,见图5。
4 c-Met通过AKT信号介导MDA-MB-231细胞耐药
AKT是HGF/c-Met信号途径中一个重要的下游信号分子[7],其可能也参与了c-Met对TNBC细胞耐药的调控。为了验证这个假设,我们首先观察了c-Met对MDA-MB-231细胞中AKT表达或活性的影响,结果发现,转染c-Met高表达质粒的乳腺癌细胞中AKT的表达并未升高,但磷酸化的AKT水平显著增加(P<0.01),表明c-Met可以促进AKT的活化。此外,当共转染AKT-siRNA及c-Met高表达质粒后,MDA-MB-231细胞表现出与未干预细胞类似的阿霉素敏感性(P<0.05),表明当AKT被抑制后,c-Met促MDA-MB-231细胞耐药的能力减弱,见图6。

Figure 2.The stable expression of c-Met protein in the TNBC cell line by transfection of the plasmid pBABE-puro TPR-Met. Mean±SD. n=3. **P<0.01 vs MDA-MB-231 cells and MDA-MB-231/NC cells.
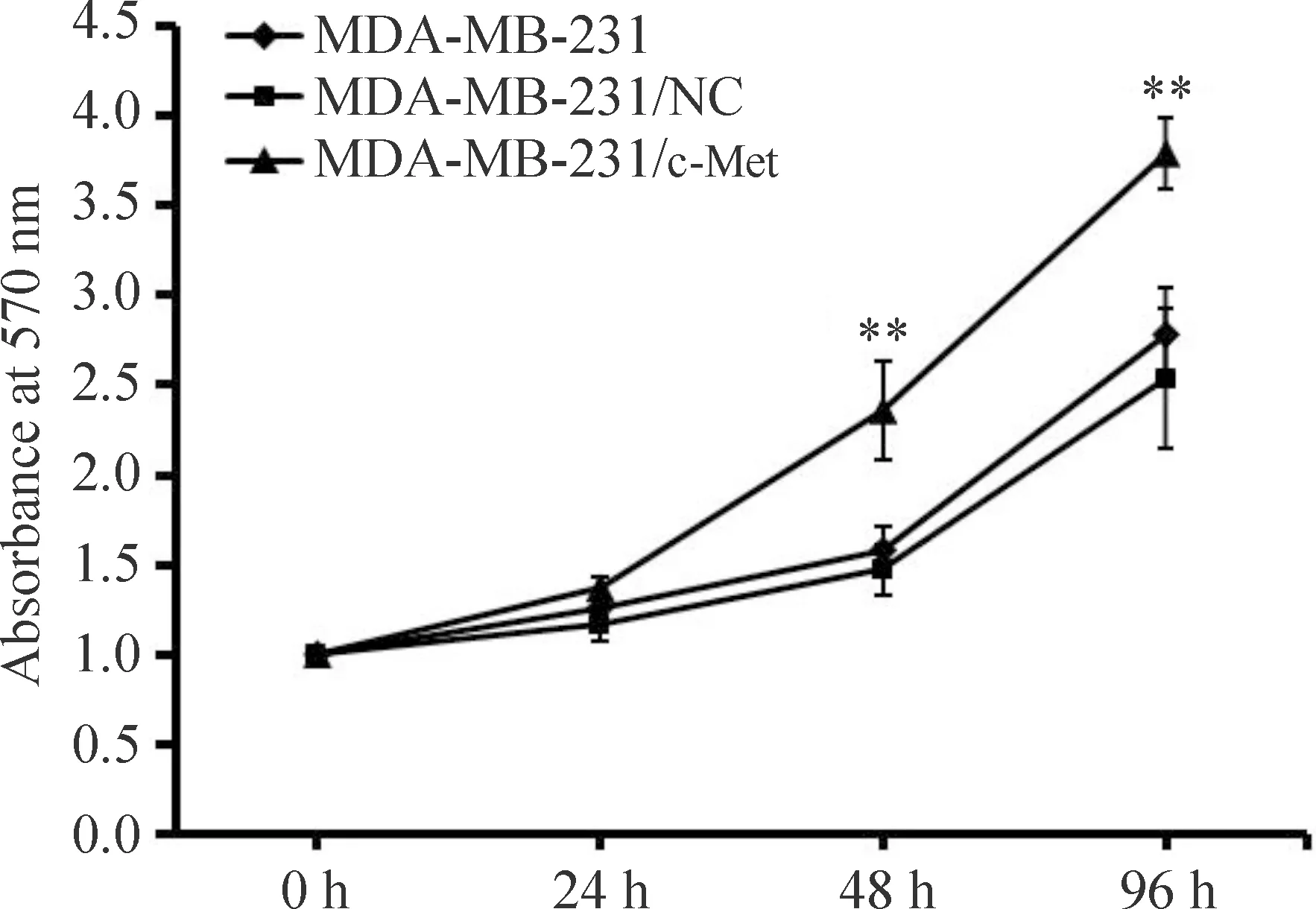
Figure 3.Over-expression of c-Met increased the MDA-MB-231 cell activity. Mean±SD. n=3. **P<0.01 vs MDA-MB-231 cells and MDA-MB-231/NC cells.
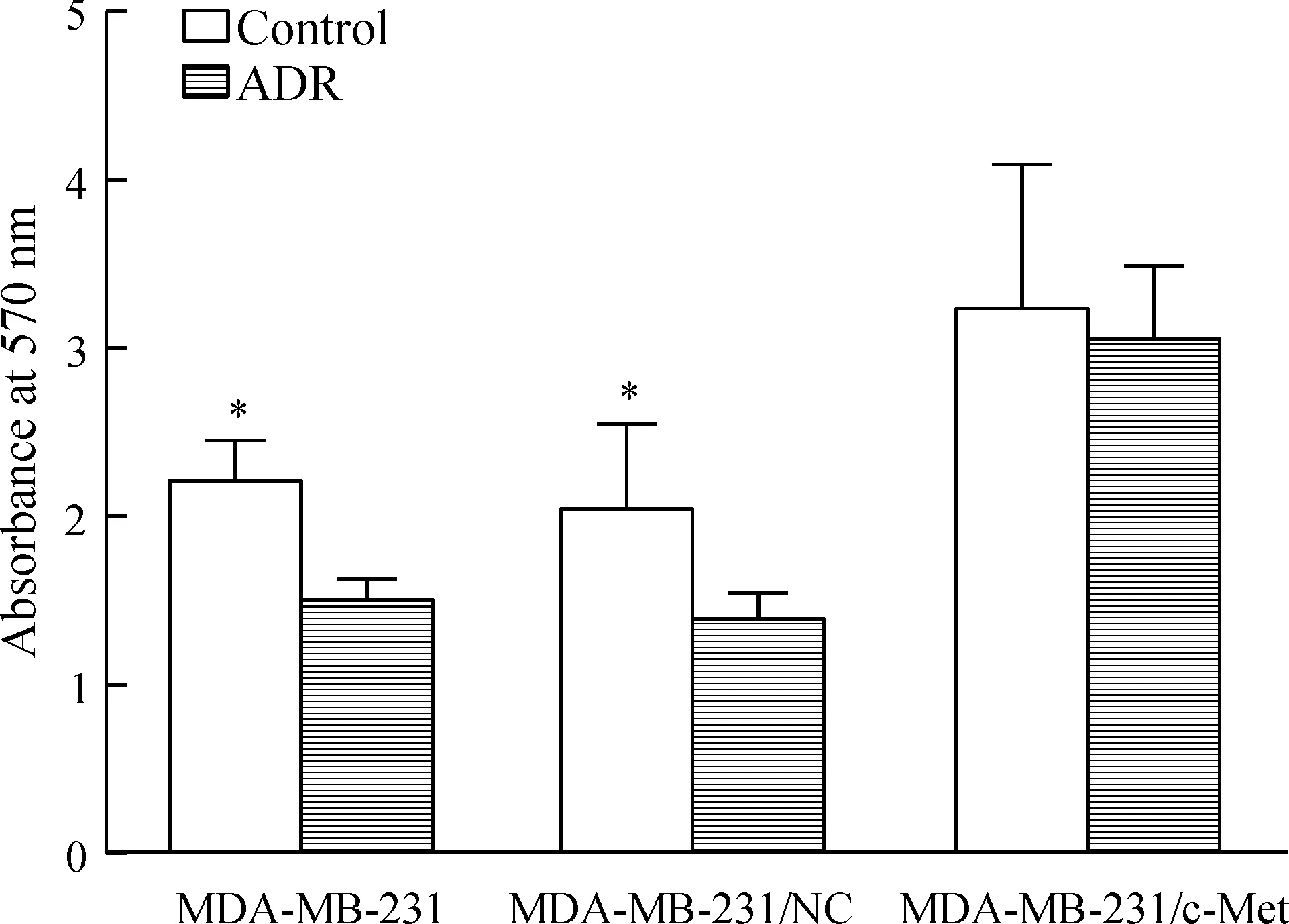
Figure 4.The effects of c-Met on the doxorubicin induced inhibition of MDA-MB-231 cell activity. Mean±SD. n=3. *P<0.05 vs ADR.
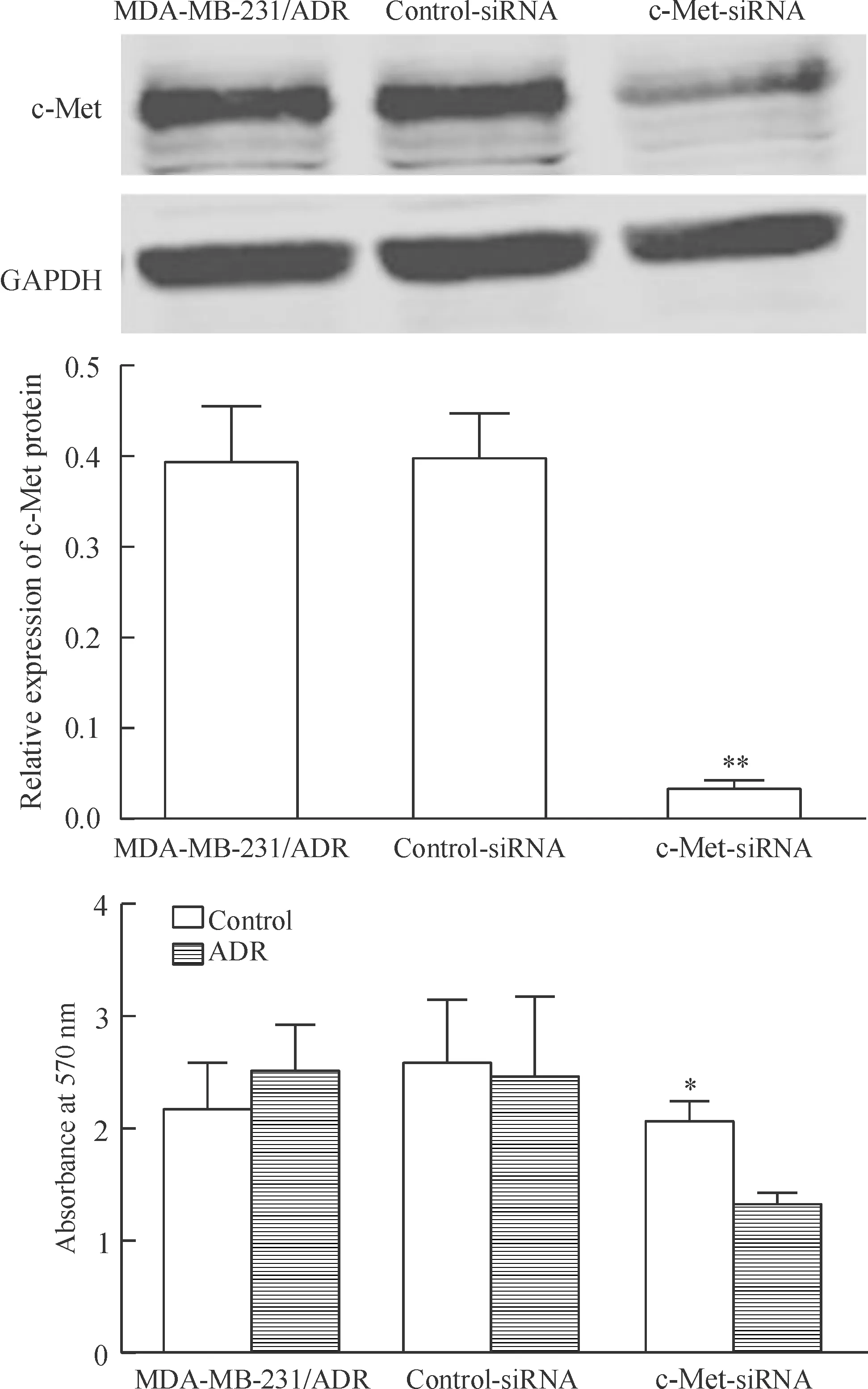
Figure 5.Inhibition of c-Met reversed doxorubicin resistance of MDA-MB-231/ADR cells. Mean±SD. n=3. *P<0.05 vs ADR; **P<0.01 vs MDA-MB-231/ADR and control-siRNA.
讨 论
c-Met在三阴性乳腺癌中的高表达已被多项研究证实[8-9],然而对于其在耐药细胞中的表达研究却较少。大量研究表明,c-Met对肿瘤组织的生长、迁移和侵袭、肿瘤新生血管的形成均具有重要意义[3]。过去的几十年中,c-Met被证实在乳腺癌组织中过表达,与其相关的信号通路与乳腺肿瘤的发展及预后密切相关[10]。在TNBC中,c-Met同样能促进癌症的恶化,并被认为可以作为TNBC的治疗靶点[10]。在本实验中,当在MDA-MB-231细胞中高表达c-Met蛋白时,细胞的增殖能力显著提高,再次证实了c-Met具有促进TNBC进展的作用。受此启发,多种人工设计的可溶性c-Met受体拮抗剂已被用于体外或体内实验,结果证实其能有效抑制TNBC的增殖及转移[10]。如冯炜红等[11]利用c-Met抑制剂SGX523作用于MDA-MB-231细胞,结果发现SGX523能明显抑制乳腺癌细胞的增殖,SGX523处理MDA-MB-231细胞48 h后,可诱导乳腺癌细胞凋亡和细胞周期G0/G1期阻滞。这些结果为c-Met靶向治疗的临床转化提供了良好的实验及理论基础。

Figure 6.c-Met induced doxorubicin resistance of MDA-MB-231 cells through AKT pathway. Mean±SD. n=3. *P<0.05 vs ADR; **P<0.01 vs MDA-MB-231 cells and MDA-MB-231/NC cells.
但值得注意的是,关于c-Met在TNBC细胞耐药中的作用尚无相关研究。因此,本实验以TNBC细胞系MDA-MB-231作为研究对象,通过增加或降低细胞中c-Met的表达来评价其在TNBC细胞阿霉素耐药中的作用。结果发现,阿霉素耐药细胞株中c-Met的表达升高,而在MDA-MB-231细胞中高表达c-Met蛋白可以降低癌细胞对阿霉素的敏感性;同时,抑制耐药细胞株中c-Met的表达可以逆转癌细胞对阿霉素的耐药。这些结果与Que等[12]在骨髓瘤细胞中的发现一致,即抑制c-Met的表达可以提高肿瘤细胞对阿霉素化疗的敏感性。此外,Shattuck等[13]还发现,c-Met能诱导HER2阳性乳腺癌对曲珠单抗的耐药,再次证实c-Met与乳腺癌耐药的相关性。因此,针对c-Met的靶向治疗可以为肿瘤耐药后的治疗提供新的策略。
c-Met作为肝细胞生长因子受体促进乳腺癌发生、发展的过程中,涉及多个信号通路,如与细胞存活相关的PI3K/AKT通路、增殖相关ERK/MAPK通路及转移侵袭相关Crk/Rac通路[10,14]。而本研究发现,c-Met促进TNBC细胞阿霉素耐药主要通过AKT信号分子,当AKT被抑制后,c-Met促MDA-MB-231细胞耐药的能力明显减弱。在此过程中值得注意的是,c-Met是一种具有络氨酸激酶活性的蛋白,其信号转导主要是通过磷酸化激活下游信号分子,如AKT等。在本实验中,我们同样观察到c-Met可磷酸化激活AKT,而并不影响其表达量。该现象也在冯炜红等[11]的研究中得以证实。
本实验中仅应用了1个TNBC细胞系作为研究对象,c-Met及其相关分子信号的促阿霉素耐药作用是否普遍存在于TNBC还需应用更多的细胞系来验证,同时体内实验的完善能更进一步地确认c-Met的作用。其次,本研究仅仅评价了TNBC中c-Met与阿霉素耐药之间的关系,对于TNBC以蒽环类及紫杉醇类为1线方案的其它药物耐药的研究也需要更多的实验来加以证实。我们在前期的研究中发现当初始细胞密度低于60%时,MTT的检测结果与BrdU法的检测结果具有较高的一致性,这与刘苹等[15]的研究结果相似。本研究的MTT实验结果在一定程度上也反映了细胞的增殖能力。对于这些结果,我们将在今后的研究进一步加以验证。
[1] Poage GM, Hartman ZC, Brown PH. Revealing targeted therapeutic opportunities in triple-negative breast cancers: a new strategy[J]. Cell Cycle, 2013, 12(17):2705-2706.
[2] Crown J, O’Shaughnessy J, Gullo G. Emerging targeted therapies in triple-negative breast cancer[J]. Ann Oncol, 2012, 23(Suppl 6):vi56-vi65.
[3] Blumenschein GR Jr, Mills GB, Gonzalez-Angulo AM. Targeting the hepatocyte growth factor-cMET axis in can-cer therapy[J]. J Clin Oncol, 2012, 30(26):3287-3296.
[4] Gupta PB, Kuperwasser C, Brunet JP, et al. The melanocyte differentiation program predisposes to metastasis after neoplastic transformation[J]. Nat Genet, 2005, 37(10):1047-1054.
[5] Fang Y, Shen H, Cao Y, et al. Involvement of miR-30c in resistance to doxorubicin by regulating YWHAZ in breast cancer cells[J]. Braz J Med Biol Res, 2014, 47(1):60-69.
[6] Bao L, Hazari S, Mehra S, et al. Increased expression of P-glycoprotein and doxorubicin chemoresistance of metastatic breast cancer is regulated by miR-298[J]. Am J Pathol, 2012, 180(6):2490-2503.
[7] Usatyuk PV, Fu P, Mohan V, et al. Role of c-Met/phosphatidylinositol 3-kinase (PI3k)/Akt signaling in hepatocyte growth factor (HGF)-mediated lamellipodia formation, reactive oxygen species (ROS) generation, and motility of lung endothelial cells[J]. J Biol Chem, 2014, 289(19):13476-13491.
[8] Inanc M, Ozkan M, Karaca H, et al. Cytokeratin 5/6, c-Met expressions, and PTEN loss prognostic indicators in triple-negative breast cancer[J]. Med Oncol, 2014, 31(1):801.
[9] Raghav KP, Wang W, Liu S, et al. cMET and phospho-cMET protein levels in breast cancers and survival outcomes[J]. Clin Cancer Res, 2012, 18(8):2269-2277.
[10]Gastaldi S, Comoglio PM, Trusolino L. The Met oncogene and basal-like breast cancer: another culprit to watch out for?[J]. Breast Cancer Res, 2010, 12(4):208.
[11]冯炜红,张 斌,赵洪猛,等. C-MET抑制剂SGX523诱导乳腺癌MDA-MB-231细胞系的凋亡[J]. 中国肿瘤临床, 2012, 39(2):61-64
[12]Que W, Chen J. Knockdown of c-Met inhibits cell proliferation and invasion and increases chemosensitivity to doxorubicin in human multiple myeloma U266 cellsinvitro[J]. Mol Med Rep, 2011, 4(2):343-349.
[13]Shattuck DL, Miller JK, Carraway KL 3rd, et al. Met receptor contributes to trastuzumab resistance of Her2-overexpressing breast cancer cells[J]. Cancer Res, 2008, 68(5):1471-1477.
[14]陆海英,刘克剑,张 悦,等. 中药抗纤灵方含药血清对TGF-β1刺激的HK-2细胞c-Met及其下游MAPK信号分子的调控作用[J]. 中国病理生理杂志, 2010, 26(1):154-157.
[15]刘 苹,李 平,熊仁平,等. MTT法与BrdU ELISA法检测成纤维细胞增殖的可靠性比较[J]. 第三军医大学学报, 2006, 28(11):1262-1263.
Effects of c-Met on proliferation of triple negative breast cancer and sensitivity to doxorubicin
DENG Zhi-ping1,2, LIAO He-he1, WANG Zhou-quan1, YANG Bo1, SONG Zhang-jun1, YAO Jun-tao1, REN Hong1, ZHANG Ming-xin3
(1TheSecondDepartmentofThoracicSurgery,FirstAffiliatedHospitalofXi’anJiaotongUniversity,2DepartmentofBreastDisease,TumorHospitalofShaanxi,Xi’an710061,China;3TangduHospitalofTheFourthMilitaryMedicalUniversity,Xi’an710000,China.E-mail:lypdzp@163.com)
AIM: To investigate the effects of c-Met on the proliferation and the sensitivity to chemotherapeutic drugs of triple negative breast cancer cells. METHODS: Doxorubicin-resistant cells (MDA-MB-231/ADR) were established. The expression of c-Met at mRNA and protein levels in the MDA-MB-231/ADR cells and parental MDA-MB-231 cells was detected by real-time PCR and Western blotting. c-Met siRNA and plasmid or AKT siRNA were transfected into the cancer cells. The cell proliferation and the sensitivity to doxorubicin were determined by MTT assay. RESULTS: The expression of c-Met at mRNA and protein levels in MDA-MB-231/ADR cells was significantly higher than that in parental MDA-MB-231 cells. Transfection with pBABE-puro TPR-MET plasmid into the MDA-MB-231 cells induced cell proliferation and resistance to doxorubicin. Meanwhile, inhibition of c-Met in the MDA-MB-231/ADR cells by siRNA reversed the doxorubicin-resistance. In addition, over-expression of c-Met led to higher phosphorylation level of AKT, which was involved in the effects of c-Met on the MDA-MB-231 cell proliferation and doxorubicin-resistance. CONCLUSION: c-Met may have the potential as a therapeutic target in the treatment of triple negative breast cancer.
c-Met; Triple negative breast cancer; Cell proliferation; Doxorubicin; Drug resistantce
1000- 4718(2015)03- 0447- 05
2014- 10- 14
2014- 12- 05
国家自然科学基金资助项目(No. 81302055);陕西省自然科学基金资助项目(No. 2013JM4035)
△通讯作者 Tel: 029-85276159; E-mail:lypdzp@163.com
R363;R737.9
A
10.3969/j.issn.1000- 4718.2015.03.011
