促血小板生成素对化学性缺氧诱导的PC12细胞凋亡的影响*
2015-04-17王晓东陈美苑周卓妍
王晓东, 陈美苑, 曾 志, 周卓妍△, 杨 默
(暨南大学 1附属第一医院神经外科, 2医学院生理学系,广东 广州 510632; 3广东药学院生理学系,广东 广州 510006; 4南方医科大学南方医院血液科,广东 广州 510515)
促血小板生成素对化学性缺氧诱导的PC12细胞凋亡的影响*
王晓东1, 陈美苑2, 曾 志3, 周卓妍2△, 杨 默4
(暨南大学1附属第一医院神经外科,2医学院生理学系,广东 广州 510632;3广东药学院生理学系,广东 广州 510006;4南方医科大学南方医院血液科,广东 广州 510515)
目的: 研究促血小板生成素(TPO)对化学性缺氧诱导的大鼠嗜铬细胞瘤PC12细胞凋亡的影响及保护作用。方法: 将PC12细胞进行相应实验处理,分为对照组、氯化钴(CoCl2)处理组、CoCl2+TPO组及TPO对照组。检测各组PC12细胞的存活率并用Annexin V/PI双染流式细胞术分别检测细胞凋亡率,线粒体膜电位的变化及细胞内活性氧簇的变化。结果: 化学性缺氧模拟剂CoCl2可以明显抑制PC12细胞的生长(P<0.01);与对照组比较,CoCl2组的细胞凋亡率明显升高(P<0.05),而CoCl2+TPO组的细胞凋亡率显著低于CoCl2组(P<0.05);TPO能减少细胞内活性氧簇生成以及抑制细胞线粒体膜电位的降低(P<0.01)。结论: TPO能对抗CoCl2缺氧所致的细胞凋亡,稳定线粒体膜电位,发挥细胞保护作用。
促血小板生成素; 氯化钴; PC12细胞; 细胞缺氧; 细胞凋亡
缺血缺氧性脑损伤 (hypoxic-ischemic brain da-mage, HIBD)是临床常见的多种疾病的共同表现。严重的缺血缺氧可致神经元坏死,较轻的缺血缺氧则可通过凋亡途径造成神经元迟发性死亡,此反应在致病因素清除后仍可持续数天甚至数周。缺血缺氧导致的神经元迟发性死亡的病理生理机制很复杂,包括神经细胞能量代谢障碍、细胞内活性氧簇(reactive oxygen species,ROS)生成增加、线粒体能量供应受阻、线粒体的损伤和细胞内钙超载等,进而导致神经元迟发性死亡。
促血小板生成素(thrombopoietin,TPO)是体内重要的造血生长因子。以往的研究一直认为TPO的功能仅限于在造血系统,近年的深入研究发现其在造血系统以外也有作用。Yang等[1]首次证实中枢神经系统存在有TPO受体c-Mpl的表达。还发现TPO有促进小鼠神经干细胞株C17.2增殖和抗凋亡的作用[2]。本课题的前期研究中发现在新生大鼠缺血缺氧脑损伤模型中,早期使用TPO干预可对缺血缺氧性脑损伤造成的新生大鼠脑功能障碍起到改善作用,但机制不明[3]。本研究采用化学性缺氧模拟剂氯化钴(cobalt chloride,CoCl2)诱导PC12细胞缺氧,观察TPO对PC12细胞凋亡和线粒体膜电位的影响,为进一步探讨TPO在缺氧损伤的神经细胞中的保护作用提供实验依据。
材 料 和 方 法
1 细胞和主要试剂
大鼠嗜铬细胞瘤细胞株PC12由广州医科大学生理学教研室惠赠。PC12细胞培养于含10%胎牛血清、1×105U/L青霉素和100 mg/L链霉素的RPMI-1640培养基,在37 ℃、饱和湿度、5% CO2细胞培养箱内培养。用0.25%胰酶每2~3 d传代1次,第3代开始用于实验。
RPMI-1640液体培养基购自Gibco;胎牛血清购自杭州天杭生物科技公司;TPO由沈阳三生生物制药有限公司惠赠;CoCl2、胰蛋白酶、EDTA、二甲基亚砜(dimethyl sulfoxide, DMSO)和MTT均购自Sigma;青霉素和链霉素购自ICN Biomedicals;Annexin V/PI试剂盒、DCFH-DA和JC-1试剂盒购自凯基生物;PBS购自HyClone;其它生化试剂均为进口分装或国产分析纯。
2 方法
2.1 建立CoCl2损伤及TPO保护模型 根据CoCl2处理浓度(200、400、600、800、1 000 μmol/L)将PC12细胞共分为5组,每组处理时间为24 h。然后分别检测CoCl2对PC12细胞存活率的影响,确定合适的损伤浓度。之后,根据TPO保护浓度将PC12细胞分为25、50、100、200、400 μg/L TPO+CoCl2损伤组,每组处理48 h后检测TPO对CoCl2抑制PC12细胞存活率的影响,确定TPO保护的最佳浓度。
2.2 实验分组 本实验分组如下:(1)对照(control)组:用上述培养基培养,不加任何处理因素; (2)CoCl2组:加入500 μmol/L CoCl2到上述培养液中培养PC12细胞24 h;(3)CoCl2+TPO组:先加入500 μmol/L CoCl2处理PC12细胞24 h后,换成加入100 μg/L TPO培养液继续培养PC12细胞48 h;(4)TPO组:于上述培养液中加入100 μg/L TPO培养PC12细胞48 h。
2.3 MTT法检测细胞活力 取对数生长期细胞,接种于96孔板培养过夜后,更换为含有不同处理因素的培养基,处理结束后各组细胞分别加入MTT(5 g/L)20 μL,37 ℃温箱孵育3~4 h,离心弃上清,每孔加入150 μL DMSO,37 ℃温箱孵育10 min后用酶标仪检测各孔的吸光度(A)值(490 nm),按公式:细胞存活率(%)=处理组A值/对照组A值×100%,求出各组的存活率,重复3次。计算并评价细胞存活率。
2.4 AnnexinⅤ/PI双染法测定细胞凋亡率 各组细胞按实验分组要求给予不同的因素处理后,离心收集细胞,预冷PBS洗2次,离心弃上清,用100 μL 1× AnnexinⅤ binding buffer重悬,调整细胞浓度为106个,取100 μL于试管中,加入5 μL的Annexin V-FITC和1 μL 100 mg/L的PI工作液,室温避光反应15 min后加入400 μL的1×Annexin V binding buffer轻轻混匀,用流式细胞仪(Coulter)检测细胞的凋亡率。激发波长488 nm; 发射波长530 nm。每次检测均使用未经凋亡诱导处理的正常细胞作为对照,进行荧光补偿的调节。
2.5 线粒体膜电位测定 各组细胞按实验要求给予不同的因素处理后,离心收集细胞,用PBS洗涤细胞2次收集不多于1×106的细胞;取1× incubation buffer,混匀并预热至37 ℃;取500 μL的1× incubation buffer加入1 μL的JC-1,漩涡混匀配成JC-1工作液;取500 μL的JC-1工作液将细胞均匀悬浮,37 ℃、5%CO2的培养箱中孵育15~20 min;室温离心(2 000 r/min,5 min)收集细胞,用1× incubation buffer洗2次;吸取500 μL的1×incubation buffer重新悬浮细胞,上流式细胞仪检测。使用未经凋亡诱导处理的正常细胞作为阴性对照组和经凋亡诱导处理的凋亡细胞作为阳性对照组,进行荧光补偿和设门调节。设定细胞取样数为10 000个,Cell Quest软件分析结果。同时取上述处理好的细胞在荧光显微镜(Nikon)下观察拍照记录结果。
2.6 细胞内活性氧簇水平测定 将PC12细胞接种于6孔板后按照实验要求给予不同的因素处理,用无血清RPMI-1640培养液清洗2次。按照1∶1 000比例用无血清RPMI 1640培养液稀释DCFH-DA,使终浓度为10 μmol/L。去除细胞培养液,加入适当体积稀释好的DCFH-DA,于37 ℃细胞培养箱中避光孵育30 min,用无血清培养液充分清洗3次,以充分去除未进入细胞内的DCFH-DA,采用荧光显微镜(Nikon)观察、拍摄。
3 统计学处理
实验数据用均数±标准差(mean±SD)的方式表示。利用SPSS 13.0对实验数据进行单因素方差分析(one-way ANOVA);组间数据的两两比较采用Student-Newman-Keulsq检验。以P<0.05表示差异有统计学意义。
结 果
1 不同浓度CoCl2损伤对PC12细胞的毒性作用
在培养液中加入不同浓度的CoCl2(0、200、400、600、800、1 000 μmol/L)作用于PC12细胞24 h, MTT检测结果显示,CoCl2剂量依赖性地降低PC12细胞存活率。随着CoCl2作用浓度的逐渐增大,可以引起PC12细胞存活率明显降低,且呈明显的量效关系(P<0.01)。600 μmol/L CoCl2作用PC12细胞24 h后细胞存活率下降,而400 μmol/L CoCl2所引起PC12细胞存活率偏高,结合预实验结果,我们选择中间值500 μmol/L浓度的CoCl2作为损伤浓度,见图1A。
2 不同浓度TPO对抗CoCl2诱导的细胞毒性
为观察TPO对抗CoCl2诱导PC12细胞毒性的作用,应用500 μmol/L浓度的CoCl2处理PC12细胞后,在培养液中分别加入不同浓度的TPO(25、50、100、200、400 μg/L)作用48 h,观察TPO处理后对细胞存活率的影响。MTT检测结果显示,在25~100 μg/L的浓度范围内,TPO呈浓度依赖性地抑制CoCl2引起的细胞毒性作用,其中100 μg/L的TPO保护作用达到峰值(P<0.01),随着TPO浓度的升高,其保护效果逐渐减小。在后续实验中选择100 μg/L的TPO作用48 h作为对抗CoCl2抑制PC12细胞生长的保护模型,见图1B。

Figure 1.The effect of different concentrations of CoCl2 on the viability of PC12 cells (A) and the protective effect of different concentrations of TPO on the viability of PC12 cells after CoCl2 treatment (B). Mean±SD. n=3. *P<0.05, **P<0.01 vs control; #P<0.05 vs 500 μmol/L CoCl2+0 μg/L TPO.
3 AnnexinⅤ/PI双染法流式细胞术测定细胞凋亡率
用Annexin V/PI双染法流式细胞术检测各组不同处理的PC12细胞的凋亡情况,对照组和TPO组的凋亡率分别为6.13%和4.57%,CoCl2处理组的凋亡率显著增加,达到23.06%(P<0.05),CoCl2处理后再加用100 μg/L TPO 处理,其细胞凋亡率明显降低至9.32%(P<0.05),而100 μg/L的TPO本身不会引起PC12细胞的凋亡率改变,表明TPO有明显的抗CoCl2诱导的细胞凋亡作用,见图2。
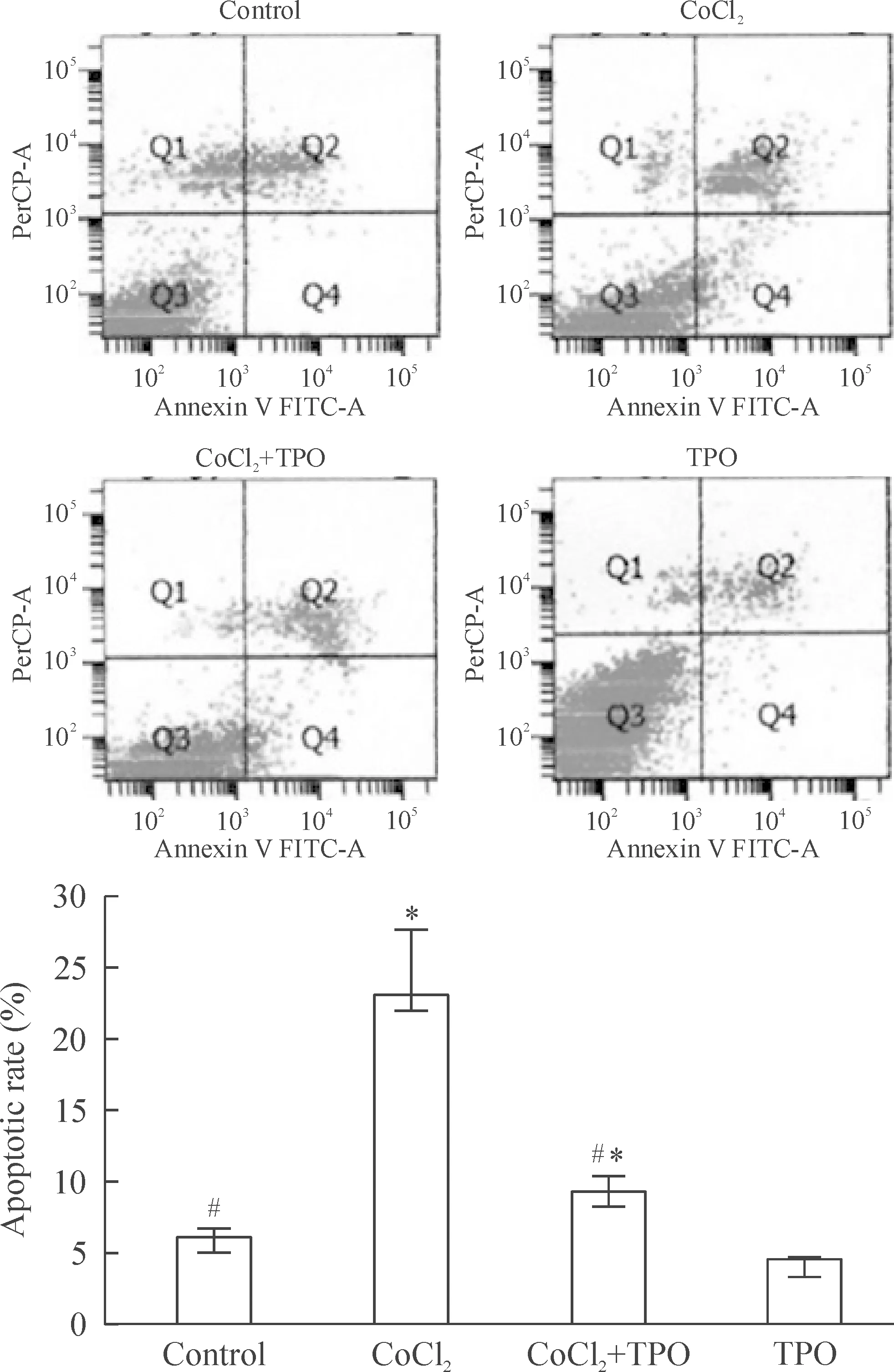
Figure 2.The effect of TPO on the CoCl2 induced apoptosis of PC12 cells by flow cytometry. Mean±SD. n=6. *P<0.05 vs control group; #P<0.05 vs CoCl2 group.
4 线粒体膜电位的改变
采用JC-1荧光染色法观察PC12细胞线粒体膜电位可见,对照组的PC12细胞在荧光显微镜下观察到为红色; TPO组也为红色;CoCl2组在荧光显微镜下观察到的PC12细胞为绿色; CoCl2+TPO 组PC12细胞在荧光显微镜下观察呈橙色。采用流式细胞术检测线粒体膜电位的变化。结果表明,PC12细胞在500 μmol/L CoCl2作用24 h后可见线粒体膜电位下降,比对照组及TPO组明显降低(P<0.01),TPO+ CoCl2能明显抑制CoCl2引起的线粒体膜电位降低(P<0.01),提示TPO对CoCl2引起的线粒体膜电位降低有抑制作用,见图3。

Figure 3.The effect of TPO on CoCl2-induced decrease in MMP in the PC12 cells. A: the images of JC-1 staining; B: the images of flow cytometry; C: quantitative analysis of the data of flow cytometry. Mean±SD. n=6. **P<0.01 vs control group; ## P<0.01 vs CoCl2 group.
5 不同处理对细胞内活性氧簇变化的影响
利用DCFH-DA检测PC12细胞内ROS的变化情况可见,ROS含量会随着胞内荧光强度的增强而增多。结果表明,PC12细胞在500 μmol/L CoCl2作用6 h后,荧光显微镜下观察发现与正常组比较细胞内荧光明显增强;而TPO+CoCl2组能降低CoCl2引起的细胞内ROS的生成(荧光明显减弱),而TPO单独作用不会引起胞内ROS水平的变化,见图4。
讨 论
TPO是重要的促血小板生成的造血生长因子,其蛋白结构和基因序列与促红细胞生成素(erythropoietin, EPO)有23%的同源性,与脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)有36%的高度同源性。目前已有大量的体内外实验证实EPO对神经细胞和心肌细胞具有保护作用[4]。我们课题组在过往的研究中也证实EPO有良好的神经保护作用,能稳定神经元胞膜,减少神经元的坏死和抗细胞凋亡[5]。TPO是否也具有相似的神经细胞保护功能?其作用机制是什么?研究表明TPO在体内与其受体(c-Mpl)结合后可通过数条细胞内信号转导通路(如JAK-STAT通路、 MAPK通路和PI3K/Akt 通路)来调节和影响细胞的增殖、成熟和凋亡。而体内多种细胞中已发现存在c-Mpl,如中枢神经系统各部位中已证明有c-Mpl的广泛表达[2,6],体外研究表明TPO可以通过激活PI3K/Akt 这一通路来对抗无血清诱导C17.2细胞株的凋亡和促进细胞生长,发挥细胞保护作用[7-8]。本课题组也在新生大鼠缺血缺氧脑损伤模型的动物体内实验中发现,在缺血缺氧早期使用TPO可以对缺血缺氧性脑损伤造成新生大鼠脑功能障碍起到治疗和改善作用,减轻缺血缺氧对脑部发育的影响[3]。另有研究也发现在大脑中动脉梗塞的成年大鼠模型中,TPO可明显减小皮层梗塞面积,改善感觉-运动神经功能[9]。
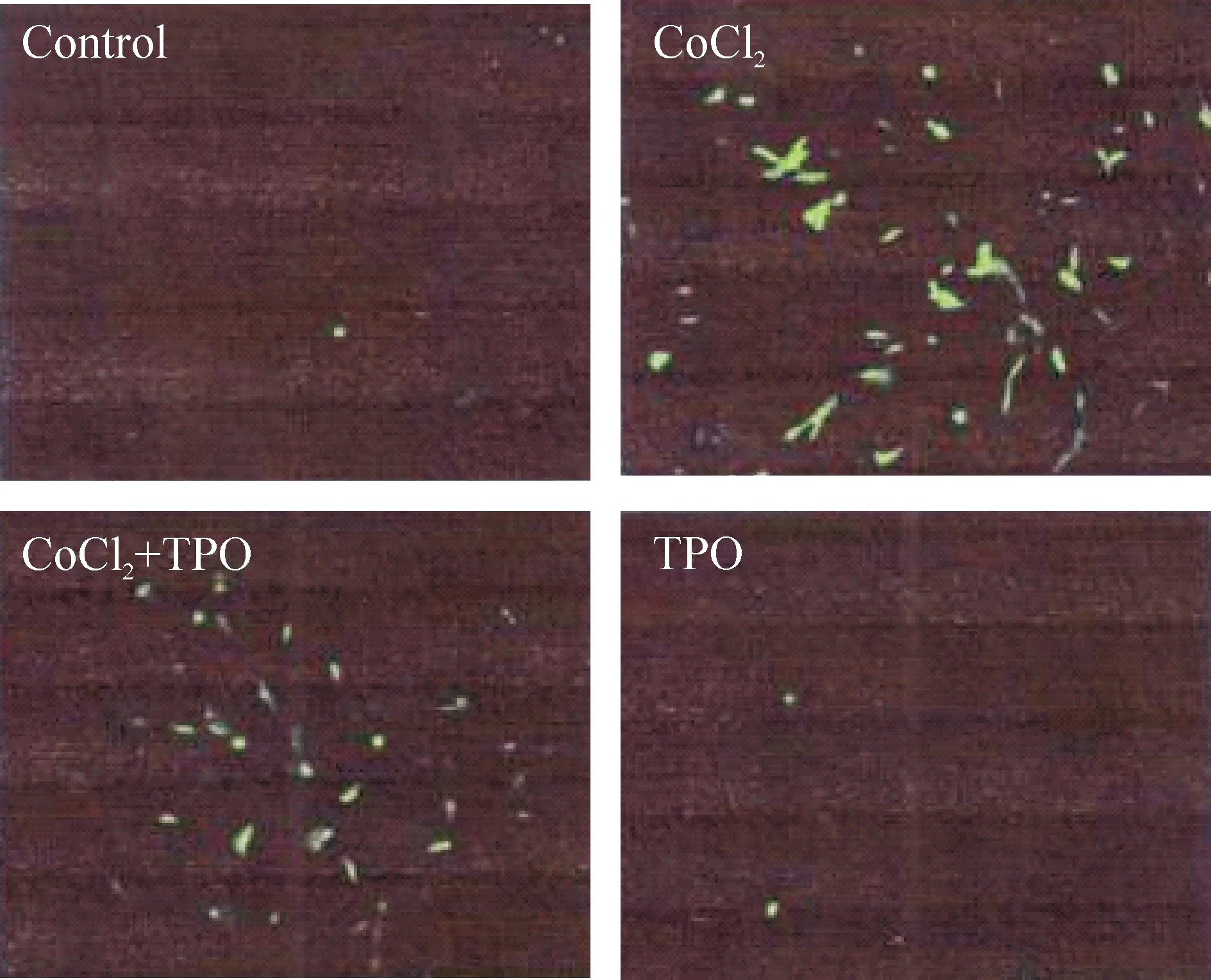
Figure 4.The inhibitory effect of TPO on CoCl2 -induced increase in intracellular reactive oxygen species (ROS) in the PC12 cells (DCFH-DA staining, ×200).
CoCl2是一种化学性低氧模拟剂,在体外培养的多种细胞中能模拟低氧/缺血状况,CoCl2可增加细胞内ROS的生成,导致线粒体膜电位降低,进而引起细胞凋亡[10-11]。本研究结果也表明加入500 μmol/L CoCl2培养PC12细胞24 h后,该组细胞存活率下降,细胞内ROS生成增加,线粒体膜电位降低,出现凋亡的细胞数量明显增加,与上述报道相符。目前研究认为,CoCl2诱导的神经细胞损伤与丝裂原激活蛋白激酶(mitogen-activated protein kinases,MAPK)通路有关,该家族成员有p38 MAPK、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)等。该信号转导通路存在于大多数细胞内,在细胞转化及凋亡等过程中具有至关重要的作用。有研究表明,化学性缺氧引起的神经元损伤由p38 MAPK通路介导[10],JNK通路活化也参与化学性缺氧引起的神经损伤[11],研究发现CoCl2能上调PC12细胞磷酸化ERK1/2蛋白的表达,而ROS清除剂N-乙酰半胱氨酸预处理1 h可明显拮抗CoCl2对p-ERK1/2表达的上调作用,提示CoCl2可导致细胞内ROS的大量堆积,ROS进而参与CoCl2对PC12细胞ERK1/2通路的激活作用。ERK1/2通路活化是化学性低氧剂(CoCl2)引起的细胞毒性、线粒体损伤及致凋亡作用的可能机制,并与p38MAPK通路存在相互激活的协同作用[12]。在缺氧/复氧诱导的大鼠原代皮层神经元凋亡的研究中也发现JNK蛋白磷酸化水平的升高与神经元凋亡率升高有关[13]。本研究结果表明,TPO能减轻CoCl2对PC12细胞的损伤作用,在先加入500 μmol/L CoCl2处理PC12细胞24h后,换成加入100 μg/L TPO培养液继续培养PC12细胞48 h,发现该组细胞存活率上升,细胞内ROS生成减少,线粒体膜电位降低减少,出现凋亡的细胞数量明显减少,该结果提示TPO对抗CoCl2诱导PC12细胞损伤的作用机制可能与其在与受体(c-Mpl)结合后通过MAPK信号转导通路介导的效应有关,推测TPO能抑制p38MAPK通路,抑制JNK蛋白磷酸化,使ERK1/2通路去活化,阻止细胞凋亡的发生。
神经细胞能量几乎完全来源于线粒体氧化磷酸化供能,故其对缺血缺氧极其敏感。线粒体跨膜电位的维持是其功能得以正常进行的前提条件。而线粒体内、外膜交界处的线粒体膜通透性转换孔可受多种细胞死亡信号如 Ca2+超载、氧化应激等的作用而开放[14],使线粒体膜电位无法维持,呼吸链断裂。线粒体膜通透性的改变还能使线粒体基质Ca2+释放,促凋亡因子(如细胞色素C)外漏到胞浆,进而启动凋亡蛋白酶依赖及非凋亡蛋白依赖细胞凋亡途径,引起细胞凋亡和死亡[15]。本研究结果显示:采用JC-1荧光染色法观察PC12细胞线粒体膜电位可见,对照组和TPO组的PC12细胞在荧光显微镜下观察到均为红色;表明这2组细胞线粒体膜电位水平较高,此时JC-1荧光染料形成聚合物,发出红色的荧光;而 CoCl2组在荧光显微镜下观察到的PC12细胞为绿色;表明CoCl2导致该组细胞线粒体膜电位水平降低,JC-1荧光染料以单体形式存在,发出绿色的荧光;在CoCl2+TPO 组PC12细胞在荧光显微镜下观察呈橙色,表明TPO能明显改善该组细胞线粒体膜电位的丢失,JC-1荧光染料大部分以聚合体形式存在,少数以单体形式存在,发出橙色的荧光。线粒体跨膜电位的下降,被认为是细胞凋亡级联反应过程中最早发生的事件,它发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前,一旦线粒体膜电位不能维持,则细胞凋亡就不可逆转。而TPO在与其受体(c-Mpl)结合后可通过数条细胞内信号转导通路(如JAK-STAT通路、 MAPK通路和PI3K/Akt 通路)来调节和改变下游信号分子的活性,稳定线粒体膜通透性转换孔,维持线粒体膜的通透性,进而维持线粒体膜电位的稳定,减少线粒体释放促凋亡因子来对抗CoCl2诱导的细胞凋亡,发挥保护细胞的作用。
TPO在促血小板生成等造血系统外表现出的神经保护作用,表明其作用的多样性,不可忽视。在脑出血和脑血管意外等疾病的治疗中,TPO可能是比EPO副作用更小、更有效的治疗药物。进一步研究TPO神经保护的机制和有效剂量,对临床上缺血缺氧性脑损伤治疗有重要的意义。
[1] Yang M, Xia WJ, Li KKH, et al. TPO has neural rege-neration effect[J]. Blood, 2003, 102(11):393B.
[2] Yang M, Xia WJ, Li K, et al. Identification of TPO receptors on central nervous system: a preliminary report[J]. Chin J Exp Hematol, 2004, 12(4):494-497.
[3] 陈美苑,刘 青,曾 志,等. TPO对新生大鼠缺氧缺血性脑损伤的保护作用[J]. 暨南大学学报, 2014, 35(1):37-44.
[4] 罗林杰,李江华,董少红,等. H2O2对大鼠骨骼肌卫星细胞凋亡和线粒体膜电位的影响及EPO 的保护作用[J]. 中国病理生理杂志, 2010,26(2):357-361.
[5] 刘 青, 曾 志, 周卓妍, 等. EPO对新生大鼠缺氧缺血性脑损伤NSE表达的影响[J]. 暨南大学学报, 2011, 32(6): 593-597.
[6] Ivanova A, Wuerfel J, Zhang J, et al. Expression pattern of the thrombopoietin receptor (Mpl) in the murine central nervous system[J]. BMC Dev Biol, 2010, 10:77.
[7] 夏文杰,项 鹏,杨 默,等. 血小板生成素thrombo-poietin对神经保护作用的体外研究[J]. 热带医学杂志, 2007, 7(7): 622-625.
[8] Nakao T, Geddis AE, Fox NE, et al. PI3K/Akt/FOXO3a pathway contributes to thrombopoietin-induced proliferation of primary megakaryocytesinvitroandinvivovia modulation of p27Kip1[J]. Cell Cycle, 2008, 7( 2):257-266.
[9] Zhou J, Li J, Rosenbaum DM, et al. Thrombopoietin protects the brain and improves sensorimotor functions: reduction of stroke-induced MMP-9 upregulation and blood-brain barrier injury[J]. J Cerebral Blood Flow Metab, 2011, 31(3):924-933.
[10]Lan AP, Mei WY, Meng JL, et al. Hydrogen sulfide protects PC12 cells against chemical hypoxia-induced injury by inhibiting p38 MAPK [J]. Chin Pharmacol Bull, 2010, 26(10):1339-1344.
[11]Lan AP, Mo LQ, Zheng DD, et al. JNK-mediated chemical hypoxia-induced PC12 cell injury[J]. Chin Pharmacol Bull, 2012, 28(1):62-64.
[12]徐文明,兰爱平,林建聪,等. 活性氧激活的ERK1/2通路在化学性缺氧损伤PC12细胞中的作用[J]. 中国药理学通报, 2013, 29(7):985-990.
[13]赵严冬,刘潘虹,李学敏, 等. 远志皂苷元抗诱导皮层神经元凋亡的机制初探[J]. 中国病理生理杂志, 2014,30(7):1166-1171.
[14]Kroemer G. The mitochondrial permeability transition pore complex as a pharmacological target: an introduction[J]. Curt Med Chem, 2003, 10(16):1469-1472.
[15]Sanderson TH, Reynolds CA, Kumar A, et al. Molecular mechanisms of ischemia-reperfusion injury in brain: pivo-tal role of the mitochondrial membrane potential in reactive oxygen species generation [J]. Mol Neurobiol, 2013, 47(1): 9-23.
Effect of thrombopoietin on chemical hypoxia-induced apoptosis of PC12 cells
WANG Xiao-dong1, CHEN Mei-yuan2, ZENG Zhi3, ZHOU Zhuo-yan2, YANG Mo4
(1DepartmentofNeurosurgery,TheFirstAffiliatedHospital,2DepartmentofPhysiology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China;3DepartmentofPhysiology,GuangdongPharmaceuticalUniversity,Guangzhou510006,China;4DepartmentofHematology,NanfangHospital,SouthernMedicalUniversity,Guangzhou510515,China.E-mail:zhuoyanzhou@126.com)
AIM: To study the effect of thrombopoietin (TPO) on chemical hypoxia-induced apoptosis of theRattusnorvegicusadrenal pheochromocytoma (PC12) cells. METHODS: The cultured PC12 cells were randomly divided into normal control group, cobalt chloride (CoCl2) group, CoCl2+TPO group and TPO group. The cell viability was mea-sured by MTT assay. The effect of TPO on CoCl2-induced cell apoptosis was analyzed by flow cytometry with Annexin V/PI double staining. The intracellular reactive oxygen species (ROS) were detected by fluorescence microscopy, and the changes of the mitochondrial membrane potential (MMT) were determined by flow cytometry and fluorescence microscopy. RESULTS: Chemical oxygen agent CoCl2significantly inhibited the growth of PC12 cells (P<0.01). The apoptotic rate in CoCl2group was obviously higher than that in control group (P<0.05), while the apoptotic rate in CoCl2+TPO group was obviously lower than that in CoCl2group (P<0.05). TPO decreased the production of ROS, and inhibited the decrease in MMP induced by CoCl2(P<0.01). CONCLUSION: TPO has a protective effect against CoCl2-induced apoptosis of PC12 cells by decreasing the production of ROS and inhibiting the decrease in MMP.
Thrombopoietin; Cobalt chloride; PC12 cells; Cell hypoxia; Cell apoptosis
1000- 4718(2015)03- 0409- 06
2014- 10 -22
2015- 01- 26
国家自然科学基金资助项目(No.81270580)
△通讯作者 Tel: 020-85220260; E-mail: zhuoyanzhou@126.com
R363.2; R338.1
A
10.3969/j.issn.1000- 4718.2015.03.005
