氧葡萄糖剥夺-再恢复后抑制小胶质细胞TLR9激活对神经元的保护作用*
2015-04-17彭晴霞杨碧莹潘经锐王鸿轩黎祥喷王艺东
彭晴霞, 杨碧莹, 潘经锐, 王鸿轩, 黎祥喷, 王艺东△
(1中山大学孙逸仙纪念医院神经科, 2广东省中医院神经四科,广东 广州 510120)
氧葡萄糖剥夺-再恢复后抑制小胶质细胞TLR9激活对神经元的保护作用*
彭晴霞1, 杨碧莹2, 潘经锐1, 王鸿轩1, 黎祥喷1, 王艺东1△
(1中山大学孙逸仙纪念医院神经科,2广东省中医院神经四科,广东 广州 510120)
目的: 观察氧葡萄糖剥夺-再恢复(OGDR)后小胶质细胞BV-2 Toll 样受体9(TLR9)激活对神经元凋亡的影响。方法: 对BV-2细胞或TLR9-siRNA转染的BV-2细胞进行OGDR处理4 h后,将细胞上清添加至OGDR处理4 h的小鼠原代皮层神经元中,继续正常培养24 h后,倒置显微镜下观察神经元形态变化,TUNEL染色检测神经元凋亡,Western blotting 检测神经元caspase-3蛋白的表达。实验分为正常BV-2组、negative control-siRNA组、TLR9-siRNA组、OGDR组、OGDR+NC-siRNA组、OGDR+TLR9-siRNA组和对照组(神经元OGDR后不添加BV-2细胞上清)。结果: OGDR后神经元胞体肿胀,折光性下降,出现空泡样变,轴突变细、扭曲、断裂。TUNEL染色各组均可见绿染凋亡小体。与对照组比较,其它组的caspase-3蛋白表达升高(P<0.05);与正常BV-2组比较,OGDR组和TLR9-siRNA组的caspase-3蛋白表达升高(P<0.05);OGDR+TLR9-siRNA转染组与TLR9-siRNA转染组和OGDR组比较,caspase-3蛋白表达下降(P<0.05)。结论: OGDR后BV-2细胞TLR9激活致神经元凋亡增多,caspase-3蛋白表达升高;抑制TLR9表达后,神经元损伤减轻。
氧葡萄糖剥夺-再恢复; 小胶质细胞; 神经元; Toll 样受体9
Toll样受体(Toll-like receptors, TLRs)是先天免疫系统的重要组成部分,在启动机体的炎症反应中起着重要作用[1]。脑缺血再灌注损伤中炎症反应占据重要地位。近年来的研究发现TLR2和TLR4表达上调与脑缺血的严重性相关,基因敲除动物的脑缺血转归更好[2]。我们在前期研究中观察到,脑梗死小鼠梗死灶外周组织TLR9选择性地在小胶质细胞内激活[3],氧葡萄糖剥夺-再恢复(oxygen-glucose deprivation/reoxygenation,OGDR)后小胶质细胞(BV-2细胞)的TLR9表达增加[4]。脑缺血再灌注后小胶质细胞TLR9的激活是否对神经元产生作用,影响缺血组织的转归,目前还未见研究报道。本研究采用 OGDR模型在体外模拟脑缺血/再灌注的体内过程,用小鼠BV-2小胶质细胞、原代皮层神经元作为体外研究小胶质细胞、神经元的细胞体系,将经OGDR处理和TLR9基因沉默后的BV-2细胞上清加入经OGDR处理的神经元中,观察神经元凋亡的变化,以阐明小胶质细胞TLR9激活对神经元的作用。
材 料 和 方 法
1 材料
BV-2细胞由中山大学孙逸仙纪念医院唐亚梅研究员馈赠;C57新生24 h小鼠购自中山大学东校区动物中心。
DMEM/F12培养基、胎牛血清、0.25 %胰酶、神经元Neurobasal培养基、B27、小鼠神经元特异性烯醇化酶(neuron-specific enolase,NSE)抗体(Abcam);594驴抗兔Ⅱ抗(Jackson);X-tremeGENE siRNA转染试剂(Roche); BCA蛋白浓度测定试剂盒(武汉博士德公司);小鼠cleaved caspase-3蛋白单克隆抗体和GAPDH蛋白单克隆抗体(CST);TUNEL 试剂盒(Merck)。TLR9 siRNA序列由上海吉玛公司设计合成。
细胞培养箱(Heraus);细胞缺氧培养箱(New Brunswick Scientiflc);倒置相差显微镜(Nikon);多功能酶标仪(Labsystems); PAC200型电泳电源、垂直电泳槽、水浴式电转印迹装置(Bio-Rad);凝胶成像分析系统(Syngene)。
2 实验方法
2.1 BV-2细胞培养 BV-2细胞接种于含10% 胎牛血清的DMEM/F12培养液,置于37 ℃、5% CO2的细胞培养箱中培养。0.25%胰酶消化传代,3~5 d传代1次。至细胞生长良好时开始实验。用于实验的细胞代数为5~15代。
2.2 原代大脑皮层神经元分离培养与鉴定 将新生(24 h内)C57小鼠,在无菌条件下将小鼠断头,取脑,仔细剥除脑膜,将皮质剪成小块,用0.125%胰酶消化,并加入少量DNase Ⅰ,用含10%血清的DMEM/F12培养液终止消化,反复吹打细胞悬液。将细胞悬液分别过200目及400目细胞筛,加入含10%血清的神经元培养基(neurobasal+2% B27+1% 谷氨酰胺)重悬细胞,细胞计数,调整细胞密度为5×108/m2,接种于预先用L-多聚赖氨酸包被的孔板中,置于37 °C、5% CO2培养箱中。4 h后待细胞贴壁后更换为不含血清的神经元培养基,之后隔3 d半量换液。待神经元细胞生长5~7 d后,进行免疫荧光技术鉴定,NSE 抗体(1∶200)标记神经元,显微镜下观察,计算神经元细胞阳性率。
2.3 实验分组 按添加至经OGD处理4 h的神经元中的BV-2细胞培养上清液的不同分为6组:(1)正常BV-2组:BV-2细胞正常培养后的上清液;(2)NC-siRNA组:BV-2细胞转染 negative control siRNA(NC-siRNA)并培养24 h的上清液;(3)TLR9-siRNA组:BV-2细胞转染TLR9-siRNA并培养24 h的上清液;(4)OGDR组:BV-2细胞OGD 4 h并复氧培养24 h的上清液;(5)OGDR+NC-siRNA组:BV-2细胞OGD 4 h并转染NC-siRNA复氧培养24 h的上清液;(6)OGDR+TLR9-siRNA组:BV-2细胞OGD 4 h并转染TLR9-siRNA复氧培养24 h的上清液。此外,另设1组神经元对照组,不添加BV-2细胞上清。
2.4 OGDR处理BV-2细胞和原代皮层神经元 把BV-2细胞以合适密度分别接种于6孔板,待其生长至60~70%,将正常培养基换成EBSS平衡盐溶液,置于缺氧培养箱中,37 °C、5% CO2、1% O2培养4 h。OGDR组BV-2细胞OGD 4 h后从缺氧培养箱中取出细胞,更换成正常培养基,恢复正常条件继续培养24 h。OGDR+NC-siRNA组、OGDR+TLR9-siRNA组BV-2细胞于OGD结束后更换成正常培养基同时加入已混匀的转染复合物。
神经元原代培养7 d后,将正常培养基换成DMEM无糖培养基,置于缺氧培养箱中,37 °C、5% CO2、1% O2培养4 h,复氧并分别添加(1)~(6)组BV-2细胞上清,神经元对照组作为对照组不添加BV-2细胞上清,继续培养24 h后行TUNEL和Western blotting检测。
2.5 BV-2细胞的TLR9基因沉默 取对数生长期的BV-2细胞,接种于6孔板, 加入不含抗生素的完全培养基培养24 h, 使细胞生长稳定并达到30%~50%的细胞贴壁融合。根据前期研究的结果[5],选取对BV-2细胞TLR9表达抑制效果最大的siRNA-1549序列作为本实验的TLR9干扰序列。参照X-tremeGENE siRNA转染试剂说明书,将转染试剂分别与相应剂量TLR9-siRNA、NC-siRNA混匀形成转染复合物,将转染复合物200 μL加入6孔板,与2 mL细胞培养基混匀后放入细胞培养箱中培养。采用实时荧光定量PCR检测siRNA干扰效率。干扰序列:siRNA-1549上游 5’-GGAACAACCUGGUGACUAUTT-3’,下游 5’-AUAGUCACCAGGUUGUUCCTT-3’);NC-siRNA 上游 5’-UUCUCCGAACGUGUCACGUTT-3’,下游 5’-ACGUGACACGUUCGGAGAATT-3’。
2.6 TUNEL法检测神经元凋亡 各组神经元经上述处理24 h取样,采用TUNEL试剂盒,参照说明书操作。荧光显微镜下观察,比较凋亡小体(绿染)与总细胞数,计算细胞凋亡率,比较各组差异。
2.7 Western blotting 检测神经元cleaved caspase-3蛋白的水平 各组神经元经上述处理24 h后提取总蛋白,BCA法测定蛋白浓度,以GAPDH为内参照,12% SDS-PAGE分离蛋白后,电转法将目的蛋白转移到PVDF膜上,脱脂奶粉封闭1 h ,分别加入I抗(1∶1 000 cleaved caspase-3抗体,1∶1 000 GAPDH抗体),4 °C孵育过夜,TBST洗膜3次,加入II抗(1∶5 000)室温孵育1 h,TBST洗膜3次,化学发光法显色。采用Quantity One分析软件对目的蛋白条带与GAPDH灰度值的比值进行统计分析。
3 统计学处理
计量数据以均数±标准差(mean±SD)表示。组间比较采用单因素方差分析,进一步采用LSD法两两比较。部分不符合正态性、方差齐性数据采用校正t检验或秩和检验。用SPSS 13.0软件分析。以P<0.05为差异有统计学意义。
结 果
1 原代神经元分离培养细胞形态
1.1 形态学观察 倒置显微镜下可见分离培养的小鼠大脑皮层神经元分散种植,6 h细胞贴壁,呈圆形或椭圆;24 h可见神经元细胞突起;48 h细胞变成锥形或梭形;72 h神经元胞体变大,突起变长,与邻近神经元胞体或突起连接,形成网络;7 d神经元胞体增大,突起增多变长,见图1。
1.2 免疫荧光鉴定 神经元培养5~7 d后荧光显微镜下可见NSE标记阳性神经元细胞胞体及轴突均染成红色(图1),阳性率在96%以上。
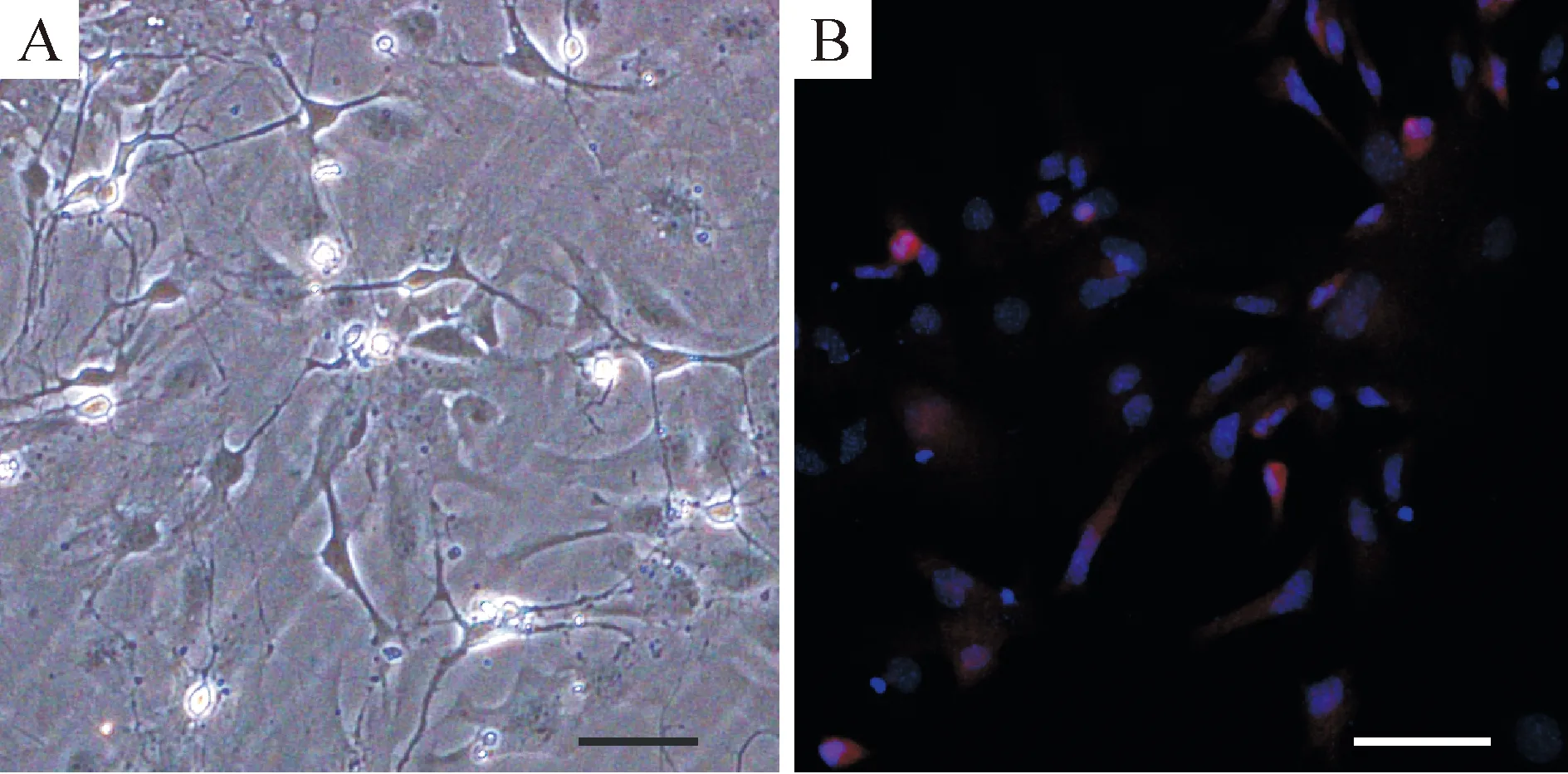
Figure 1.A: morphological image of the cultured neurons from the brain cortex of newborn C57 mice; B: the neurons were stained with neuron-specific enolase (red) and nuclei were counterstained with DAPI (blue). The scale bar=50 μm.
1.3 OGDR后BV-2细胞和原代神经元的形态变化 正常培养BV-2细胞单层生长,细胞体呈细长或椭圆,从胞体发出细长而有分支的突起,表面有许多小棘突,胞体饱满,细胞间相互交织成簇状,处于静止状态。OGD 4 h恢复正常培养前(即OGDR 0 h),细胞数量减少,贴壁细胞变小、变圆,部分细胞皱缩,细胞突触消失,细胞之间连接消失; OGDR 24 h,细胞体变为椭圆,分支变细长,细胞分裂,数量变多,见图2。
神经元OGDR 0 h部分神经元胞体皱缩,折光性下降,出现空泡样变,轴突变细、扭曲、断裂。OGDR 24 h大部分神经元肿胀、胞膜破裂、折光性消失、胞核固缩碎裂、轴突变细变短断裂,见图2。
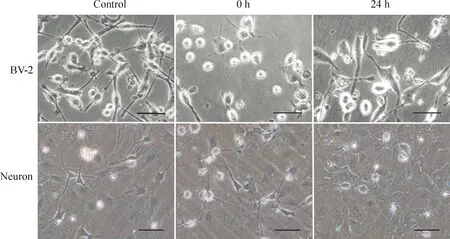
Figure 2.The morphologic changes of BV-2 cells and primary neurons after OGDR. The scale bar=50 μm.
2 BV-2细胞TLR9基因沉默效果
经序列siRNA-1549和NC-siRNA处理24 h, BV-2细胞TLR9的mRNA相对表达水平分别为0.22±0.05和0.95±0.04,使TLR9 mRNA表达于24 h降低77.89%(P<0.05),而NC-siRNA与对照组无统计学差异,说明TLR9-siRNA能有效抑制TLR9基因的表达。
3 神经元凋亡检测结果
荧光显微镜下可见,神经元对照组外的其余6组NSE染色显示大部分神经元胞体边界不清,轴突消失,周围大片红色淡染,与DAPI分布一致,极少数神经元仍保留正常结构;神经元对照组NSE染色更淡, 可见部分DAPI染色核碎裂。TUNEL染色各组均可见绿染凋亡小体。7组凋亡率分别为3.27%、14.23%、18.93%、11.50%、8.17%、6.73%和1.00%,各组间比较差异均有统计学意义(P<0.05),见图3。

Figure 3.The neurons were stained with neuron-specific enolase (NSE, red), nuclei were counterstained with DAPI (blue) and apoptosis were detected by TUNEL (green). The scale bar=50 μm.
4 神经元cleaved caspase-3蛋白表达的变化
与神经元对照组比较,其余6组cleaved caspase-3蛋白水平均增高(P<0.05)。NC-siRNA组clcaved caspase-3蛋白水平较正常BV-2组增高(P<0.05),与TLR9-siRNA组比较无明显变化(P>0.05)。OGDR组cleaved caspase-3蛋白水平较正常BV-2组增高(P<0.05),与OGDR+NC-siRNA组比较无明显变化(P>0.05)。与OGDR+TLR9-siRNA组比较,TLR9-siRNA组、OGDR组和OGDR+NC-siRNA组cleaved caspase-3蛋白水平均增高(P<0.05),见图4。
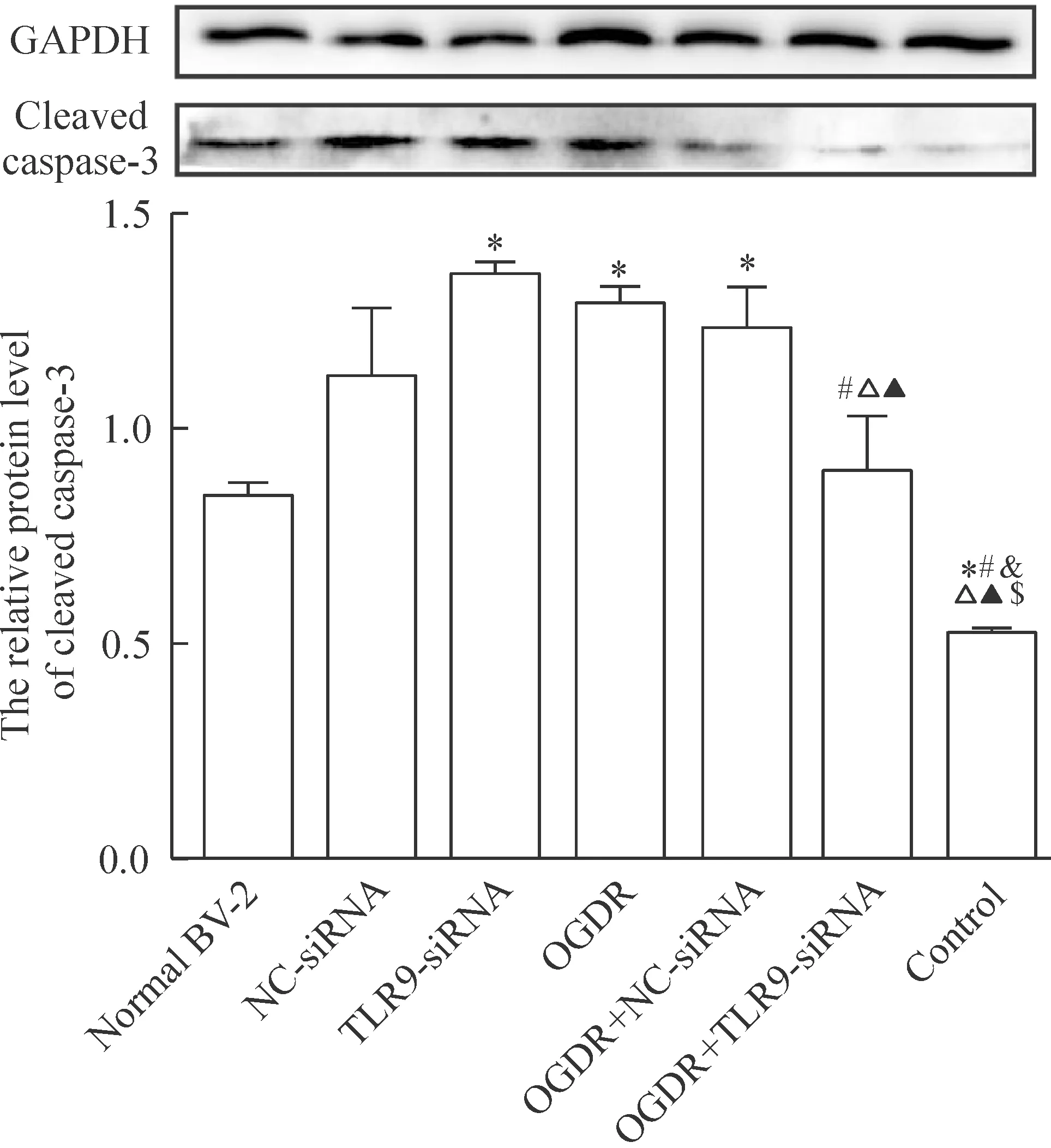
Figure 4.The protein level of cleaved caspase-3 in the neurons with different treatments determined by Western blotting. Mean±SD. n=3. *P<0.05 vs normal BV-2 group; &P<0.05 vs NC-siRNA group; #P<0.05 vs TLR9-siRNA group; △P<0.05 vs OGDR group; ▲P<0.05 vs OGDR+NC-siRNA group; $P<0.05 vs OGDR+TLR9-siRNA group.
讨 论
在既往的体内外实验中,我们已发现脑缺血再灌注或OGDR后小胶质细胞TLR9被激活[3-4]。本研究采用RNA干扰技术,观察到OGDR后小胶质细胞TLR9基因沉默能减轻神经元凋亡,降低神经元caspase-3蛋白的表达。
为了明确小胶质细胞TLR9激活对神经元存活的作用,避免神经细胞间的相互作用对结果的影响,本研究对小胶质细胞和神经元分别进行培养。OGD 4 h后神经元呈缺血缺氧性损伤改变,恢复氧葡萄糖供应24 h后神经元损伤部分恢复,出现凋亡。而加入不同处理的BV-2细胞上清后,神经元损伤均加重,凋亡率增加,cleaved caspase-3蛋白水平上调。说明BV-2细胞分泌的物质对神经元产生损伤。其中OGDR组比正常BV-2组神经元损伤更为严重,表明OGDR处理可促使BV-2细胞分泌更多的有害物质。对OGDR处理的BV-2细胞TLR9进行RNA干扰后,神经元的凋亡率降低,cleaved caspase-3蛋白水平上调被抑制。这些结果进一步说明OGDR后BV-2细胞TLR9的激活可能是导致神经元损伤的一个重要原因。
TLR9作为TLRs家族中是唯一识别DNA的成员,位于胞浆的内质网膜上,细胞激活后,TLR9被传递至内吞溶酶体,并于此处启动配体识别和后续的信号转导[6-7]。TLR9的配体为含非甲基化胞嘧啶-磷酸-鸟嘌呤(CpG)二核苷酸序列的DNA[cy-tosinephosphate-guanine-containing oligodeoxynucleotide (ODN)-DNA, CpG-DNA]。TLR9被激活后,可通过转录因子核因子κB(nuclear factor kappa B, NF-κB)或干扰素调节因子7(interferon regulatory factor 7,IRF7)途径,诱导促炎症因子肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)或细胞保护因子干扰素β(interferon β,IFN-β)等的产生,在炎症免疫反应中发挥重要作用[8-9]。在另一体外实验中,我们观察到OGDR后BV-2细胞TLR9、NF-κB(p-p65)、p-IRF-7、TNF-α和IL-1β蛋白表达上调,而NF-κB(p65)、IRF-7和IFN-β蛋白表达无显著变化。这些结果表明OGDR后小胶质细胞TLR9信号通路的活化以促炎途径为主。本研究发现OGDR后小胶质细胞TLR9基因沉默能减轻神经元的损伤,其机制可能为抑制了TLR9的下游炎症因子的分泌。
本实验中单纯TLR9-siRNA转染组细胞上清处理后神经元的cleaved caspase-3蛋白水平反而较其余各组升高,凋亡增加,原因可能与上述TLR9能介导促炎症和细胞保护2条信号通路有关。既往研究显示,给予细胞TLR9配体CpG-DNA的预处理,诱导适当细胞因子的产生和炎症反应可使神经元缺血再灌注损伤减少[10-11]。而单纯沉默TLR9后,此种神经保护作用可能消失,反而加重了神经元的凋亡。OGDR+TLR9-siRNA组较OGDR组神经元凋亡减少,OGD处理与预处理不同,可能诱导TLR9参加促炎症因子而加重神经元损伤,抑制TLR9可减轻神经元损伤。此外,正常BV-2组与NC-siRNA转染组、OGDR组与 OGDR+NC-siRNA组之间的cleave caspase-3蛋白水平差异无统计学意义,说明本实验中转染操作本身并不增加对神经元的损伤,排除了转染因素对实验结果的影响。
综上所述,本研究模拟脑缺血再灌注的体内过程,通过体外实验发现小胶质细胞TLR9的激活加重神经元的缺血缺氧损伤,而沉默TLR9基因对神经元起保护作用。进一步的研究还需明确小胶质细胞TLR9的激活加重神经元损伤的机制。
[1] Gesuete R, Kohama SG, Stenzel-Poore MP. Toll-like receptors and ischemic brain injury[J]. J Neuropathol Exp Neurol, 2014, 73(5):378-386.
[2] Wang YC, Lin S, Yang QW. Toll-like receptors in cerebral ischemic inflammatory injury[J]. J Neuroinflammation, 2011, 8:134.
[3] 纪 原,杨碧莹,黄小雄,等.小鼠脑梗死后小胶质细胞内Toll样受体9选择性上调[J]. 中国病理生理杂志, 2014, 30(1):110-116.
[4] 杨碧莹,马珊珊,潘经锐,等. 氧葡萄糖剥夺-再恢复小鼠小胶质细胞的激活及Toll 样受体9表达的变化[J]. 中国脑血管病杂志,2013, 10(2):84-88.
[5] 杨碧莹,彭晴霞,潘经锐,等. 有效抑制小鼠小胶质细胞上Toll样受休9表达的siRNA的筛选[J]. 中华脑科疾病与康复杂志:电子版,2014, 4(6): 386-390.
[6] Latz E, Schoenemeyer A, Visintin A, et al. TLR9 signals after translocating from the ER to CpG DNA in the lysosome[J]. Nat Immunol, 2004, 5(2):190-198.
[7] Fukui R, Saitoh S, Matsumoto F, et al. Unc93B1 biases Toll-like receptor responses to nucleic acid in dendritic cells toward DNA- but against RNA-sensing[J]. J Exp Med, 2009, 206(6):1339-1350.
[8] Marsh BJ,Williams-Karnesky RL,Stenzel-Poore MP. Toll-like receptor signaling in endogenous neuroprotection and stroke[J]. Neuroscience, 2009, 158(3): 1007-1020.
[9] Downes CE, Crack PJ. Neural injury following stroke:are Toll-like receptors the link between the immune system and the CNS?[J]. Br J Pharmacol, 2010, 160(8):1872-1888.
[10]Stevens SL, Ciesielski TM, Marsh BJ, et al. Toll-like receptor 9: a new target of ischemic preconditioning in the brain[J]. J Cereb Blood Flow Metab, 2008, 28(5):1040-1047.
[11]Bahjat FR, Williams-Karnesky RL, Kohama SG, et al. Proof of concept: pharmacological preconditioning with a Toll-like receptor agonist protects against cerebrovascular injury in a primate model of stroke[J]. J Cereb Blood Flow Metab, 2011, 31(5):1229-1242.
Inhibition of Toll-like receptor 9 activation in microglia after oxygen-glucose deprivation and reoxygenation protects neurons from damage
PENG Qing-xia1, YANG Bi-ying2, PAN Jing-rui1, WANG Hong-xuan1, LI Xiang-pen1, WANG Yi-dong1
(1DepartmentofNeurology,SunYat-senMemorialHospital,SunYat-senUniversity,2TheForthDepartmentofNeurology,GuangdongProvincialHospitalofTraditionalChineseMedicine,Guangzhou510120,China.E-mail:wydys@126.com)
AIM: To observe the Toll-like receptor 9 (TLR9) activation in microglia BV-2 cells after oxygen-glucose deprivation and reoxygenation (OGDR), and its effects on neuronal apoptosis. METHODS: The BV-2 cell supernatants were collected after the corresponding treatment and added to mouse primary cortical neurons after OGDR for 4 h, followed by normal culture for 24 h. The cells were divided into normal BV-2 group, NC-siRNA group, TLR9-siRNA group, OGDR group, OGDR+NC-siRNA group, OGDR+TLR9-siRNA group and control group (without adding BV-2 cell supernatant). The changes of the neuronal morphology were observed under an inverted phase- contrast microscope, and the neuronal apoptosis was detected by TUNEL. The protein expression of cleaved caspase-3 was detected by Western blotting. RESULTS: After OGDR, the axon turned thin, twisted and broken, and neuronal swelling, decrease in refraction and vacuolar degeneration were observed. The green-stained apoptotic bodies in the neurons in all groups were positive. Compared with control group, the caspase-3 protein levels in other groups were increased. Compared with the normal BV-2 group, the caspase-3 protein in OGDR group and TLR9-siRNA group was increased. Compared with OGDR+TLR9-siRNA group, the caspase-3 protein in TLR9-siRNA group and OGDR group was decreased. CONCLUSION: After OGDR, TLR9 activation in BV-2 cells induces neuronal apoptosis with the increase in caspase-3 protein level. Inhibition of TLR9 expression reduces neuronal damage.
Oxygen-glucose deprivation and reoxygenation; Microglia; Neurons; Toll-like receptor 9
1000- 4718(2015)03- 0403- 06
2014- 10- 28
2014- 12- 19
国家自然科学基金资助项目(No. 81171103);广东省自然科学基金资助项目(No. S2011010006043)
△通讯作者 Tel: 020-81332619; E-mail: wydys@126.com
R743; R363
A
10.3969/j.issn.1000- 4718.2015.03.004
