沉默婆罗双树样基因4对前列腺癌LNCaP细胞增殖和凋亡生物学行为的影响*
2015-04-17赖义明曾乐祥王淦平陈贤举余永晟陈杰青张思敏张一鸣郭正辉
李 金, 黄 海, 赖义明, 曾乐祥, 曹 亿, 王淦平, 陈贤举, 余永晟, 陈杰青, 张思敏, 张一鸣, 郭正辉△
(中山大学孙逸仙纪念医院 1泌尿外科, 2小儿外科, 3急诊外科,广东 广州 510120; 4深圳市第二人民医院泌尿外科,广东 深圳 518035; 5惠州市中心医院泌尿外科,广东 惠州 516001; 6南方医科大学珠江医院泌尿外科,广东 广州 510282)
沉默婆罗双树样基因4对前列腺癌LNCaP细胞增殖和凋亡生物学行为的影响*
李 金1, 黄 海1, 赖义明1, 曾乐祥2, 曹 亿3, 王淦平1, 陈贤举1, 余永晟1, 陈杰青4, 张思敏5, 张一鸣6, 郭正辉1△
(中山大学孙逸仙纪念医院1泌尿外科,2小儿外科,3急诊外科,广东 广州 510120;4深圳市第二人民医院泌尿外科,广东 深圳 518035;5惠州市中心医院泌尿外科,广东 惠州 516001;6南方医科大学珠江医院泌尿外科,广东 广州 510282)
目的: 使用小干扰RNA(siRNA)抑制人前列腺癌LNCaP细胞中婆罗双树样基因4(SALL4)的表达并对抑制效果进行测定,检测沉默(SALL4)后LNCaP细胞增殖、集落形成及凋亡等生物学行为的变化。方法: 培养LNCaP细胞,分为si-SALL4组、阴性对照组与空白对照组。Real-time PCR与Western blotting技术检测SALL4 mRNA与蛋白水平。采用MTS比色法观察各组细胞增殖能力的变化,采用集落形成实验观察各组细胞集落形成能力的变化,流式细胞术研究SALL4对细胞凋亡的影响,利用Western blotting方法检测凋亡相关蛋白Bax和Bcl-2的表达情况。结果: 与阴性对照组相比,si-SALL4组SALL4 mRNA和蛋白表达水平、细胞增殖能力、细胞集落形成能力均明显降低(P<0.05),而凋亡细胞明显增加(P<0.05),Bcl-2的表达减弱,而Bax的表达增强。结论: 通过siRNA技术沉默(SALL4)表达可抑制前列腺癌LNCaP细胞增殖和集落形成能力,促进细胞凋亡,其促进凋亡作用可能与Bcl-2及Bax表达有关。
SALL4蛋白; 前列腺肿瘤; 细胞凋亡
前列腺癌是欧美国家诊断率最高的恶性肿瘤,居男性恶性肿瘤死亡率第2位,近年来随着居民平均寿命的延长和诊断水平的提高,我国的发病率也逐年上升[1]。前列腺癌早期无明显症状,大部分患者发现时肿瘤已经发生转移,治疗效果欠佳,从而导致患者死亡率升高。因此,寻找能够早期预测前列腺癌发生、发展的特异性标记物,及开发靶向此标记物的抑制药物很有必要。
婆罗双树基因4(Sal-like 4,SALL4)最早于 2006年克隆于果蝇,编码的蛋白具有多个 C2H2 型的双锌指结构,是一种广泛表达的转录因子。在正常生理状态下,SALL4 作为一种胚胎干细胞因子,在胚胎的发育和器官形成的过程中发挥重要作用[2]。近年来研究表明其与肿瘤的发生发展也密切相关。SALL4 高表达的报道可见于生殖细胞肿瘤、胃癌、肺癌、乳腺癌和肝癌等[3-7]。我们的前期研究[8]中发现SALL4蛋白在前列腺癌组织中高表达,其表达水平与Gleason评分、前列腺癌临床分期、预后及组织前列腺特异抗原表达密切相关,提示SALL4蛋白可能成为未来前列腺癌诊断和预后评估的重要标记物。因此需要对其在前列腺癌中的生物学功能进行深入的研究。本研究利用RNAi技术沉默前列腺癌LNCaP细胞株中SALL4基因表达,并通过MTS检测增殖、集落形成实验检测集落形成能力、流式细胞术检测凋亡情况,来探讨SALL4蛋白在调节前列腺癌细胞的增殖和凋亡中的作用。
材 料 和 方 法
1 主要试剂和前列腺癌细胞系
RNAiso Plus总RNA提取试剂、逆转录试剂盒和PCR试剂购自TaKaRa;SALL4兔抗人多克隆抗体购自Abcam;Bcl-2单克隆抗体购自CST;LipofectamineTM2000转染试剂购自Invitrogen;MTS试剂购于Promega;凋亡试剂购于eBioscience;血清购自Biological Industries;RPMI-1640不完全培养基购自Gibco;其它试剂购自江苏碧云天生物技术研究所。
人前列腺癌LNCaP细胞系由中山大学孙逸仙纪念医院林百欣医学研究中心提供。LNCaP细胞在37 ℃、5%CO2、饱和湿度的细胞培养箱中培养。培养基为含有10%小牛血清的RPMI-1640。
2 方法
2.1 LNCaP细胞转染 转染前24 h,将LNCaP细胞按2×109/m2的密度接种至6孔板。待细胞汇合至70%~80%,进行转染。分为3组:空白对照组不做任何处理(blank control),阴性对照组(negative control)加入阴性对照siRNA(NC-siRNA)。si-SALL4组加入SALL4siRNA。脂质体lipofectamineTM2000按照5 mL/L溶于无血清无抗生素培养基中,混匀。将各组siRNA按100 pmol/L的浓度溶于无血清无抗生素培养基中。将上述2种混合液混合,室温放置20 min。弃旧培养基,用无血清培养基洗涤细胞2次,然后将脂质体和RNA混合物加入细胞中,补足培养基。6 h后换正常含血清培养基。继续培养24~72 h,进行相关指标测定。
2.2 Real-time PCR检测细胞的SALL4 mRNA水平 转染48 h后,利用Trizol试剂提取LNCaP细胞的总RNA,real-time PCR扩增SALL4和内参照GAPDH。SALL4引物正义链为5’-CCCGGCAGTAAGGACTGTC-3’,反义链为5’-TCTCTGTCTTTAGGTACACCACA-3’,PCR产物为97 bp;GAPDH引物正义链为5’-CGGAGTCAACGGATTTGGTCGTAT-3’,反义链为5’-AGCCTTCTCCATGGTGGTGAAGAC-3’,扩增片段长度为500 bp。PCR反应条件为98 ℃ 20 s,55 ℃ 30 s,72 ℃ 30 s,共32个循环。
2.3 Western blotting分析细胞SALL4、Bcl-2和Bax的蛋白表达 转染72 h后收集细胞提取总蛋白并定量,取50 μg蛋白进行8%SDS-PAGE分离蛋白,电泳结束后转移蛋白至PVDF膜上,5%脱脂奶粉室温封闭1 h,孵育GAPDH(1∶1 000)、SALL4(1∶1 000)、Bcl-2(1∶1 000)和Bax(1∶1 000)Ⅰ抗4 ℃过夜。TBST洗膜,加入1∶2 000稀释的羊抗兔IgG/HRP,室温孵育1 h,TBST洗膜,然后用超敏ECL发光液(Millipore)发光。
2.4 MTS法检测细胞增殖率 将LNCaP细胞培养于96孔培养板,转染24 h、48 h、72 h、96 h后,各孔分别加入20 μL MTS试剂,37 ℃培养4 h,在490 nm处检测吸光度值(A)。每组设置3复孔,最终结果取3孔平均值。
2.5 集落形成实验检测细胞集落形成率 将LNCaP细胞培养于6孔板,转染24 h后重新消化贴壁细胞,将消化下的细胞进行计数,每组各取2 000个细胞重新种于6孔板,待14 d后移除培养基,用1 mL多聚甲醛固定细胞20 min,吸去多聚甲醛,加入1 mL结晶紫染液染色30 min,移去结晶紫用纯水清洗干净,37 ℃下晾干后在镜下计数,大于50个细胞记为1个集落。
2.6 流式细胞术检测细胞凋亡 转染后72 h收集106个细胞,用PBS洗涤,1 000 r/min离心5 min,反复2次。弃上清液,收集细胞,混匀沉淀,加入500 μL binding buffer悬浮细胞,加入10 μL PI,混匀;室温、避光,反应5~15 min;5 μL Annexin V-FITC混匀后,用流式细胞仪进行检测。
3 统计学处理
采用SPSS 19.0统计软件分析,数据以均数±标准差(mean±SD)表示,采用t检验或单因素方差分析进行各组间差异的比较。
结 果
1 siRNA抑制转染细胞中SALL4 mRNA水平
转染后48 h提取细胞总RNA,利用real-time PCR方法检测SALL4基因转录水平,结果如图1A所示。设定阴性对照组的SALL4 mRNA的相对表达量为100%,si-SALL4实验组的SALL4 mRNA的相对表达量为39.8%(P<0.05),si-SALL4在mRNA水平上抑制了SALL4的表达。
2 siRNA抑制转染细胞中SALL4蛋白水平
转染72 h后提取细胞总蛋白进行Western blotting分析,结果如图1B所示。si-SALL4实验组的SALL4蛋白水平为对照组的49.5%,蛋白表达受到明显抑制(P<0.05)。Western blotting结果进一步证实了构建的SALL4小干扰RNA可在蛋白水平上抑制SALL4表达。
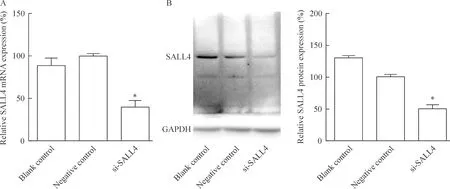
Figure 1.The expression of SALL4 at mRNA (A) and protein (B) levels in LNCaP cells after transfection with SALL4 siRNA. Mean±SD. n=3. *P<0.05 vs negative control.
3 转染SALL4小干扰RNA抑制细胞增殖
与空白对照组和阴性对照组相比转染si-SALL4后72 h LNCaP细胞的增殖活性开始受到抑制(P<0.05),见图2。
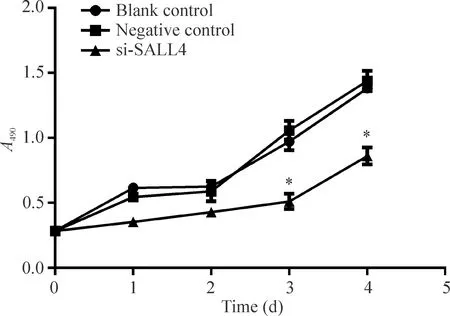
Figure 2.MTS detection results after SALL4 siRNA transfection in LNCaP cells. Mean±SD. n=3. *P<0.05 vs negative control.
4 转染SALL4小干扰RNA抑制细胞集落形成
转染24 h后进行集落实验,培养14 d后检测集落形成率。转染SALL4 siRNA后,LNCaP细胞的集落形成数与阴性对照组相比下降了46.4%(P<0.05),见图3。
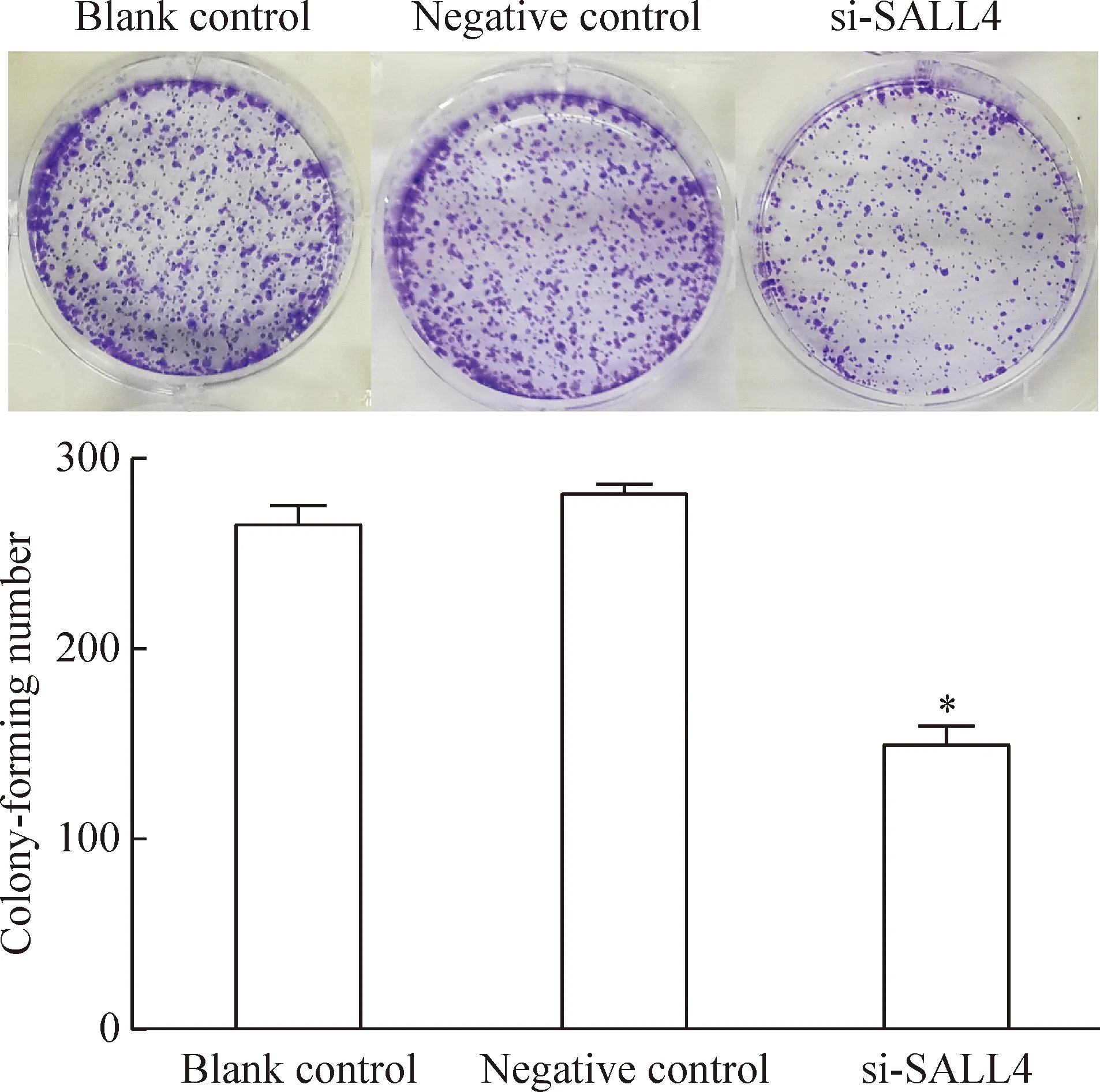
Figure 3.Colony formation results after SALL4 siRNA transfection in LNCaP cells. Mean±SD. n=3. *P<0.05 vs negative control.
5 Annexin V-FITC流式细胞术检测细胞凋亡
si-SALL4组出现早期凋亡细胞群,其总体凋亡率为15.46%,与阴性对照组比较,差异显著(P<0.05),见图4。
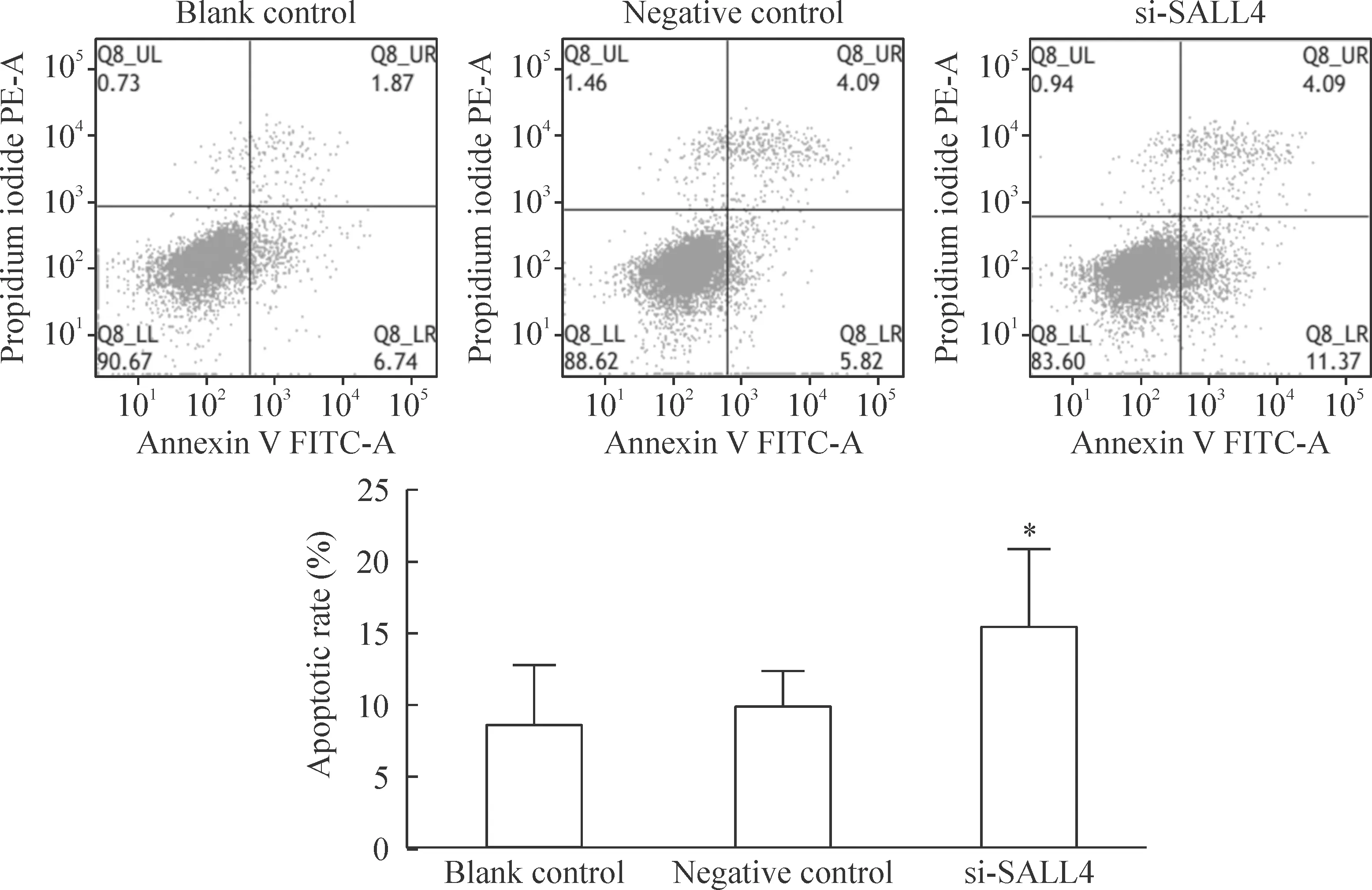
Figure 4.Detection of apoptotic rate by flow cytometry after transfection of SALL4 siRNA in LNCaP cells. Mean±SD. n=3. *P<0.05 vs negative control.
6 si-SALL4下调Bcl-2蛋白的表达,上调Bax蛋白的表达
Western blotting结果显示,与阴性对照组相比,si-SALL4组中LNCaP细胞的抗凋亡蛋白Bcl-2的表达明显下调(P<0.05),而促凋亡蛋白Bax的表达量明显上调(P<0.05),见图5。
讨 论
在欧美国家,前列腺癌是一种老年男性常见疾病,其发病率仅次于肺癌,居第2位。流行病学显示,前列腺癌在我国的发病率也呈逐年上升趋势,已列为男性泌尿系统肿瘤的第3位[9],但发病机制尚不明确。研究表明,肿瘤不受控制的增殖能力与抵抗细胞凋亡能力是恶性肿瘤的两大标志之一[10],但是调控肿瘤细胞增殖与抗凋亡功能的机制尚未明确。

Figure 5.The effect of SALL4 siRNA on the expression of Bax and Bcl-2 proteins in LNCaP cells. Mean±SD. n=3. *P <0.05 vs negative control.
SALL4基因在维持胚胎器官的分化与发育中发挥着重要的作用,是一种重要的转录因子和干性因子。在人类中,SALL4的缺失或突变与多种疾病相关,包括acro-renal-ocular 综合征、Okihiro综合征和IVIC综合征,这些疾病均以多器官畸形为特征,如耳畸形、听力丧失以及肾脏、心脏和肢体等脏器的缺陷等。近年来研究表明SALL4蛋白在许多恶性肿瘤中高表达,其功能可能在调节肿瘤细胞特别是肿瘤干细胞的增殖与凋亡当中发挥着重要的作用。SALL4过表达于不同的恶性肿瘤,在结直肠癌中,大约90%的肿瘤标本有SALL4过表达,并且与肿瘤淋巴结转移及分化程度密切相关[11],在乳腺癌中也有86.1%的肿瘤SALL4表达增高,甚至在肿瘤的早期就可以增高[6]。 此外,Oikawa等[12]的研究指出,SALL4在肝癌干细胞中而非肝癌细胞中高表达,干预SALL4基因的表达后,肝癌干细胞的增殖能力下调,凋亡增加。Yang等[13]发现,从白血病NB4细胞系分离出的癌干细胞中SALL4的表达对与细胞的存活与凋亡至关重要,表达谱芯片显示抑制SALL4基因后抗凋亡基因bcl-2等下调明显,而TP53、TNF等促凋亡基因显著上调,提示SALL4对于维持白血病细胞抗凋亡能力至关重要。另外,我们的前期研究发现,前列腺特异性膜抗原可能通过上调ERK蛋白的活性正向调节前列腺癌细胞的生长、迁移[14],进一步检测发现不同情况下ERK与SALL4的表达具有高度的一致性,磷酸化的ERK可能通过进入胞内激活SALL4启动肿瘤细胞快速增殖机制,因此前列腺癌中SALL4的高表达可能受前列腺特异性膜抗原调控。我们的前期研究[8]中发现SALL4蛋白在前列腺癌组织中高表达,其表达水平与Gleason评分、前列腺癌临床分期、预后及组织前列腺特异抗原表达密切相关,提示其可能是前列腺癌发生发展的重要标记物。但是目前SALL4调控前列腺癌细胞生物学功能的研究尚未见报道。我们的研究首次发现,抑制SALL4蛋白表达后,前列腺癌LNCAP细胞的增殖和集落形成能力明显降低,凋亡细胞增加,提示抑制SALL4可能通过增加细胞凋亡来抑制细胞增殖。但是相关机制尚未明确。
细胞的凋亡受多种因素的影响,是一个涉及多分子、多基因水平变化的多阶段过程,在其过程中不同功能的分子和基因对细胞所产生的影响协同调节细胞凋亡[15]。众多研究表明bcl-2基因是抗细胞凋亡的重要基因,其过度表达可导致下游产物Bax的减少,抑制细胞凋亡,并导致细胞增殖与程序性细胞死亡失衡[16-17]。而且近年研究也发现Bcl-2在进展及转移性前列腺癌中高表达,其可导致前列腺癌抗凋亡能力增加,并最终导致肿瘤的耐药性增加[18-19]。本实验中,瞬时转染SALL4 siRNA后,可导致细胞凋亡增加,Western blotting检测发现Bcl-2的蛋白水平下降,Bax的蛋白水平上升,说明抑制SALL4具有促进前列腺癌细胞凋亡的重要作用,其机制可能是通过调节凋亡相关蛋白Bcl-2与Bax的表达而促进细胞凋亡。
我们的实验结果表明,SALL4可以调控前列腺癌细胞的多种生物学功能,下调SALL4可导致前列腺癌细胞增殖减少、集落形成能力下调,凋亡增加,其机制可能是通过Bcl-2与Bax蛋白调控细胞凋亡。此结果为进一步研究SALL4调控细胞的机制及其在前列腺癌中的作用奠定了基础。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90.
[2] Rao S, Zhen S, Roumiantsev S, et al. Differential roles of Sall4 isoforms in embryonic stem cell pluripotency[J]. Mol Cell Biol, 2010, 30(22):5364-5380.
[3] Yong J, Gao C, Lim JS, et al. Oncofetal geneSALL4 in aggressive hepatocellular carcinoma[J]. N Engl J Med, 2013, 368(24):2266-2276.
[4] Kobayashi D,KuribayashiK,Tanaka M,et al. Overexpression of SALL4 in lung cancer and its importance in cell proliferation[J]. Oncol Rep, 2011,26(4):965-970.
[5] Cao D, Li J, Guo CC, et al. SALL4 is a novel diagnostic marker for testicular germ cell tumors[J]. Am J Surg Pathol, 2009, 33(7):1065-1077.
[6] Kobayashi D, Kuribayshi K, Tanaka M, et al. SALL4 is essential for cancer cell proliferation and is overexpressed at early clinical stages in breast cancer[J]. Int J Oncol, 2011, 38(4):933-939.
[7] Zhang L, Xu Z, Xu X, et al. SALL4, a novel marker for human gastric carcinogenesis and metastasis[J]. Oncogene, 2014, 33(48):5491-5500.
[8] 赖义明,黄 海,凌逸虹,等. 婆罗双树样基因4在人前列腺癌细胞和组织中的表达及其与临床预后之间的关系[J]. 中国病理生理杂志, 2013, 29(12):2186-2192.
[9] Gao H, Li Y, Wu S, et al. Mass screening of prostate cancer in a Chinese population: the relationship between pathological features of prostate cancer and serum prostate specific antigen[J]. Asian J Androl, 2005, 7(2):159-163.
[10]Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5):646-674.
[11]Forghanifard MM, Moghbeli M, Raeisossadati R, et al. Role of SALL4 in the progression and metastasis of colorectal cancer[J]. J Biomed Sci, 2013, 20:6.
[12]Oikawa T, Kamiya A, Zeniya M, et al. Sal-like protein 4 (SALL4), a stem cell biomarker in liver cancers[J]. Hepatology, 2013, 57(4):1469-1483.
[13]Yang J, Chai L, Gao C, et al. SALL4 is a key regulator of survival and apoptosis in human leukemic cells[J]. Blood, 2008, 112(3):805-813.
[14]郭正辉,黄 海,杜 涛,等. PSMA对LNCaP细胞生长、迁移及ERK蛋白活性的影响[J]. 中国病理生理杂志, 2011, 27(6):1090-1096.
[15]Eum K, Lee M. Crosstalk between autophagy and apoptosis in the regulation of paclitaxel-induced cell death in v-Ha-ras-transformed fibroblasts[J]. Mol Cell Biochem, 2011, 348(1-2):61-68.
[16]Czabotar E, Lessene G, Strasser A, et al. Control of apoptosis by the BCL-2 protein family: implications for phy-siology and therapy[J]. Nat Rev Mol Cell Biol, 2013, 15(1):49-63.
[17]Akl H, Vervloessem T, Kiviluoto S, et al. A dual role for the anti-apoptotic Bcl-2 protein in cancer: mitochondriaversusendoplasmic reticulum[J]. Biochim Biophy Acta ,2014, 1843(10):2240-2252.
[18]Karnak D, Xu L. Chemosensitization of prostate cancer by modulating Bcl-2 family proteins[J]. Curr Drug Targets, 2010, 11(6):699-707.
[19]Furuya Y, Krajewski S, Epstein JI, et al. Expression ofbcl-2 and the progression of human and rodent prostatic cancers[J]. Clin Cancer Res, 1996, 2(2):389-398.
Knockdown of SALL4 expression regulates cell proliferation and apoptosis in prostate cancer LNCaP cells
LI Jin1, HUANG Hai1, LAI Yi-ming1, ZENG Le-xiang2, CAO Yi3, WANG Gan-ping1, CHEN Xian-ju1, YU Yong-sheng1, CHEN Jie-qing4, ZHANG Si-min5, ZHANG Yi-ming6, GUO Zheng-hui1
(1DepartmentofUrology,2DepartmentofPediatricSurgery,3DepartmentofEmergencySurgery,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China;4DepartmentofUrology,ShenzhenSecondMunicipalHospital,Shenzhen518035,China;5DepartmentofUrology,HuizhouMunicipalCentralHospital,Huizhou516001,China;6DepartmentofUrology,ZhujiangHospital,SouthernMedicalUniversity,Guangzhou510282,China.E-mail: 2352236171@qq.com)
AIM: To investigate the SALL4 expression, proliferation and apoptosis in the LNCaP cells after transfection ofSALL4 siRNA. METHODS: The expression of SALL4 at mRNA and protein levels was detected by real-time PCR and Western blotting. MTS assay, colony formation assay and flow cytometry were used to determine the proliferation, colony formation ability and apoptosis of the LNCaP cells. The effect of SALL4 on the expression of Bax and Bcl-2 was analyzed by Western blotting. RESULTS: Compared with negative control group, the expression of SALL4 at mRNA and protein levels in LNCaP cells was down-regulated by transfection ofSALL4 siRNA (P<0.05). The proliferation rate and colony formation ability were decreased, while apoptosis rate increased in si-SALL4 group (P<0.05). Higher expression of Bax and lower expression of Bcl-2 in si-SALL4 group were observed (P<0.05). CONCLUSION: Down-regulation ofSALL4 by siRNA not only suppresses LNCaP cell proliferation and colony formation, but also inhibits Bcl-2 expression and activates Bax expression to induce apoptosis.
SALL4 protein; Prostate neoplasms; Apoptosis
1000- 4718(2015)03- 0435- 05
2014- 10- 27
2014- 12- 12
国家自然科学基金资助项目(No. 81272807; No. 81472382; No. 81101947); 广东省自然科学基金资助项目(No. S2011010004546; No. S2012010010780)
△通讯作者 Tel: 020-81332146; E-mail: 2352236171@qq.com
R730.23
A
10.3969/j.issn.1000- 4718.2015.03.009
