抵抗素基因启动子-420C/G、细胞色素P4501A1-MspI多态性与吸烟的交互作用对非酒精性脂肪性肝病的影响
2015-04-17张超贤郭李柯
张超贤, 郭李柯
(新乡医学院第一附属医院 1消化内科,2口腔科,河南 卫辉 453100)
抵抗素基因启动子-420C/G、细胞色素P4501A1-MspI多态性与吸烟的交互作用对非酒精性脂肪性肝病的影响
张超贤1△, 郭李柯2
(新乡医学院第一附属医院1消化内科,2口腔科,河南 卫辉 453100)
目的: 探讨抵抗素基因启动子-420C/G、细胞色素P4501A1- MspI(CYP1A1- MspI)基因多态性与吸烟的交互作用与非酒精性脂肪性肝病(NAFLD)的关系。方法: 采用病例-对照研究的方法,以1 200例NAFLD患者及1 200例健康对照者的外周血白细胞为样本,利用聚合酶链反应(polymerase chain reaction, PCR)技术分析了抵抗素基因启动子-420C/G和CYP1A1- MspI基因多态性。结果: -420C/G (GG)基因型和CYP1A1- MspI(m2/m2)基因型频率分布分别为49.75%、50.08%(病例组)和24.00%、24.25%(对照组),两者经χ2检验差异显著(P<0.01)。-420C/G (GG)基因型者患NAFLD的风险显著增加。CYP1A1- MspI (m2/m2)基因型者患NAFLD的风险也显著增加。基因突变的协同分析发现-420C/G (GG)/ CYP1A1- MspI (m2/m2)基因型者在NAFLD组和对照组中的分布频率分别为39.83%和12.83%,两者经χ2检验有显著差异(P<0.01)。-420C/G (GG)/ CYP1A1- MspI (m2/m2)基因型者患NAFLD的风险显著增加。病例组的吸烟率显著高于对照组的吸烟率(P<0.01),吸烟与-420C/G (GG)和CYP1A1- MspI (m2/m2)基因型均有交互作用。结论: -420C/G (GG)、CYP1A1- MspI (m2/m2)基因型和吸烟是NAFLD的易患因素,基因多态性与吸烟的交互作用增加了NAFLD的发病风险。
非酒精性脂肪性肝病; 抵抗素基因启动子-420C/G; 细胞色素P4501A1-MspI; 基因多态性; 吸烟
非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)的确切发病机制目前尚不清楚,以二次打击学说较为流行,该学说认为胰岛素抵抗会导致肝脏脂肪沉积,成为NAFLD发病过程中的一次打击,而在肝脏脂肪沉积基础上所发生的氧化应激和脂质过氧化反应则形成二次打击,最终导致NAFLD的发生[1-4]。香烟以燃烧过程中生成的尼古丁、3,4-苯并芘、一氧化碳等干扰脂质代谢,激发自由基及活性氧生成,促进脂质过氧化而参与NAFLD的发生、发展[5]。抵抗素(resistin)是一种主要由白色脂肪细胞分泌的肽类,其作用是对抗胰岛素的效应,引起胰岛素抵抗,并且具有潜在炎性因子活性,是促进NAFLD的进展的重要因素[6-7]。细胞色素P450酶(cytochromes P450, CYP450)是一类参与内源性和外源性化合物代谢的酶, 其1A1亚型(CYP1A1)是参与氧化应激和脂质过氧化过程中的关键酶,对 NAFLD的发生及发展起着重要作用[8]。抵抗素、CYP1A1基因具有多态性,即具有多个等位基因,不同的等位基因编码的抵抗素或谷胱甘肽过氧化物酶活性有差异。从理论上推断抵抗素或CYP1A1基因的多态性可使机体对外界环境(如吸烟)的反应能力有所不同,这是决定机体NAFLD易感性的一个重要因素。抵抗素、CYP1A1基因多态性与NAFLD易感性的研究日渐增多[9-10],但尚未见吸烟与上述基因多态性的联合作用对NAFLD易感性影响的报道。为了研究抵抗素和谷胱甘肽过氧化物酶在豫北地区当地人群中的分布状态,进而探索其和吸烟习惯相互作用与NAFLD高发的关系,我们在国内首次开展了抵抗素和CYP1A1联合基因多态性与NAFLD易感性关系的研究。
材 料 和 方 法
1 研究对象及相关资料
2010年5月~2013年7月在我院门诊和病房诊治的NAFLD患者1 200例,NAFLD的诊断参照中华医学会肝脏病学分会脂肪肝和酒精性肝病学组的诊断标准[11]。对照组1 200例为健康体检人群,排除2型糖尿病、肥胖、高血压、高脂血症及其它代谢性疾病,排除饮酒史。2组在年龄、性别、民族和籍贯无显著差异,无血缘关系,吸烟状况本文分为不吸烟者、吸烟者(将每天1~5支,持续3年以上或每天5支以上持续1年以上定义为吸烟者)。每人各抽取静脉血2~3 mL,置乙二胺四乙酸钠抗凝管, 分离白细胞层。用QIAampDNA提取试剂盒(QIAgen)提取白细胞DNA,DNA置-30℃低温冰箱保存备用。
2 基因测定
2.1 抵抗素基因启动子-420C/G多态性分析[12]上游引物序列为5’-GTTTGCATCAGCCACCCT-3’,下游引物序列为5’-GCACCGCAGCTCTTTCTT -3’ (由上海生工生物技术有限公司合成),PCR反应体系包括基因组DNA 1 μL,上、下游引物各0.5 μL,Taq DNA聚合酶Mix液(TaKaRa)25 μL。反应条件为94 ℃ 5 min;94℃ 45 s, 55 ℃ 45 s,72 ℃ 30 s,40个循环;最后72 ℃ 7 min。PCR产物长度为286 bp,经Bio-Rad染色琼脂糖凝胶电泳确认扩增结果后,以限制性内切酶EarⅠ酶切,37 ℃孵育4 h,取酶切产物4 μL经Bio-Rad染色琼脂糖凝胶电泳后,酶切产物放入紫外线凝胶成像仪观测,可见3种带型: CC纯合子为179 bp和107 bp的2条区带,GG纯合子为286 bp的1条区带,CG杂合子为286 bp、179 bp和107 bp的3条区带,见图1。
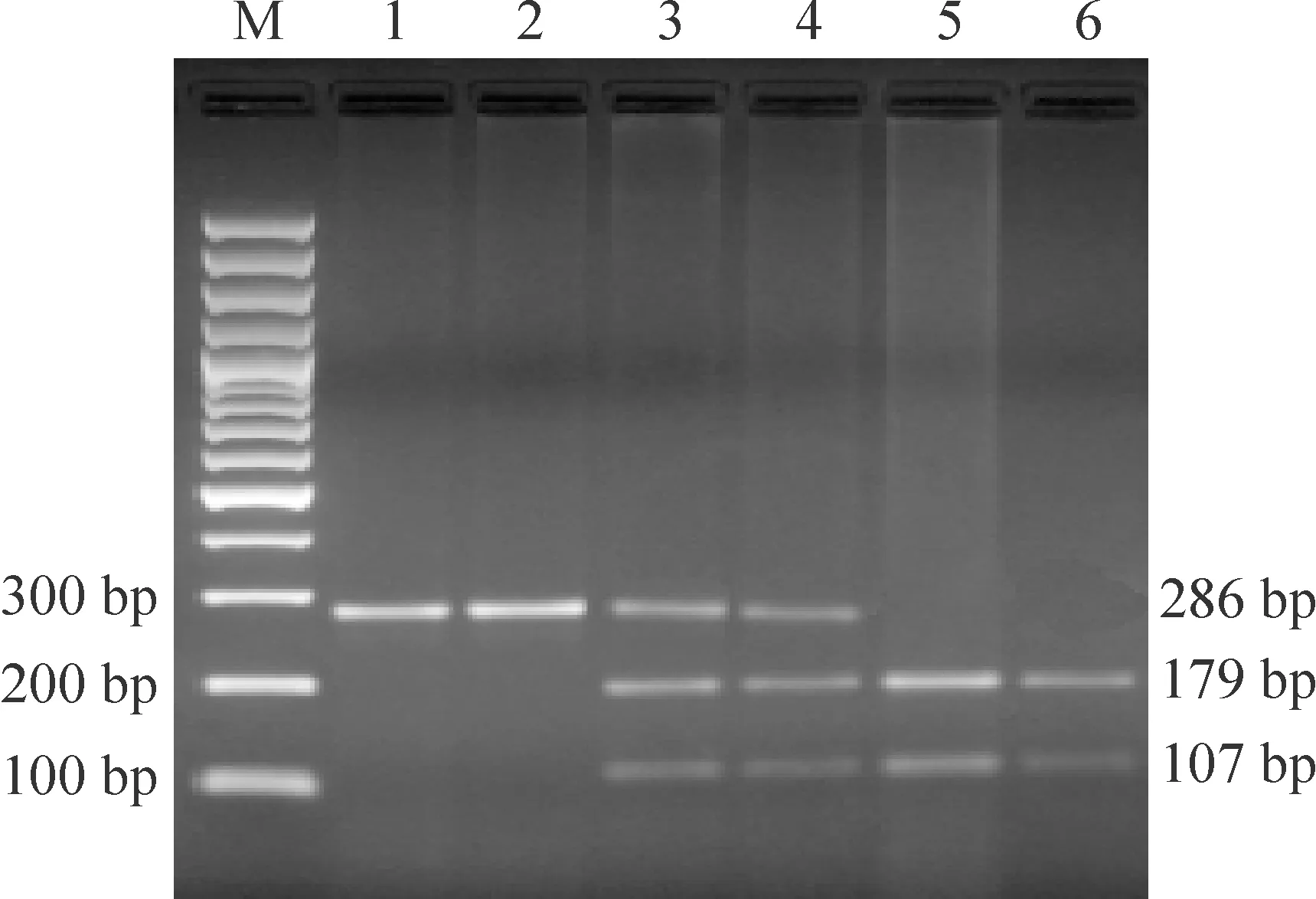
Figure 1.The PCR product electrophoretogram of resistin gene promoter -420C/G. M: marker; Lane 1, 2: G/G; Lane 3, 4: C/G; Lane 5, 6: C/C.
2.2 CYP1A1-MspI多态性分析[13]引物序列为5’-CAGTGAAGAGGTGTAGCCGCT-3’和5’-TAGGAGTCTTGTCTCATGCCT-3’(由上海生工生物工程技术服务有限公司合成)。PCR反应体系总量25 μL,包括10×缓冲液2.5 μL、1 mmol/L dNTP 2.5 μL、引物各15 pmol、TaqDNA聚合酶2.5 U、模板DNA 2 μL(Promega)。扩增参数为94 ℃ 4 min;94 ℃40 s,55 ℃ 40 s,72 ℃ 50 s,循环35次;72 ℃ 7 min。取PCR扩增产物5 μL于1.5%琼脂糖凝胶中,100 V电泳1 h,溴化乙锭(ethydium bromide,EB)染色30 min,紫外分析仪观察PCR扩增结果。电泳板琼脂糖由大连宝生物工程有限公司生产。取PCR产物10 μL,加入MspI内切酶(TaRaKa),酶切反应体系总量30 μL,包括PCR产物10 μL、10×反应缓冲液2 μL、MspI内切酶10 U,37 ℃ 3 h。酶切后产物点样于1.5%琼脂糖凝胶中,100 V电泳1 h,EB染色30 min,分析结果。酶切后分为3种基因型:野生型(m1/m1)为340 bp单一条带,杂合型(m1/m2)为340、200、140 bp 3条区带,突变纯合型(m2/m2)为200、140 bp 2条区带,见图2。
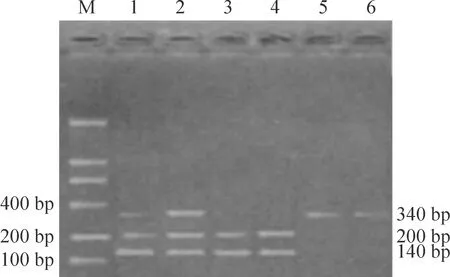
Figure 2.The PCR product electrophoretogram of CYP1A1 gene digested with Msp I restriction enzyme. M: marker; Lane 1, 2: m1/m2; Lane 3, 4: m2/m2; Lane 5, 6: m1/m1.
3 统计学处理
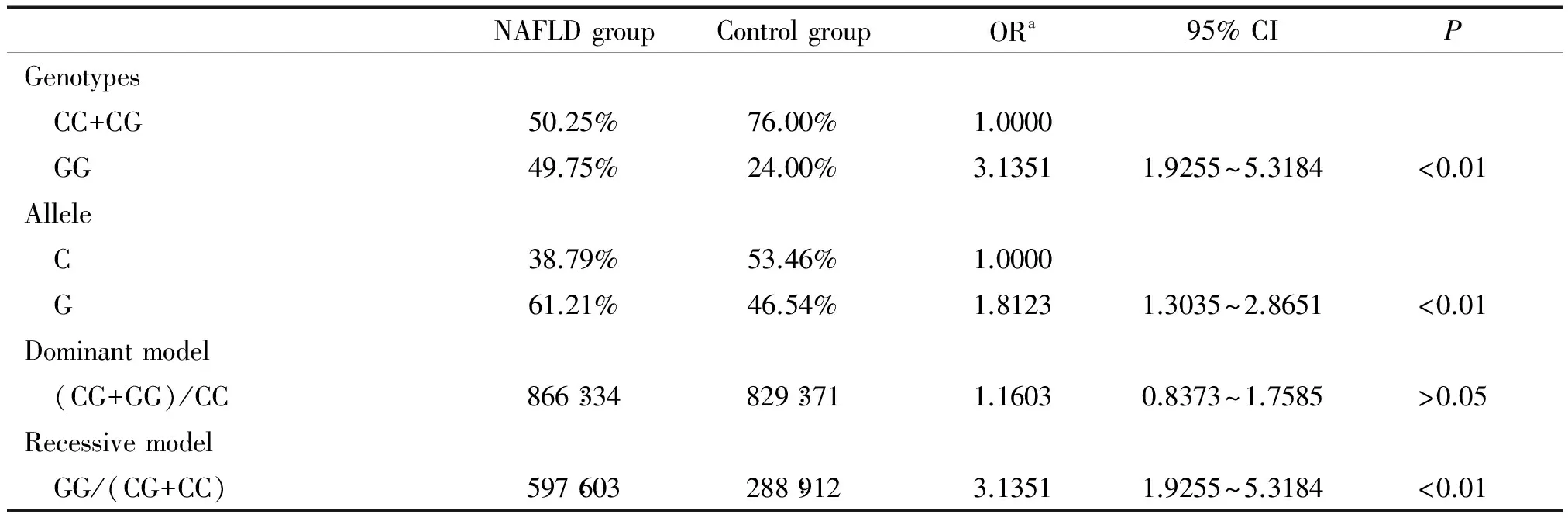
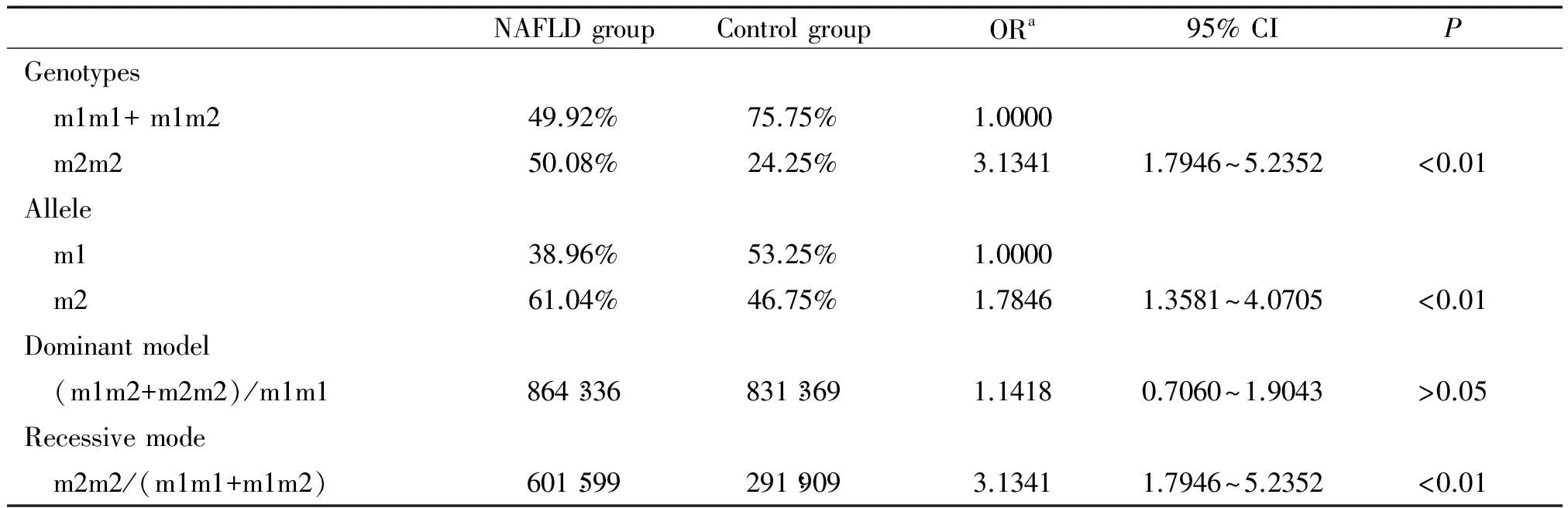
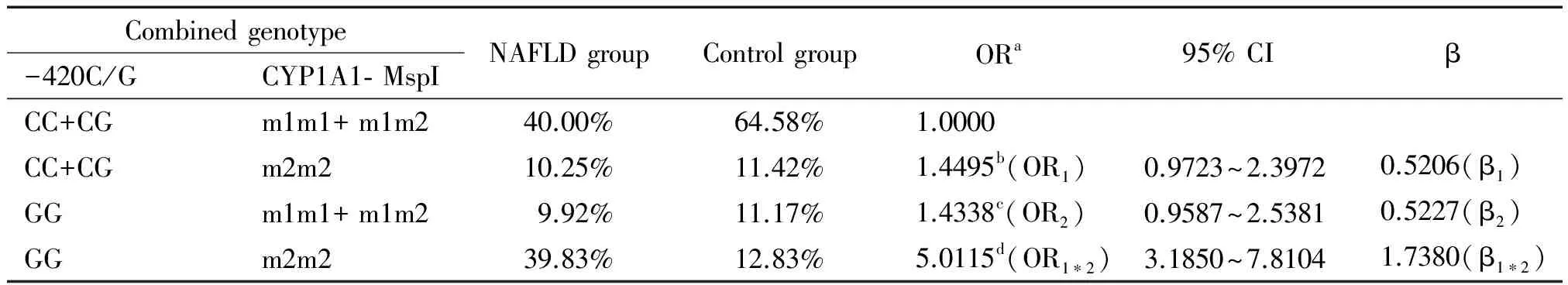
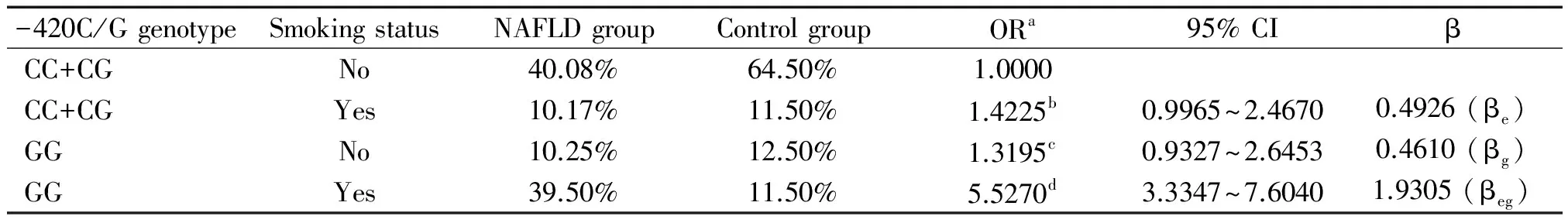
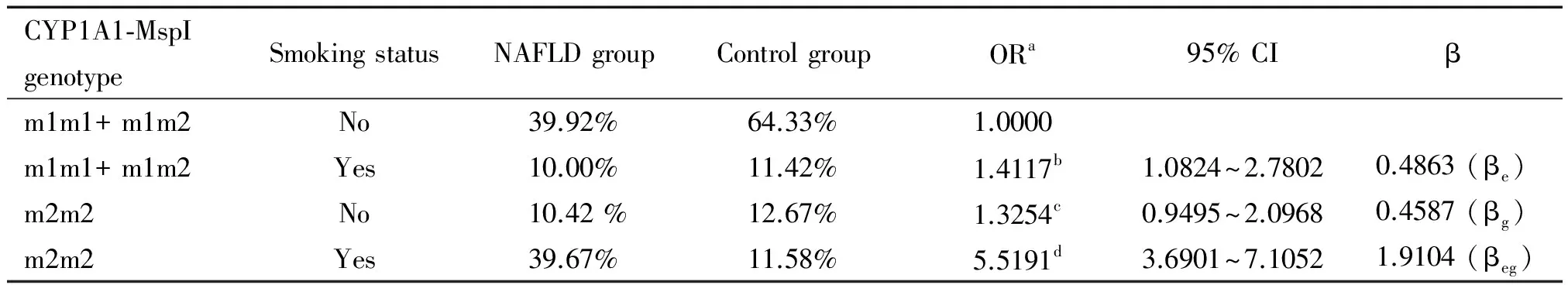
Hardy-Weinberg平衡检验研究样本的群体代表性 ,以P>0.05为符合 Hardy-Weinberg规律。用比值比(OR)值和95%可信区间 (95% CI)评价相对风险,病例组和对照组之间的基因型频率和等位基因频率采用2检验,以P<0.05为差异有统计学意义。条件Logistic回归模型分析交互作用;根据Khoury等[14]提出的交互作用模型和交互系数(γ=βeg/βe)判断基因-环境交互作用模型以及交互作用类型。判定依据1: γ>1,表示基因对环境暴露的效应有放大作用,正向交互作用;γ<1,表示基因对环境暴露的效应有减弱作用,负向交互作用; γ=1,表示基因对环境暴露没有交互作用。在病例对照研究中,γ 为两变量lgOR的比值。判定依据2:OReg=ORe×ORg为相乘模型;OReg>ORe×ORg为超相乘模型;OReg 1 NAFLD组和对照组的一般资料分析 如表1所示,NAFLD组和对照组性别、年龄分布无显著差异;NAFLD组吸烟率显著高于对照组,差异有统计学意义。 表1 NAFLD组和对照组的一般资料 **P<0.01vscontrol group. 2 抵抗素基因启动子-420C/G和CYP1A1-MspI基因型、等位基因频率及相关遗传模型关联分析 经Hardy-Weinberg 平衡检验,-420C/G各基因型在对照组中的分布均符合Hardy-Weinberg 规律(P>0.05),说明研究群体具有代表性(表2)。CC+CG、 GG基因型频率在病例组和对照组有显著差异(P<0.01);等位基因G在NAFLD组和对照组之间的分布差异具有统计学意义(P<0.01),且OR值大于1,说明含等位基因G的个体发生NAFLD 的风险相对较高;采用显性和隐性2种遗传模型进行分析发现在隐性模型中,两位点的不同基因型在病例、对照组之间的分布差异均具有统计学意义(P<0.01),说明GG纯合型个体具有NAFLD 易感性。结果表明:-420C/G(C→G突变)可能增加NAFLD的患病风险(表2)。CYP1A1-MspI 3种基因型、等位基因频率及相关遗传模型关联亦符合上述规律(表3)。 3 抵抗素基因启动子-420C/G和CYP1A1-MspI基因多态性NAFLD发病中的交互作用 -420C/G (GG)/ CYP1A1-MspI(m2/m2)在NAFLD组占39.83%,而对照组仅占12.83%,-420C/G (GG)和CYP1A1-MspI(m2/m2) 在NAFLD发病中存在正向交互作用,交互系数γ1=β1*2/β2=3.3250和γ2=β1*2/β1=3.3385均大于1,OR1*2>OR1×OR2为超相乘模型(表4)。 表2 抵抗素基因启动子-420C/G基因型与等位基因分布及其遗传模型分析 aAdjusted according to age, gender and smoking status. 表3 CYP1A1- MspI基因型与等位基因分布及其遗传模型分析 aAdjusted according to age, gender and smoking status. 表4 抵抗素基因启动子-420C/G和CYP1A1- MspI多态性在NAFLD发病中的交互作用 aAdjusted according to age, gender and smoking status;bOR value by simple CYP1A1- MspI homozygous mutants exposure (OR1);cOR value by simple -420C/G homozygous mutants exposure (OR2);dOR value by 2 interacting genes in homozygous mutant (OR1*2). 4 抵抗素基因启动子-420C/G、CYP1A1-MspI多态性与吸烟在NAFLD发病中的交互作用 携带-420C/G (CC+CG) 基因吸烟者ORe为1.4225(95% CI:0.9965~2.4670),单独携带-420C/G (GG)型的ORg为1.3195(95% CI:0.9327~2.6453),两者同时存在时,交互作用OReg为5.5270(95% CI:3.3347~7.6040),交互系数γ=βeg/βe=3.9190>1,OReg>ORe×ORg为超相乘模型(表5)。携带CYP1A1-MspI (m2/m2)者同时吸烟交互作用OReg为5.5191(95% CI:3.6901~7.1052),交互系数γ=βeg/βe=3.9284>1,OReg>ORe×ORg为超相乘模型(表6)。 表5 抵抗素基因启动子-420C/G多态性和吸烟在NAFLD发病中的交互作用 aAdjusted according to age and gender;bOR value by simple smoking exposure (ORe);cOR value by simple homozygous mutant type exposure (ORg);dOR value by the interaction of smoking and homozygous mutant (OReg). 表6 CYP1A1-MspI多态性和吸烟在NAFLD发病中的交互作用 aAdjusted according to age and gender;bOR value by simple smoking exposure (ORe);cOR value by simple homozygous mutant type exposure (ORg);dOR value by the interaction of smoking and homozygous mutant (OReg). 抵抗素是一种由脂肪细胞特异分泌的多肽类激素。与代谢密切相关,可减弱脂肪细胞、骨骼肌细胞以及肝细胞对胰岛素的敏感性,是导致肝脏胰岛素抵抗、促进肝脏脂肪沉积的的一种重要细胞因子[15-17]。抵抗素γ的表达受基因的控制和环境因素的诱导,其表达和诱导表达水平均有显著个体差异。人抵抗素基因定位于19p13.2,内含子边界序列均高度保守,其mRNA含476 个碱基对,其编码区含有326个碱基对,编码108个氨基酸。人的抵抗素基因存在多种单核苷酸多态性现象,如-420C/G、+299 G/A和-638G/A等。其中-420C/G 被认为是影响抵抗素基因表达的主要多态性位点,可影响启动子的活性,增加血液和组织中抵抗素的表达,从而影响其生物学效应。抵抗素基因-420C/G多态性具有3种基因型: -420C/G(CC)、-420C/G(CG)和-420C/G(GG),国内外已有研究报道认为-420C/G位点的多态性与代谢综合征有关[18-19]。本研究发现-420C/G(GG)基因型者发生NAFLD的风险显著增加,其OR等于3.1351, 95% CI为1.9255~5.3184。与上述研究结果一致。-420C/G(GG)基因型者易患NAFLD的机理还不清楚,相关研究显示G等位基因可能通过活化抵抗素基因转录过程,增加抵抗素表达,降低胰岛素敏感性[20],从而最终引起肝脏内脂质沉积,增加NAFLD发生的危险性。 在非酒精性脂肪肝的两次打击学说中, CYP1A1介导的脂质过氧化发挥重要的作用, 其作用机制与肝细胞内微粒体氧类物质和自由基的生成有关。肝细胞内蓄积游离脂肪酸可诱导CYP1A1 活性增加,促进微粒体氧应激,随着CYP1A1 表达的增强,抗氧化剂(如SOD、GSH、维生素E)的含量均显著下降。由于脂质过氧化反应的增强而抗氧化能力下降,导致自由基的生成增多。自由基氧化细胞膜的脂质和蛋白质最终导致肝细胞结构与功能的损害可造成肝毒性和线粒体的损伤,同时由CYP1A1 产生的活性氧通过扩散作用,激活肝星状细胞形成肝纤维化[21]。CYP1A1基因定位于人类染色体15q 22224,包含7个外显子和6个内含子。CYP1A1的表达受基因的控制和环境因素的诱导,其本底表达和诱导表达水平均有显著个体差异。其3′端非翻译区的T6235C置换产生1个MspⅠ酶切位点即MspI多态性,突变基因的存在可能是通过与该基因调节区其它多态性的连锁而影响CYP1A1的诱导性。CYP1A1不仅因介导脂质过氧化反应在NAFLD进展中发挥重要作用,而且同时是参与药物、毒物、前致癌物代谢主要Ⅰ相代谢酶,大多数环境致癌物在体内都需要CYP1A1代谢激活后才有致癌性, 所以在理论上因CYP1A1基因变异导致CYP1A1转录或活性增强皆有可能增加恶性肿瘤和NAFLD的易感性。国内外已有研究报道认为MspI位点的多态性与胆囊癌、肺癌等肿瘤的易感性有关[22-23]。MspI多态性具有3种基因型: 野生型(m1/m1)、杂合型(m1/m2)、突变纯合型(m2/m2),本研究发现CYP1A1(m2/m2)基因型者发生NAFLD的风险显著增加,与上述研究结果一致。CYP1A1(m2/m2)基因型者易患癌或NAFLD的机理还不清楚,相关研究证明m2基因型的酶活性高于m1基因型[24]。因此,m2/m2纯合子易患癌或NAFLD的原因可能是此种基因型者体内CYP1A1活性高,可发挥更大的促脂质过氧化或促致癌物形成作用。 本次研究应用Khoury等[14]交互作用模型理论,探询抵抗素基因启动子-420C/G和CYP1A1-MspI多态性与吸烟的交互作用,及其对NAFLD发生的意义。本研究发现-420C/G与CYP1A1-MspI突变型的交互作用增加了NAFLD的发病风险。-420C/G (GG) 和CYP1A1-MspI (m2/m2)基因型对NAFLD的发生风险有相互放大效应;通过对吸烟状况的分析发现,吸烟者患NAFLD的风险明显高于不吸烟者;吸烟与-420C/G(GG)和CYP1A1-MspI (m2/m2)基因型的交互作用OR值分别为5.5270、5.5191,γ值分别为3.9190、3.9284,均明显大于1,提示-420C/G(GG)和CYP1A1-MspI(m2/m2)基因型与吸烟暴露在NAFLD发生中均有正向交互作用,携带-420C/G(GG)或和CYP1A1-MspI (m2/m2)基因型者吸烟的危害效应更大;两基因型与吸烟暴露交互作用OReg均大于ORe×ORg,显示上述两纯合突变基因与吸烟交互作用机制在NAFLD发生中可能为超相乘模型。长期吸烟可使细胞内葡萄糖代谢的氧化与非氧化通路显著减弱,脂肪组织氧化增多,血浆游离脂肪酸水平升高,而游离脂肪酸又可被肝脏和脂肪组织摄取而合成甘油三酯,从而发生中心脂肪堆积形成腹型肥胖,导致胰岛素抵抗的发生。烟草中的尼古丁还会引起交感神经系统兴奋,导致儿茶酚胺和其它升糖激素释放增多,而儿茶酚胺是胰岛素作用的强效拮抗剂,它通过损伤胰岛素的信号转导通路和内在活性,使葡萄糖转运蛋白合成减少,从而使胰岛素作用减弱,为NAFLD发病过程中的第一次打击创造了条件[25-26]。通常情况下生物体内的活细胞均可产生氧自由基,因存在着包括GPx-1在内的自由基清除系统,可及时清除体内过剩的自由基,维持自由基的动态平衡,香烟含多种化合物,多环类的苯并芘能接受电子而形成自由基,另香烟烟气中有一氧化碳、二氧化碳、一氧化氮、烷基和烷氧基等多种有害自由基。长期吸烟的人,过量氧自由基通过血液进入肝细胞,促使肝细胞发生脂质过氧化及启动新的自由基反应,最终导致脂肪肝。这可能是吸烟可单独增加及与抵抗素基因启动子-420C/G (GG)、CYP1A1-MspI (m2/m2)协同增加NAFLD发生风险性的重要原因。 NAFLD是涉及环境因子和多种基因相互作用的复杂过程,本研究提示携带抵抗素基因启动子-420C/G和CYP1A1-MspI (m2/m2)突变基因型的个体属NAFLD高危险人群, NAFLD防治方案中应加以重视,虽然尚不能通过改变其NAFLD易感的基因型来防治NAFLD,但可以根据其与环境病因相互作用的特点,采取相应的控制环境病因的措施如戒烟或基因调控以达到有效预防NAFLD的目的。 [1] do Nascimento JH, Epifanio M, Soder RB, et al. MRI-diagnosed nonalcoholic fatty liver disease is correlated to insulin resistance in adolescents[J]. Acad Radiol, 2013, 20(11):1436-1442. [2] Nomura K, Yamanouchi T. The role of fructose-enriched diets in mechanisms of nonalcoholic fatty liver disease[J]. J Nutr Biochem, 2012, 23(3):203-208. [3] 戴 宁,邹 原,王慧芳,等. 红景天苷对非酒精性脂肪性肝炎大鼠肝组织氧化应激的抑制作用[J]. 中国病理生理杂志, 2013, 29(9):1704-1708. [4] 林妙霞,李泽楷,罗敏琪,等. 非酒精性脂肪性肝病与代谢综合征的关系研究[J]. 中国病理生理杂志, 2010, 26(12):2465-2466. [5] Liu Y, Dai M, Bi Y, et al. Active smoking, passive smoking, and risk of nonalcoholic fatty liver disease (NAFLD): a population-based study in China[J]. J Epidemiol, 2013, 23(2):115-121. [6] Boyraz M, Cekmez F, Karaoglu A, et al. Serum adiponectin, leptin, resistin and RBP4 levels in obese and metabolic syndrome children with nonalcoholic fatty liver disease[J]. Biomark Med, 2013, 7(5):737-745. [7] 李 焱,何 娟,李芳萍,等. 抵抗素在肝脏胰岛素抵抗中的作用及其机制[J]. 中国病理生理杂志, 2009, 25(4):688-692. [8] 冯雯琪, 刘群英, 曾志华,等. 电针对非酒精性脂肪肝大鼠肝细胞色素P4501A1和脂质过氧化的影响[J]. 针刺研究, 2009, 34(2):89-92. [9] Zhang LY, Jin YJ, Jin QS,et al. Association between resistin +299A/A genotype and nonalcoholic fatty liver disease in Chinese patients with type 2 diabetes mellitus[J]. Gene, 2013, 529(2):340-344. [10]Jiang W, Wang L, Kondraganti SR, et al. Disruption of the gene for CYP1A2,which is expressed primarily in liver, leads to differential regulation of hepaticand pulmonary mouse CYP1A1 expression and augmented human CYP1A1 transcriptional activation in response to 3-methylcholanthreneinvivo[J]. J Pharmacol Exp Ther, 2010, 335(2):369-379. [11]葛均波,徐永健,梅长林,等. 内科学[M]. 第8版. 北京: 人民卫生出版社, 2013:408-409. [12]Hossein-Nezhad A, Varzaneh FN, Mirzaei K, et al. A polymorphism in the resistin gene promoter and the risk of multiple sclerosis[J]. Minerva Med, 2013, 104(4):431-438. [13]Tan C, Xu HY, Zhang CY, et al. Effect of CYP1A1 MSPI polymorphism on the relationship between TP53 mutation and CDKN2A hypermethylation in non-small cell lung cancer[J]. Arch Med Res, 2011, 42(8):669-676. [14]Khoury MJ, Wagener DK. Epidemiological evaluation of the use of genetics to improve the predictive value of disease risk factors[J]. Am J Hum Genet, 1995, 56(4):835-844. [15]Lebensztejn DM, Wojtkowska M, Skiba E, et al. Serum concentration of adiponectin, leptin and resistin in obese children with non-alcoholic fatty liver disease [J]. Adv Med Sci, 2009, 54(2):177-182. [16]李 焱,何 娟,李芳萍,等. 重组腺病毒介导的高抵抗素血症对小鼠糖代谢的影响[J]. 中国病理生理杂志, 2009, 25(5):944-948. [17]牟 娇,贾德福,何作云,等. 罗格列酮对2型糖尿病大鼠血浆resistin的影响及对肾小球硬化的干预研究[J]. 中国病理生理杂志, 2009, 25(8):1635-1639. [18]Boumaiza I, Omezzine A, Rejeb J, et al. Association between four resistin polymorphisms, obesity, and metabolic syndrome parameters in Tunisian volunteers [J]. Genet Test Mol Biomarkers, 2012, 16(12):1356-1362. [19]Bik W, Ostrowski J, Baranowska-Bik A, et al. Adipokines and genetic factors in overweight or obese but metabolically healthy Polish women[J]. Neuro Endocrinol Lett, 2010, 31(4):497-506. [20]Norata GD, Ongari M, Garlaschelli K, et al. Effect of the -420C/G variant of the resistin gene promoter on metabolic syndrome, obesity, myocardial infarction and kidney dysfunction[J]. J Intern Med, 2007, 262(1):104-112. [21]谭 丽, 管小琴. 维生素E、硒对非酒精性脂肪肝大鼠肝细胞色素P4501A1及脂质过氧化的干预作用[J]. 世界华人消化杂志, 2007, 15(28):2977-2982. [22]Sharma KL, Agarwal A, Misra S, et al. Association of genetic variants of xenobiotic and estrogen metabolism pathway (CYP1A1 and CYP1B1) with gallbladder cancer susceptibility[J]. Tumour Biol, 2014, 35(6):5431-5439. [23]Li W, Song LQ, Tan J. Combined effects of CYP1A1 MspI and GSTM1 genetic polymorphisms on risk of lung cancer: an updated meta-analysis[J]. Tumour Biol, 2014, 35(9):9281-9290. [24]Sergentanis TN, Economopoulos KP, Choussein S, et al. Cytochrome P450 1A1 (CYP1A1) gene polymorphisms and cervical cancer risk: a meta-analysis[J]. Mol Biol Rep, 2012, 39(6):6647-6654. [25]Jia WP. The impact of cigarette smoking on metabolic syndrome[J]. Biomed Environ Sci, 2013, 26(12):947-952. [26]Yalcinkaya E, Celik M, Gursoy E. Determining the combined effects of smoking and obesity on insulin resistance and inflammation[J]. Eur Rev Med Pharmacol Sci, 2014,18(5):760. Interaction of polymorphisms in resistin gene promoter -420C/G, cytochromes P4501A1 gene MspI and cigarette smoking on nonalcoholic fatty liver disease ZHANG Chao-xian1, GUO Li-ke2 (1DepartmentofGastroenterology,2DepatmentofStomatology,TheFirstAffiliatedHospitalofXinxiangMedicalUniversity,Weihui453100,China.E-mail:nn21882001@aliyun.com) AIM: To investigate the interaction of polymorphisms of resistin gene promoter -420C/G, cytochromes P4501A1-MspI and cigarette smoking in nonalcoholic fatty liver disease (NAFLD). METHODS: The genetic polymorphisms in resistin gene promoter -420C/G and CYP1A1-MspI were analyzed by the technique of polymerase chain reaction (PCR) in peripheral blood leukocytes of 900 NAFLD cases and 900 healthy persons. RESULTS: The frequencies of -420C/G (GG) and CYP1A1-MspI (m2/m2) were 49.75% and 50.08% in NAFLD cases and 24.00% and 24.25% in healthy controls, respectively. Statistical tests showed a significant difference in the frequencies between the 2 groups (P<0.01). The risk of NAFLD with -420C/G (GG) was significantly higher than that of controls. Individuals who carried with CYP1A1-MspI (m2/m2) had a high risk of NAFLD. Combined analysis of the polymorphisms showed that the percentages of -420C/G (GG)/CYP1A1-MspI (m2/m2) in NAFLD and control groups were 39.83% and 12.83%, respectively (P<0.01). The people who carried with -420C/G (GG)/CYP1A1-MspI(m2/m2) had a high risk in NAFLD group. The cigarette smoking rate in NAFLD group was signi-ficantly higher than that in control group (P<0.01), and the statistic analysis suggested an interaction between cigarette smoking and -420C/G (GG) and CYP1A1-MspI (m2/m2), which increased the risk of NAFLD.CONCLUSION: -420C/G (GG), CYP1A1-MspI (m2/m2) and cigarette smoking are the risk factors in NAFLD. The interactions between genetic polymorphisms in -420C/G, CYP1A1- MspI (m2/m2) and cigarette smoking increase the risk of NAFLD. Nonalcoholic fatty liver disease; Resistin gene promoter -420C/G; Cytochromes P4501A1-MspI; Genetic polymorphism; Cigarette smoking 1000- 4718(2015)03- 0485- 07 2014- 09- 30 2014- 12- 05 R363; R575 A 10.3969/j.issn.1000- 4718.2015.03.018 △通讯作者 Tel: 0373-4402216; E-mail: nn21882001@aliyun.com结 果
讨 论
