2种诱导iPSC向神经干细胞分化方法的比较*
2015-04-15汪运山
杨 坦, 刘 华, 汪运山△
(1山东省医学科学院基础医学研究所,济南大学-山东省医学科学院医学与生命科学学院,2山东大学附属济南市中心医院中心实验室, 3山东省移植与组织工程研究中心,山东 济南 250013)
·实验技术·
2种诱导iPSC向神经干细胞分化方法的比较*
杨 坦1, 2, 刘 华2, 3, 汪运山2, 3△
(1山东省医学科学院基础医学研究所,济南大学-山东省医学科学院医学与生命科学学院,2山东大学附属济南市中心医院中心实验室,3山东省移植与组织工程研究中心,山东 济南 250013)
目的: 整体比较2种促进诱导性多能干细胞(induced pluripotent stem cells, iPSC)向神经干细胞(neural stem cells,NSC)分化的方法,确定一种稳定、高效的获得NSC的方法,并对NSC进行系统鉴定。方法: 方法A:SB431542和drosomophorin的浓度均为5 μmmol/L,诱导初始密度100%;方法B:SB431542的浓度为5 mmol/L,drosomophorin的浓度为1 mmol/L,诱导初始密度为40%。比较及鉴定方法: 镜下观察诱导获得NSC的状态;real-time PCR比较神经干细胞相关基因Pax6、nestin、Sox1、Sox2等表达量;流式细胞术分析诱导第16天 Pax6阳性率;免疫荧光定性分析神经干细胞相关蛋白的表达及其自发分化的能力。结果: 方法A获得的NSC悬起后成球趋势明显,圆形,透明;方法B诱导获得NSC形状不规则,色灰暗。Real-time PCR结果证明方法A诱导获得的细胞神经干细胞相关基因的表达量高于方法B。流式细胞术分析证明第16 天,PAX6的阳性率,方法A高于方法B。经鉴定,方法A获得的神经干细胞高表达Pax6、nestin、Sox2等基因自发分化30 d,形成明显的神经纤维束,表达TUJ-1、MAP2及GFAP等神经元和胶质细胞的特异性标志物。结论: 方法A整体优于方法B,我们推荐方法A作为诱导iPSC向神经干细胞分化的方法。
诱导性多能干细胞; 分化; 神经干细胞
神经干细胞(neural stem cells, NSC)可用于建立神经系统疾病的细胞模型,因此在神经系统疾病的机制及治疗的研究中日趋重要[1]。神经干细胞获得有以下几个途径:(1)从流产的胎儿脑组织中分离[2],体外扩增,但该来源有限,且受到伦理约束;(2)人胚胎干细胞(human embryonic stem cells, hESC)体外分化获得[3],此途径细胞来源受限,存在异体间的免疫排斥反应;(3)尿液细胞转分化为神经干细胞[4];(4)经诱导性多能干细胞(induced pluripotent stem cells, iPSC)体外分化获得,该途径来源广泛,无伦理约束,是体外获得NSC的较理想的途径[3-4]。因此寻找一种高效稳定的促进iPSC向NSC分化的方法尤为重要。目前诱导iPSC向NSC分化的方法分为2种。(1)拟胚体(embryoid body,EB)法,通过EB诱导iPSC向NSC分化[5],但EB之间存在异质性,诱导效率不稳定,操作繁琐,不易掌握。(2)单层诱导法,在使用TGF-β和BMP通路的抑制剂的基础上贴壁诱导iPSC向NSC分化[6-7]。该法可操作性强,容易掌握。但单层诱导法在抑制剂浓度及诱导初始密度等方面存在差异,目前应用较多的单层诱导法主要是根据2009年Stuart 等[6]及2012年 Shi 等[7]使用的单层诱导干细胞向神经干细胞分化的方法。为确定一种稳定高效的分化方法,我们比较了这2种方法(前者命名为方法A,后者命名为方法B)诱导神经干细胞的效率及获得的神经干细胞的状态,并对获得的神经干细胞进行系统鉴定。结果证明方法A获得NSC的效率高于方法B,且细胞生存状态要优于方法B。
材 料 和 方 法
1 细胞系和主要试剂
人iPS细胞系是中国科学院广州生物医药与健康院工作人员提取正常人尿液细胞重编程获得并命名为UC5的细胞系。
iPSC培养基:mTeSR1;N2B27培养基: 1% N-2 supplement、99% DMEM/F12、2% B-27 supplement、98% Neurobasal混合物。
Matrigel 基质胶和BD Cytofix/CytopermTM固定液/通透液试剂盒购自BD;0.5 mmol/L EDTA消化酶、accutase 消化酶和DMEM/F12基础培养基购自Gibco;dispase 消化酶、N-2 supplement、B-27 supplement和Neurobasal购自 Life Technologies;SYBR Premix ExTaq 试剂盒购自TaKaRa;anti-Oct4 抗体购自Santa Cruz;anti-Pax6 抗体、anti-nestin polyclonal 抗体和anti-glial fibrillary acidic protein (GFAP)抗体购自Millipore;anti-Sox2 抗体购自R&D; anti-β-tubulin III (TUJ-1)抗体购自Sigma。
2 方法
2.1 iPS细胞传代培养 mTeSR1培养iPS细胞系UC5,待细胞密度达到70%~80%时,0.5 mmol/L 的EDTA消化4~5 min, F12洗1遍, mTeSR1将细胞吹起,1∶3接种于Matrigel预处理的6孔板上。
2.2 诱导iPSC向神经干细胞分化 方法A:6孔板中iPCS密度达到70%~80%,2∶1接种至12孔板,24 h后细胞融合密度几近100%,换诱导分化培养基(N2B27含5 mmol/L SB431542和 5 mmol/L drosomophorin),记为第0 天,隔天全换液。第8 天,巴氏吸管将细胞刮下,1∶2转入 Matrigel 预处理的6孔板中,N2B27培养。第9 天观察,细胞贴壁,换培养基,隔天全换液。第16 天,dispase消化细胞,F12洗1遍,神经干细胞维持培养基(N2B27含20 μg/L EGF和20 μg/L bFGF),将细胞吹起,转入T25的培养瓶中。继续培养1周左右,传代。方法B:6孔板中iPSC密度达到70%~80%,1∶3接种至6孔板中,24 h后细胞密度40%左右,换诱导分化培养基(N2B27含5 mmoL/L SB431542和 1 mmoL/L drosomophorin),记为第0天。此后操作同方法A。
2.3 神经干细胞传代 离心收集神经球,accutase消化15 min,待神经球变松散,F12洗1遍,收集细胞。将其吹成单细胞悬液。移至T25瓶,神经干细胞维持培养基(N2B27含20 μg/L EGF和20 μg/L bFGF)培养。1周左右,神经球较大,颜色变暗,不透明,即可传代。
2.4 实时荧光定量PCR (real-time PCR) 收集诱导第16 天 NSC,Trizol法提取细胞总RNA,使用Thermal Cycler Dice Real Time 系统和SYBR Premix Ex Taq 试剂盒进行real-time PCR,扩增多能性基因Oct4、Nanog及NSC相关基因Pax6、nestin、Sox1、Sox2。GAPDH作为内参照。相关引物序列见表1。

表1 Real-time PCR引物序列表
2.5 流式细胞术检测Pax6阳性率 收集第16 天不同方法诱导的细胞,accutase消化,离心收集细胞,PBS洗1遍,流式固定液常温避光固定20 min,PBS洗1遍,流式专用通透液4 ℃通透10 min,1∶200加入Pax6及同型对照抗体,常温孵育1 h。PBS洗掉抗体,重悬,上机检测。
2.6 免疫荧光分析 将NSC的单细胞或小球种在Matrigel预处理的玻片上,24 h后,4%多聚甲醛常温固定20 min,PBS洗3遍,孵育 I 抗:Oct4(1∶50)、 Pax6(1∶1 000)、nestin(1∶1 000)、Sox2(1∶100)、TUJ-1(1∶1 000)、MAP2(1∶1 000)和GFAP(1∶500),I抗稀释液 (含1% BSA、10% 羊血清和0.3% Triton X-100的PBS) 4 ℃过夜。PBS洗3遍,孵育II抗(1∶500),常温避光1.5 h,PBS洗3遍,常温孵育DAPI(1∶5 000) 5 min,PBS洗3遍,封片。
2.7 神经干细胞自发分化 将神经干细胞单细胞接种在明胶预处理的玻片上,第2 天换自发分化培养基(N2B27含10 μg/L BDNF、10 μg/L GDNF和 1 mg/L cAMP)。培养30 d,免疫荧光检测神经元及星形胶质细胞的特异性标志物TUJ-1、MAP2和GFAP的表达。
3 统计学处理
采用SPSS 17.0统计软件处理。数据以均数±标准差(mean±SD)表示。2组间数据的比较使用t检验。以P<0.05)为差异有统计学意义。
结 果
1 镜下观察不同时间点细胞形态变化
第0天,细胞克隆状生长,典型的干细胞克隆,细胞核大,核仁明显;第12 天左右开始出现花环样结构;第16 天花环结构明显。第19天,方法A获得的P0代神经干细胞聚集成圆球形,透明;而方法B获得的P0代神经干细胞聚集不规则,色灰暗,不透明,见图1。
2 Real-time PCR检测多能性及神经干细胞相关基因的表达

Figure 1.The cell morphology in different days.
Real-time PCR结果显示,第16天方法A诱导获得的细胞其神经干细胞相关基因Pax6、nestin、Sox1和Sox2的表达量明显高于方法B获得的细胞,且差异存在统计学意义(P<0.05),A、B方法诱导获得细胞均不表达多能性基因Oct4和Nanog,见图2。

Figure 2.Comparison of the expression levels of Oct4, Nanog, Pax6, nestin, Sox1 and Sox2 at 16 d.Mean±SD. n=5. *P<0.05 vs A.
3 流式细胞术分析第16 天诱导细胞Pax6的阳性率
流式细胞术结果显示,第16天方法A诱导获得细胞Pax6的阳性率高于方法B,且差异存在统计学意义(P<0.05),见图 3。
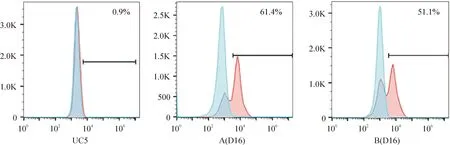
Figure 3.The expression level of Pax6 in the cells induced by method A and method B.
以上结果说明方法A诱导获得的神经干细胞的效率较方法B高,因此我们选择方法A作为诱导iPSC向神经干细胞分化的方法。
4 方法A诱导获得细胞的鉴定
4.1 免疫荧光检测多能性及神经干细胞相关蛋白的表达 免疫荧光结果证明:方法A获得的NSC不表达Oct4,而高表达神经干细胞相关蛋白Pax6、nestin和Sox2,见图4。
4.2 神经干细胞自发分化能力检测 自发分化第30天,镜下可清楚看到神经纤维束,相互交错、连接形成神经网络。免疫荧光结果显示,该细胞表达神经元的特异性标志物TUJ-1和MAP2及星形胶质细胞的特异性标志物GFAP,见图5。

Figure 4.Immunostaining of iPSC (UC5) and NSC for the indicated markers.Scale bar=50 μm.

Figure 5.Spontaneous differentiation of NSC in vitro. A: bright-field images of spontaneously differentiated cells from iPSC (UC5); B: immunostaining of spontaneously differentiated cells for the indicated markers TUJ-1, MAP2 and GFAP.
讨 论
目前体外诱导iPSC向NSC分化的思路:抑制iPS向中、内胚层分化,促进其向极化的神经外胚层转化,进而形成玫瑰花环状的经典神经干细胞,高表达nestin、Pax6、Sox1、Sox2等NSC标志物[4]。而TGF-β、BMP信号通路在这一过程中起到关键性作用[8-10]。因此单层诱导方法是在N2B27培养基的基础上添加TGF-β、BMP通路的小分子抑制剂SB431542和dorsomorphin,贴壁诱导。但抑制剂的浓度及诱导初始密度存在差异,这是否会影响iPSC向NSC分化的效率?对此,我们整体比较了A、B这2种方法,包括抑制剂浓度及诱导初始密度。方法A的SB431542和dorsomorphin的浓度均为5 mmol/L,诱导初始密度100%;方法B的SB431542浓度为5 mmol/L, dorsomorphin的浓度为1 mmol/L,诱导初始密度40%左右。结果证明方法A诱导获得细胞神经干细胞相关基因的表达高于方法B获得的细胞,细胞状态优于方法B,且方法A获得的神经干细胞连续传代性强。用方法A获得的NSC的鉴定结果证明,NSC高表达nestin、Pax6、Sox2等NSC特异性标志物,且可自发分化为神经元、星形胶质细胞。因此,我们推荐方法A作为诱导iPSC向NSC分化的方法。
在诱导分化过程中,我们发现,对于方法A,当诱导密度较小,未达到100%,即换用诱导培养基培养时,细胞状态较差,死亡较多,诱导效率明显受到影响。推测可能由于抑制剂浓度大,细胞毒性大,当密度较小,细胞间空隙较大时,抑制剂对细胞的毒性超过了细胞的耐受能力,因此导致细胞的状态较差,死亡较多。对于方法B,当细胞密度较大时,在诱导至第8天之前,细胞密度达到一定极限,导致细胞漂起,死亡,诱导不能继续。可能由于抑制剂dorsomorphin的浓度较小,细胞毒性小,细胞状态好,增长速度快,密度达到一定极限,继而生长状态下降,最后漂起,死亡。对比2种方法,我们推测抑制剂浓度、细胞毒性及细胞的密度3者之间存在一个平衡点,该平衡点可以维持细胞基本的生存状态至第8 天传代。方法A的抑制剂浓度、细胞毒性与细胞密度达到这个平衡点,故获得的NSC的效率较方法B高,细胞状态好。目前,NSC至少可传至20代左右,但是神经干细胞的增殖能力不强,扩增效率不理想,因此我们将对NSC的增殖能力做进一步的研究。
致谢:中国科学院广州生物医药与健康研究院潘光锦课题组提供了诱导所需的iPS及相关的实验场所和设备,广州生物医药与健康研究院的潘光锦老师、郭易平老师,以及苏整会、李希芮等同学在细胞培养技术和分子生物实验技术方面给予了宝贵的指导和帮助,在此一并致以由衷的感谢!
[1] Aboody K, Capela A, Niazi N, et al. Translating stem cell studies to the clinic for CNS repair: current state of the art and the need for a Rosetta stone[J]. Neuron, 2011, 70(4):597-613.
[2] 李 欣,廖新学,冯鉴强,等. 胚胎海马来源干细胞移植治疗缺血性脑梗死的研究[J].中国病理生理杂志,2009, 25(8):1474-1480.
[3] 陶 靖,葛 坚,陈系古,等. 体外诱导小鼠胚胎干细胞分化为神经干细胞的实验研究[J]. 中国病理生理杂志,2003, 19(3):289-292.
[4] Wang LH, Wang LL, Huang WH, et al. Generation of integration-free neural progenitor cells from cells in human urine[J]. Nat Methods, 2013, 10(1):84-89.
[5] 冯年花,谢 安,王 泱,等.人诱导性多能干细胞向神经干细胞分化的方法探讨 [J]. 中国病理生理杂志,2010, 26(8):1662-1664.
[6] Stuart MC, Christopher AF, Lorenz S, et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling[J]. Nat Biotechnol, 2009, 27(3):275-280.
[7] Shi YC, Peter K, Frederick JL. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks[J]. Nat Protoc, 2012, 7(10):1836-1846.
[8] Boris G, Philippe C, Hans RS, et al. FGF signaling inhibits neural induction in human embryonic stem cells[J]. EMBO J, 2011, 30(24):4874-4884.
[9] Paul AW, Ali Hemmati-Brivanlou. Vertebrate neural induction: inducers, inhibitors, and a new synthesis[J]. Neuron, 1997, 18(5):699-710.
Comparison of 2 methods for inducing iPSC to differentiate into neural stem cells
YANG Tan1, 2, LIU Hua2, 3, WANG Yun-shan2, 3
(1InstituteofBasicMedicine,ShandongAcademyofMedicalSciences,SchoolofMedicineandLifeSciences,UniversityofJinan-ShandongAcademyofMedicalSciences,2CentralLaboratory,JinanCentralHospitalAffiliatedtoShandongUniversity,3ShandongResearchCenterofTransplantationandTissueEngineering,Jinan250013,China.E-mail:sdjnwys@163.com)
AIM: To select an efficient way of promoting induced pluripotent stem cells (iPSC) to differentiate into neural stem cells (NSC) by comparing 2 methods. METHODS: The culture system in method A contained SB431542 (5 mmol/L) and drosomophorin (5 mmol/L) with 100% initial cell density, while that in method B contained SB431542 (5 mmol/L) and drosomophorin (1 mmol/L) with 30%~50% initial cell density. For comparison and identification of the 2 methods, the growth state was observed under microscope, and the expression of Pax6, nestin, Sox1 and Sox2 was quantitatively detected by real-time PCR and flow cytometry . The related protein expression and the ability of spontaneous differentiation were determined by immunofluorescence analysis. RESULTS: The cells derived from method A with 5 mmol/L of SB431542 and drosomophorin and 100% initial cell density achieved the higher expression of Pax6, nestin, Sox1 and Sox2. The growth state was better and the cells differentiated into neurons and astrocytes normally. CONCLUSION: The method A was superior to method B, and we recommend the method A with 5 mmol/L of SB431542 and drosomophorin and 100% initial cell density as the method for differentiating NSC.
Induced pluripotent stem cells; Differentiation; Neural stem cells
1000- 4718(2015)01- 0188- 05
2014- 09- 23
2014- 11- 03
973 计划资助项目(No. 2012CB966503; No. 2012CB966504);国家青年科学基金资助项目(No. 81200950)
△通讯作者 Tel: 0531-85695368; E-mail: sdjnwys@163.com
R33-3
A
10.3969/j.issn.1000- 4718.2015.01.035
