人胃癌及癌旁组织RNA氧化损伤水平的比较及临床意义
2015-04-15林宪慧余俊华林海鸿屠洋洋罗顺斌林型城叶孙志郑志强蔡剑平
林宪慧, 余俊华, 林海鸿, 屠洋洋, 罗顺斌, 徐 涛, 陈 统, 林型城, 叶孙志, 郑志强△, 蔡剑平△
(1温州医科大学附属第二医院,浙江 温州 325027; 2卫生部北京医院,卫生部北京老年医学研究所,卫生部老年医学重点实验室,北京 100730)
人胃癌及癌旁组织RNA氧化损伤水平的比较及临床意义
林宪慧1, 余俊华1, 林海鸿1, 屠洋洋1, 罗顺斌2, 徐 涛2, 陈 统1, 林型城1, 叶孙志1, 郑志强1△, 蔡剑平2△
(1温州医科大学附属第二医院,浙江 温州 325027;2卫生部北京医院,卫生部北京老年医学研究所,卫生部老年医学重点实验室,北京 100730)
目的: 通过检测人胃癌组织及其癌旁组织中的RNA氧化损伤程度,探讨RNA氧化与胃癌发生的相关性。方法: 分别利用免疫组化方法和液相-串联质谱(LC-MS/MS)方法对61例胃癌组织及其癌旁组织中8-氧鸟苷(8-oxoGsn)进行定性和定量分析,并统计分析结果。结果: 免疫组化结果检测显示8-oxoGsn在癌旁组织中含量低,而在胃癌组织中含量明显增高,且棕色染色区域主要集中在肿瘤细胞胞浆位置。质谱检测结果显示胃癌组织中8-oxoGsn含量较对应癌旁组织高,差异有统计学意义(P<0.05)。结论: 8-oxoGsn在胃癌组织中含量增加。RNA氧化损伤可能在胃癌的发生发展过程中起重要作用。
胃肿瘤; 免疫组织化学; 8-氧鸟苷; 液相-串联质谱
十几年前,RNA的氧化损伤很少受到人们的关注。传统的观念认为RNA损伤修复远不如DNA损伤修复重要。然而,随着RNA甲基化损伤修复机制及RNA修复酶的发现,这一观点受到了巨大的挑战。据研究,与其它细胞组分相比,RNA更易受到氧化损伤。Nunomura等[1]采用原位免疫组化法检测了阿尔兹海默病(Alzheimer disease, AD)患者脑组织中的氧化核苷水平,结果显示,大多数氧化核苷是由细胞质RNA氧化而成,而不是细胞核DNA和线粒体DNA。在其它多种神经退行性疾病、表达SOD1G93A突变体的ALS转基因小鼠模型(SOD1G93A小鼠)以及氧化应激细胞培养模型中也观察到这种现象[2-4]。这些研究表明,RNA比DNA更易受到氧化损伤。此外,SOD1G93A小鼠的RNA氧化研究显示[2],症状前期SOD1G93A小鼠的脊髓中,蛋白质羰基化和脂质过氧化水平不升高(或仅轻微地升高),而RNA氧化水平显著升高。这表明RNA可能比蛋白质、脂类更易受到氧化损伤。RNA氧化修饰会干扰翻译过程并使蛋白质合成减少或合成错误蛋白质,这可能会导致细胞退化甚至死亡。也有学者认为RNA氧化可能不是细胞死亡的结果,而是人类多种疾病(如阿尔兹海默病、帕金森病以及肿瘤)发病的一个早期事件[5]。虽然目前很少有文献报道RNA氧化与肿瘤的关系。但是,根据大量的研究,我们发现RNA氧化损伤可能会加速多种人类疾病的恶化。因此为了更加深入的探讨这个问题,笔者研究了RNA氧化损伤与胃癌发生之间的相关性。
细胞正常代谢产生的多种自由基以及外源性自由基中,羟自由基(OH·)具有高反应性,能引起生物大分子(包括RNA)的直接氧化损伤。由于羟自由基的高反应性和不易扩散性,在RNA附近生成的羟自由基可以很容易地对RNA进行氧化修饰。因此,羟自由基介导的氧化修饰作用可能是RNA损伤的重要方式之一。目前发现,羟自由基能损伤20多种不同类型的碱基[6]。其中8-氧鸟嘌呤(8-oxoguanine,8-oxoGua)是最常见的RNA氧化碱基,是公认的最重要的RNA氧化标志物。因此本研究通过免疫组化法对胃癌及癌旁组织中8-氧鸟苷(8-oxoguanosine,8-oxoGsn)进行检测,并利用LC-MS/MS对其进行定量检测,从而来探讨RNA氧化损伤与胃癌发生的相关性。
材 料 和 方 法
1 材料、主要仪器和试剂
人胃癌组织61例及其对应的癌旁组织标本来自于温州医科大学附属第二医院胃肠外科2009~2013年间临床病理确诊的胃癌手术患者。其中男性45例,女性16例,患者临床资料如表1所示,所有患者术前均未行放化疗。取手术切除胃癌组织及癌旁15 cm以上组织,立即放于液氮中保存,该操作均术前告知患者及其家属并签署知情同意书。
Agilent 1290 Infinity液相系统、Agilent 6490 三重四级杆质谱系统、Qualitative Analysis B.06.00及QQQ Quantitative Analysis数据分析软件(Agilent);KUBOTA 3740低温离心机(KUBOTA);分光光度计(Eppendorf);520A型pH计(ORION);JY600C型电泳仪(中国君意东方电泳设备有限公司);超净工作台(中国北京长城空气净化工程公司);烤片机(中国天津天力机电有限公司);冰冻切片机(Thermo)。

表1 组织来源患者的临床病理资料
[13C,15N2]8-oxoGsn (Toronto Research Chemicals);[15N5]Gsn(Cambridge Isotope Laboratories);甲磺酸去铁铵(Sigma);TRIzol(Invitrogen);蛋白酶K(AMERESCO);核酸酶P1(WAKO);碱性磷酸酶(NEB);鼠抗8-oxoGua单克隆抗体(Abcam);RNase-free DNase I(TaKaRa);色谱级甲醇、乙腈、醋酸铵(Fisher Scientific);免疫组化试剂盒PV6000、DAB显色剂、抗体稀释液、伊红、苏木素、丙酮(北京中衫金桥生物科技有限公司);异丙醇、氯仿、乙醇、冰醋酸等试剂均为分析纯(北京化学试剂有限公司)。
2 方法
2.1 免疫组化 将已烘烤2 h并冷却的冰冻切片水化5 min,用1% Triton X-100处理10 min使其破膜;PBS洗涤5 min×3次;37 ℃ DNase 1×106U/L处理1 h,PBS洗涤 5 min×3次;用正常山羊血清室温孵育封闭30 min;吸弃封闭液后滴加适当比例稀释的小鼠来源抗8-oxoGua单克隆抗体(1∶100)之后4 ℃冰箱孵育过夜,PBS洗涤 5 min×3次;3%过氧化氢避光孵育20 min,消除内源性过氧化物酶,PBS洗涤 5 min×3次,以去除残留的过氧化氢;II抗孵育30 min,PBS洗涤 5 min×3次;镜下DAB控制显色,约1 min,用水终止显色;空白对照组用抗体稀释液代替抗体孵育过夜;苏木素染色1 min;盐酸乙醇洗涤3次;水洗10 min;70%乙醇、80%乙醇、90%乙醇、无水乙醇依次脱水2 min;二甲苯Ⅰ、二甲苯Ⅱ 分别透明5 min;明胶封片后镜下观察。
2.2 胃癌组织及癌旁组织RNA抗氧化提取并消化 取适量(约100 mg)组织于研钵,加入液氮,将组织研磨成细粉(防止组织融化);取粉末装于1.5 mL EP管;加入1 mL TRIzol(含1 mmol/L甲磺酸去铁铵,进一步降低RNA在体外的人为氧化),吹打混匀,室温下静置5 min;加入0.2 mL氯仿,盖紧盖子,用手摇匀15 s,室温静置3 min;4 ℃、12 000×g离心10 min;取上层约500 μL至一新的EP管;加入500 μL异丙醇,颠倒混匀,室温放置10 min;4 ℃、12 000×g离心10 min;此时可见白色沉淀,弃上清,加入1 mL 75%乙醇洗涤(0.1% DEPC水配制),4 ℃、10 000×g离心5 min;重复洗涤 1 次;吸弃乙醇;待沉淀干燥后,加入适量0.1% DEPC水(含1 mmol/L 甲磺酸去铁铵);测其吸光度(A)值;根据所测浓度取20 μg RNA于新的EP管中,用0.1% DEPC水定容至79.5 μL;100 ℃金属浴变性3 min,插入冰中急速冷却;加入10 μL核酸酶P1,混匀;37 ℃水浴孵育2 h,期间在30 min和60 min时各混匀1次;加入10.5 μL碱性磷酸酶,混匀;37 ℃水浴孵育1 h,期间在30 min时混匀 1 次;孵育结束后,4 ℃ 10 000×g离心5 min;取90 μL上清于内插管中,加入5 μL [13C,15N2]8-oxoGsn(50 μg/L)和5 μL [15N5]Gsn(25 mg/L),吹打混匀,直接进行质谱检测或保存于-80 ℃。
2.3 LC-MS/MS检测 液相色谱条件:色谱柱采用Agilent ZORBAX SB-Aq Rapid Resolution HT(3.0*100mm)1.8-Micron 600 Bar;流动相:A液为5 mmol/L醋酸铵(pH=3.75),B液为甲醇。梯度洗脱如下:0~5 min:A相从90%~50%,B相从10%~50%;5~5.01 min:A相从50%~90%,B相从50%~10%;5.01~7.5 min:A∶B为90∶10;流速:0.3 mL/min;柱温:35 ℃,进样量2 μL,整个分析时间为7.5 min。质谱条件:电喷雾(ESI)离子源正离子模式,多反应检测扫描(MRM);喷雾器气温:200 ℃;喷雾器气流:14 L/min;喷雾器:20 psi;鞘气流温度:400 ℃;鞘气流流速:11 L/min;毛细管电压:3 500 V;喷嘴电压:1 500 V;驻留时间:100 ms;8-oxoGsn、Gsn及其同位素内标检测离子对参数见表2。
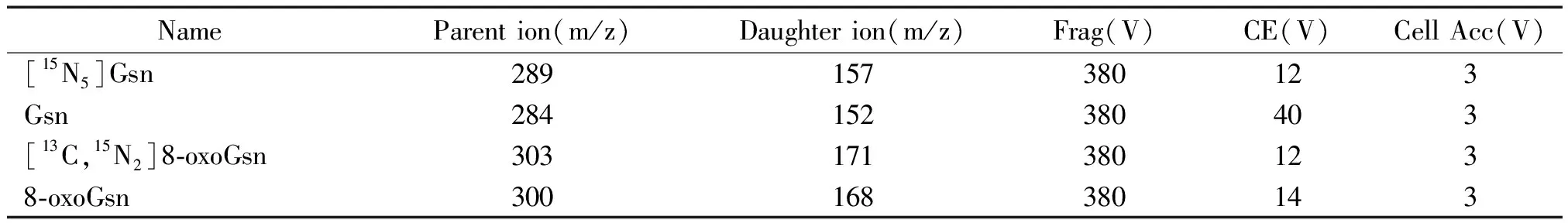
表2 正离子模式下8-oxoGsn、Gsn及其对应的同位素内标的离子源参数
3 统计学处理
采用SPSS 17.0软件统计,数值变量用均数±标准差(mean±SD)表示。用t检验判定2组均数差异显著性,以P<0.05为差异有统计学意义。
结 果
1 8-oxoGua在胃癌组织及癌旁组织中的分布
免疫组化提示胃癌及癌旁组织细胞胞浆中均可以检测到8-oxoGua,而其在胃癌组织中的含量明显增加,见图1。

Figure 1.The results of 8-oxoGua immunohistochemical observation after pre-treatment with DNase in the gastric can-cer tissues and para-carcinoma tissues.
2 LC-MS/MS检测体系的建立
如图2所示,样品中Gsn、8-oxoGsn与其各自的内标[15N5]Gsn、[13C,15N2]8-oxoGsn出峰时间一致,峰形完整、结果可靠,在本实验条件下,8-oxoGsn最低检测量可达0.2 pg。
3 胃癌组织及对应癌旁组织之间RNA氧化程度的差异
本研究用LC-MS/MS检测方法平行检测61组胃癌及癌旁组织RNA中8-oxoGsn及Gsn的含量,RNA氧化损伤程度以每106个Gsn中含8-oxoGsn个数的平均值表示。如图3所示,胃癌组织RNA中8-oxoGsn/106Gsn的含量为5.888±2.932,癌旁组织RNA中8-oxoGsn/106Gsn的含量为4.469±2.876,胃癌组织比癌旁组织高24.1%(P<0.05)。对61例组织进行分型研究发现,胃腺癌或印戒细胞癌中均存在类似现象,见图4,表明RNA氧化损伤可能与胃癌发生之间存在着一定的联系。
讨 论
许多RNA在肿瘤发生发展中发挥着重要作用[7-10],而肿瘤发生发展的重要原因之一是氧化应激水平的增高。氧化应激是指机体在遭受各种有害刺激时,体内高活性分子如活性氧自由基(reactive oxygen species,ROS)等产生过多,氧化程度超出机体氧化物的清除能力,使氧化系统和抗氧化系统失衡,导致组织损伤的过程。对氧化应激量化评价的重要指标主要是测定由活性氧修饰的化合物以及测定活性氧清除酶和抗氧化物质的量。由于我们考虑RNA氧化损伤是否与肿瘤发生发展有密切关系,因此选择了近年被广泛认可的活性氧修饰化合物8-oxoGsn作为氧化标志物。

Figure 2.The LC-MS/MS detection figure of 8-oxoGsn, Gsn and the corresponding isotopic mark.

Figure 3.The levels of 8-oxoGsn in the human gastric cancer and para-carcinoma. Mean±SD. n= 61. *P<0.05 vs para-carcinoma tissue.

Figure 4.The levels of 8-oxoGsn in adenocarcinoma, signet-ring cell carcinoma and their corresponding para-carcinoma. Mean±SD. *P<0.05 vs para-carcinoma tissue.
目前对8-oxoGsn的检测技术大致可以分为两类,即免疫分析法和色谱法[5]。免疫分析法中又分为免疫组化法、免疫荧光法和ELISA法等,免疫组化法和免疫荧光法可用于细胞中8-oxoGsn的定性分析和半定量分析;ELISA方法则可以用于血浆、尿液及其它体液中8-oxoGsn的定量分析。由于受到所用抗体特异性以及其它与底物结构类似物的影响,免疫分析法很难得到准确可靠的定量数据。色谱法因其敏感度高、线性好、分析准确及非特异干扰小的优点而被广泛应用,其中包括HPLC-ECD、GC-MS、LC-MS/MS等。LC-MS/MS因其串联质谱的多反应检测模式可以最大程度提高检测方法的特异性,该方法通过液相色谱阶段分离样品中的杂质,再用串联质谱根据化合物母离子和子离子对的不同来区分生物样品中的8-oxoGsn和Gsn,具有通量高、敏感度高和特异性强的特点。因此,为了更加准确的检测组织中RNA的氧化产物8-oxoGsn的含量,我们采用同位素稀释LC-MS/MS,该检测体系敏感度高,分析准确,非特异干扰小,最低定量可以达到0.2 pg,能够准确地检测胃癌及癌旁组织中的8-oxoGsn的含量。
本研究对RNA氧化损伤重要标志物8-oxoGsn的检测结果表明,胃癌组织中的8-oxoGsn/106Gsn平均值为5.888±2.932,癌旁组织RNA中8-oxoGsn/106Gsn平均值为4.469±2.876,胃癌组织比癌旁组织高24.1%(P<0.05),表明RNA氧化损伤可能与肿瘤发生有关。不同类型胃癌如印戒细胞癌和腺癌中均存在癌组织中RNA氧化程度高于癌旁组织的情况。此外,印戒细胞癌RNA氧化程度明显高于腺癌,也可能与印戒细胞癌例数不够多有关。
也有学者研究了日常饮食是否会对8-oxoGsn和8-oxodGsn的检测结果有影响,他们得出日常饮食并不会影响这些生物分子在尿液中排泄的结论[11]。另外还有研究表明日常饮食对血液中8-oxoGsn和8-oxodGsn的含量也没有影响[12]。还有文献报道8-oxoGsn和8-oxodGsn的水平增高也会出现在其他器官中[13]。而且我们发现胃癌组的8-oxoGsn含量明显高于癌旁组,因此我们可以考虑将8-oxoGsn作为胃癌的一个肿瘤标志物。
[1] Nunomura A, Perry G, Pappolla MA, et al. RNA oxidation is a prominent feature of vulnerable neurons in Alzheimer's disease[J]. J Neurosci, 1999, 19(6):1959-1964.
[2] Chang Y, Kong Q, Shan X, et al. Messenger RNA oxidation occurs early in disease pathogenesis and promotes motor neuron degeneration in ALS[J]. PLoS One, 2008, 3(8):e2849.
[3] Nunomura A, Chiba S, Kosaka K, et al. Neuronal RNA oxidation is a prominent feature of dementia with Lewy bodies[J]. Neuroreport, 2002, 13(16):2035-2039.
[4] Shan X, Lin CL. Quantification of oxidized RNAs in Alzheimer’s disease[J]. Neurobiol Aging, 2006, 27(5):657-662.
[5] Kong Q, Lin CL. Oxidative damage to RNA: mechanisms, consequences, and diseases[J]. Cell Mol Life Sci, 2010, 67(11):1817-1829.
[6] Barciszewski J, Barciszewska MZ, Siboska G, et al. Some unusual nucleic acid bases are products of hydroxyl radical oxidation of DNA and RNA[J]. Mol Biol Rep, 1999, 26(4):231-238.
[7] 郭艳合,张义玲,刘 立,等. 非编码RNA与人类重大疾病的发生及其在生物医学领域内的应用[J]. 中国病理生理杂志, 2009, 25(6):1232-1239.
[8] 蒋 振,郭俊明,肖丙秀. 特异性微小RNA抑制剂对胃癌细胞增殖的影响[J]. 中国病理生理杂志, 2009, 25(9):1726-1730.
[9] 邵永富,蒋孝明,朱梦颖,等. 长链非编码RNA在消化系统肿瘤发生中的作用[J]. 中国细胞生物学学报,2013, 35(9):1357-1366.
[10]王 勇,赵 伟. miR-335靶向Sp1对人骨肉瘤MG-63细胞增殖的调控[J]. 中国病理生理杂志,2013, 29(8):1428-1432.
[11]Gackowski D, Rozalski R, Roszkowski K, et al. 8-Oxo-7, 8-dihydroguanine and 8-oxo-7, 8-dihydro-2’-deoxy-guanosine levels in human urine do not depend on diet[J]. Free Radic Res, 2001, 35(6):825-832.
[12]Cooke MS, Evans MD, Dove R, et al. DNA repair is responsible for the presence of oxidatively damaged DNA lesions in urine[J]. Mutat Res, 2005, 574(1-2): 58-66.
[13]Roszkowski K, Jozwicki W, Blaszczyk P, et al. Oxidative damage DNA: 8-oxoGua and 8-oxodG as molecular markers of cancer[J]. Med Sci Monit, 2011, 17(6):CR329-CR333.
Level and clinical significance of RNA oxidative damage in human gastric cancer and para-carcinoma tissues
LIN Xian-hui1, YU Jun-hua1, LIN Hai-hong1, TU Yang-yang1, LUO Shun-bin2, XU Tao2, CHEN Tong1, LIN Xing-cheng1, YE Sun-zhi1, ZHENG Zhi-qiang1, CAI Jian-ping2
(1DepartmentofGeneral,SecondAffiliatedHospitalofWenzhouMedicalUniversity,Wenzhou325027,China;2TheKeyLaboratoryofGeriatrics,BeijingHospital,BeijingInstituteofGeriatrics,MinistryofHealth,Beijing100730,China.E-mail:zhe-zhi2000@yahoo.com.cn;caijp61@vip.sina.com)
AIM: To investigate the RNA oxidative damage in human gastric cancer tissue and para-carcinoma tissue for exploring the role of RNA oxidation in the occurrence of gastric cancer. METHODS: Immunohistochemical observation and LC-MS/MS analysis were performed in 61 cases of gastric carcinoma. The position and concentration of 8-oxoguanosine (8-oxoGsn) were detected, respectively. RESULTS: The results of immunohistochemical observation showed that 8-oxoGsn was obviously up-regulated in the gastric cancer. The positive staining mainly accumulated in the cytoplasm of the tumor cells. The results of mass spectrometry showed that the level of 8-oxoGsn in the gastric cancer tissues was higher than that in the para-carcinoma tissues (P<0.05). CONCLUSION: 8-oxoGsn is up-regulated in gastric cancer. RNA oxidative damage may play important roles in the occurrence of gastric cancer.
Stomach neoplasms; Immunohistochemistry; 8-oxoguanosine; LC-MS/MS
1000- 4718(2015)01- 0172- 05
2014- 09- 16
2014- 11- 18
△通讯作者 郑志强 Tel: 0577-88653538; E-mail: zhe-zhi2000@yahoo.com.cn; 蔡剑平 Tel: 010-58115039; E-mail: caijp61@vip.sina.com
R735.2
A
10.3969/j.issn.1000- 4718.2015.01.032
