Sox2诱导小鼠胚胎成纤维细胞直接重编程为神经干细胞*
2015-04-15戎利民
刘 畅, 戎利民, 刘 斌
(中山大学附属第三医院脊柱外科,广东 广州 510630)
Sox2诱导小鼠胚胎成纤维细胞直接重编程为神经干细胞*
刘 畅, 戎利民, 刘 斌△
(中山大学附属第三医院脊柱外科,广东 广州 510630)
目的: 探讨Sox2诱导小鼠胚胎成纤维细胞(mouse embryonic fibroblasts, MEFs)直接重编程为神经干细胞的方法,为诱导神经干细胞(induced neural stem cells, iNSCs)作为种子细胞治疗脊髓损伤(spinal cord injury,SCI)奠定实验基础。方法: 逆转录病毒感染Sox2转录因子的MEFs在神经干细胞培养基中贴壁培养10 d。随后,悬浮、贴壁反复循环培养3次。Real-time PCR检测神经干细胞标志基因和多潜能标志基因的表达。iNSCs在分化培养基中贴壁培养7~14 d,免疫荧光分别检测神经干细胞、神经元、星形胶质细胞和少突胶质细胞的标志物nestin、MAP2、GFAP和MBP的表达。将iNSCs显微注射至小鼠大脑皮质,7~14 d后免疫荧光检测神经细胞标志物nestin、MAP2、GFAP和MBP的表达。结果: Real-time PCR显示iNSCs的多种神经干细胞标志基因nestin、Blbp、Pax6和zbtb16表达较诱导前显著增高(P<0.05),且iNSCs不表达多潜能相关基因Nanog、Oct4和zfp42。免疫荧光显示iNSCs高表达神经干细胞标志物nestin。免疫荧光同时表明iNSCs可在体内外存活并分化为神经元、星形胶质细胞和少突胶质细胞。结论: Sox2可以诱导MEFs直接重编程为神经干细胞。iNSCs具有自我更新的能力,且在体内外都具有三向分化潜能,可作为修复SCI合适的种子细胞。
Sox2; 小鼠胚胎成纤维细胞; 直接重编程; 神经干细胞
2006年,Takahashi等[1]首次实现将小鼠和人的体细胞直接重编程为诱导多能干细胞(induced pluripotent stem cells, iPSCs)。随后数年,学者们进一步改进了诱导方法并提高了诱导效率。包括肌萎缩侧索硬化症[2]、脊髓性肌萎缩[3]和帕金森氏病[4]等多种疾病特异性的iPSCs细胞系也成功建立。这些细胞系为相应疾病发病机制的研究提供了极大的便利,并为未来细胞移植治疗提供了一种新的可能。但是,iPSCs诱导成为所需细胞的过程仍复杂漫长。并且,与胚胎干细胞(embryonic stem cells, ESCs)相似,iPSCs在体内存在致瘤性的潜在危险[5]。因此,把体细胞直接转化为所需细胞的直接重编程技术无疑是一种更为便捷和安全的方法。
直接重编程就是一种终末分化的体细胞在转录因子的作用下直接转变为另外一种终末分化的细胞。近年来,多项研究报道在不同组合的转录因子作用下,成纤维细胞可以直接重编程为诱导神经细胞(induced neural cells, iNCs)[6-9]。iNCs表现出与神经元相似的表型和电生理特征,其诱导效率可以达到5%~20%。然而,iNCs作为终末分化细胞不具备自我增殖的能力,这严重限制了iNCs的进一步应用。随后不久,又有研究发现,在3种或者4种转录因子的作用下,小鼠成纤维细胞可以诱导成为具有自我更新和分化能力的诱导神经干细胞(induced neural stem cells, iNSCs)[10-11]。iNSCs是治疗脊髓损伤理想的种子细胞。本研究中,我们仅仅使用一种转录因子Sox2成功诱导小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs)直接重编程为具有自我更新能力和多分化潜能的iNSCs。
材 料 和 方 法
1 材料与试剂
孕13.5 d的CD-1小鼠及8~12周CD-1小鼠(购自北京维通利华实验动物技术有限公司);pMX-Sox2(获赠于干细胞与组织工程研究中心); iPS细胞(购自中国科学院广州生物医药与健康研究院);胎牛血清、DMEM高糖培养基、L-谷氨酰胺、非必需氨基酸(non-essential amino acid,NEAA)、N2添加物(N2 supplement)、B27添加物(B27 supplement)、DMEM/F12培养基、含有EDTA的胰酶、明胶溶液、维甲酸(retinoic acid,RA)购于Sigma;碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和表皮生长因子(epidermal growth factor,EGF)购自Peprotech;兔抗小鼠巢蛋白(nestin)单克隆抗体购自Abcam;兔抗小鼠微管相关蛋白 2(microtubule-associated protein 2,MAP2)单克隆抗体购自Millipore;兔抗小鼠胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)单克隆抗体和兔抗小鼠髓磷脂碱性蛋白(myelin basic protein,MBP)单克隆抗体购自Santa Cruz;Triton X-100 穿膜剂购自天津光复精细化工研究所;牛血清白蛋白(bovine serum albumin,BSA)溶液购自Biosharp; 染核试剂Hoechst 33342购自广州齐云生物公司;甲醇和磷酸盐缓冲液(phosphate-buffered saline solution,PBS)购自广州化学试剂厂。
2 主要方法
2.1 培养基配制 MEF和Plat-E培养基: DMEM 高糖培养基、10%胎牛血清;诱导和神经干细胞培养基: DMEM/F12 培养基、2 mmol/L GlutaMAX、2% B27 supplement;神经干细胞分化培养基: DMEM/F12 培养基、5% 胎牛血清和1 μmol/L RA。
2.2 MEFs和wt-NSCs的提取 颈椎脱臼法处死孕13.5 d的CD-1小鼠。取出胚胎,去除内脏和四肢。保留头部提取wt-NSCs,躯干部位提取MEFs。将相应组织剪碎,0.25%胰酶(含EDTA)室温下消化30 min,用巴氏吸管反复吹打1 min,加入等体积MEFs培养基终止消化。200×g离心5 min,分别培养于MEFs培养基和NSCs培养基。
2.3 Sox2逆转录病毒的包装 提前1 d将Plat-E细胞铺板,次日细胞融合率达到70%~80%即可进行转染。Lipo 2000和pMX-Sox2质粒在Opti-MEM培养基中共同孵育20 min,加入无血清培养基转染Plat-E细胞6~8 h。48 h和72 h分别收取病毒上清液,0.45 μm滤器过滤。过滤后的病毒液与新鲜MEF培养基1∶1混合后感染MEFs。
2.4 逆转录病毒感染MEFs 使用P2~P4代的MEFs作为诱导起始细胞。提前 1 d将MEFs种植在明胶包被的玻璃盖玻片上,第2天和第 3天重复加入Sox2逆转录病毒上清液感染细胞。随后,感染后的MEFs用神经干细胞培养基继续培养。
2.5 Real-time PCR检测 无菌PBS洗3遍,常规Trizol法提取总RNA。使用TaKaRa逆转录试剂盒,随机引物逆转录合成cDNA后进行PCR扩增,各标记物基因引物见表1,PCR反应条件如下:50 °C 2 min,95 °C 10 min;95 °C 15 s,60 °C 30 s,72 °C 36 s,扩增40个循环;95 °C 15 s,60 °C 1 min。数据采用2-ΔΔCt法进行计算分析。

表1 引物序列
2.6 免疫荧光染色 PBS清洗3遍,每次5 min,加入兔抗小鼠nestinⅠ抗(1∶200)、MAP-2Ⅰ抗(1∶1 000)、GFAPⅠ抗(1∶200)及MBPⅠ抗(1∶200),4 °C环境中孵育过夜;第2 天吸除Ⅰ抗溶液,PBS清洗3遍,每次5 min,加入羊抗兔荧光标记Ⅱ抗(1∶50)或驴抗兔荧光标记Ⅱ抗(1∶ 400),室温孵育1 h;吸除Ⅱ抗溶液,PBS清洗3遍,每次5 min,Hoechst 33342染核2~3 min;吸除染核试剂,添加少量PBS后,倒置荧光显微镜下观察。
2.7 iNSCs的分化 iNSCs悬浮培养7 d聚集成球后接种于明胶包被的培养皿中。次日换用含有血清和维甲酸的培养基诱导其分化。继续培养7~14 d,行免疫荧光检测神经元、少突胶质细胞和星形胶质细胞标志物。
2.8 iNSCs移植到小鼠大脑皮质 10%水合氯醛腹腔注射6~8周CD-1小鼠(200 mg/kg),麻醉后用安尔碘消毒皮肤。沿小鼠头部正中线切开皮肤,暴露颅骨,显露矢状缝、冠状缝、前囟。于前囟前1 mm、正中线右侧2.5 mm处,用1 mm颅钻开孔,然后将50 μL微量注射器经骨孔垂直进入3.5 mm,缓慢注入GFP标记的iNSCs悬液。注射完毕后,针头停留15 min,缓慢拔针。缝合皮肤,待其自然苏醒。7 d后处死取材,行免疫荧光染色检测神经细胞标记物。
3 统计学处理
用 SPSS 16.0 统计软件进行分析。数据均采用均数±标准差(mean±SD) 表示,两组间比较采用t检验分析。以P<0. 05 为差异有统计学意义。
结 果
1 小鼠成纤维细胞直接重编程为诱导神经干细胞
感染前的MEFs呈长梭形(图1A),感染后第6天,可以看到MEFs形态发生明显变化。细胞呈现克隆样生长,且各克隆间有相互联系(图1B)。免疫荧光结果显示感染后的细胞Sox2和nestin染色呈强阳性,见图2。
感染后10 d,消化收集细胞后进一步培养和扩增。为了纯化NSC样细胞,我们把细胞种植在低吸附培养皿中。3~4 d后,可以看到神经球样克隆形成(图1C)。把神经球样克隆贴壁培养后可以观察到神经突起样结构从克隆边缘爬出(图1D)。为了进一步纯化和扩增NSC样细胞,我们把克隆反复悬浮和贴壁培养2~3次。如图3所示,第8代和20代NSC样细胞与野生型NSCs形态高度相似。
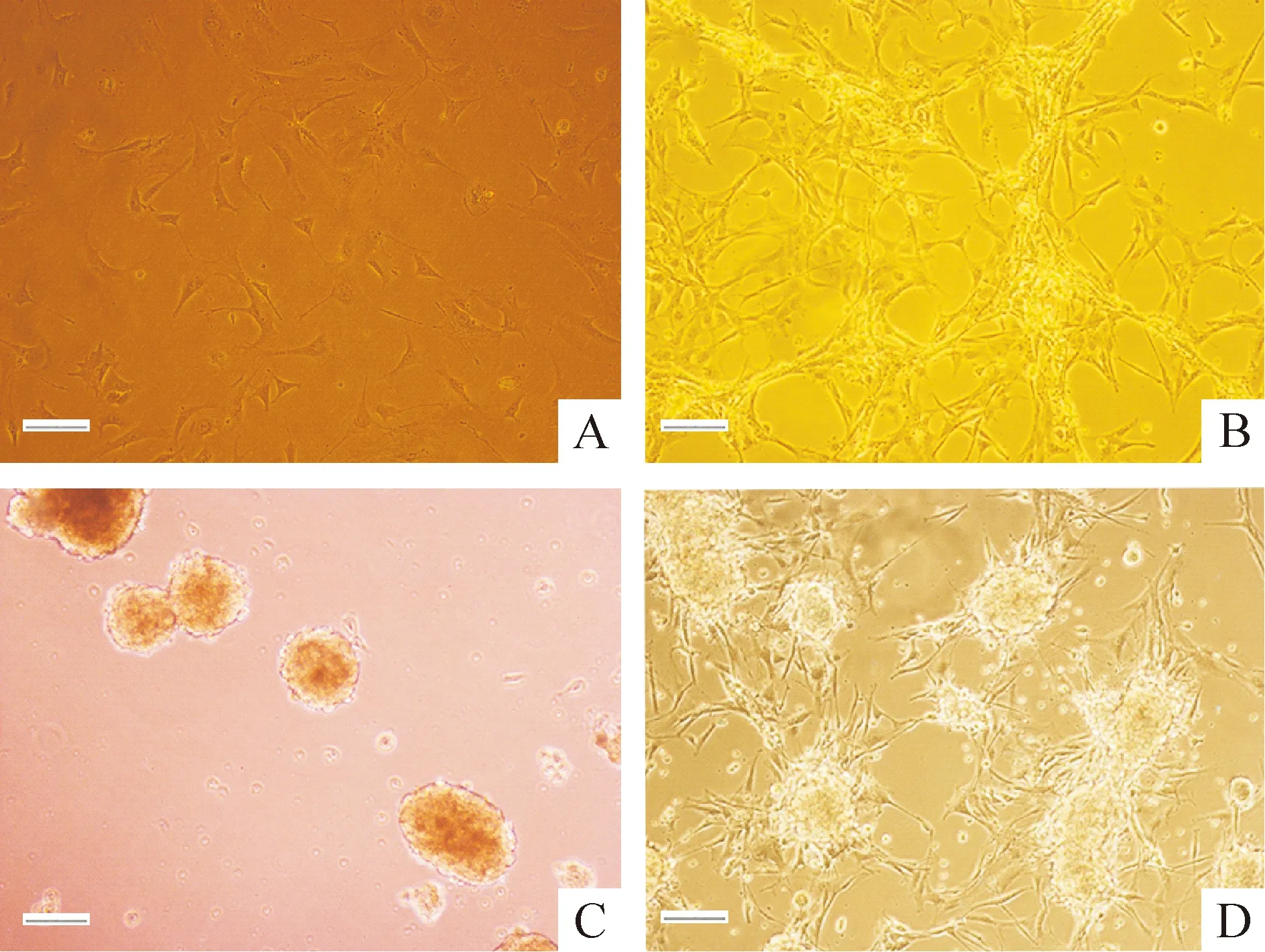
Figure 1.Induction of iNSCs. A: the morphology of MEFs before infection; B: 6 d after infection, the morphology of MEFs was dramatically changed; C: iNSCs formed neurosphere in suspension culture; D: cultured 2 d on gelatin-coated dish.Scale bar=200 μm.
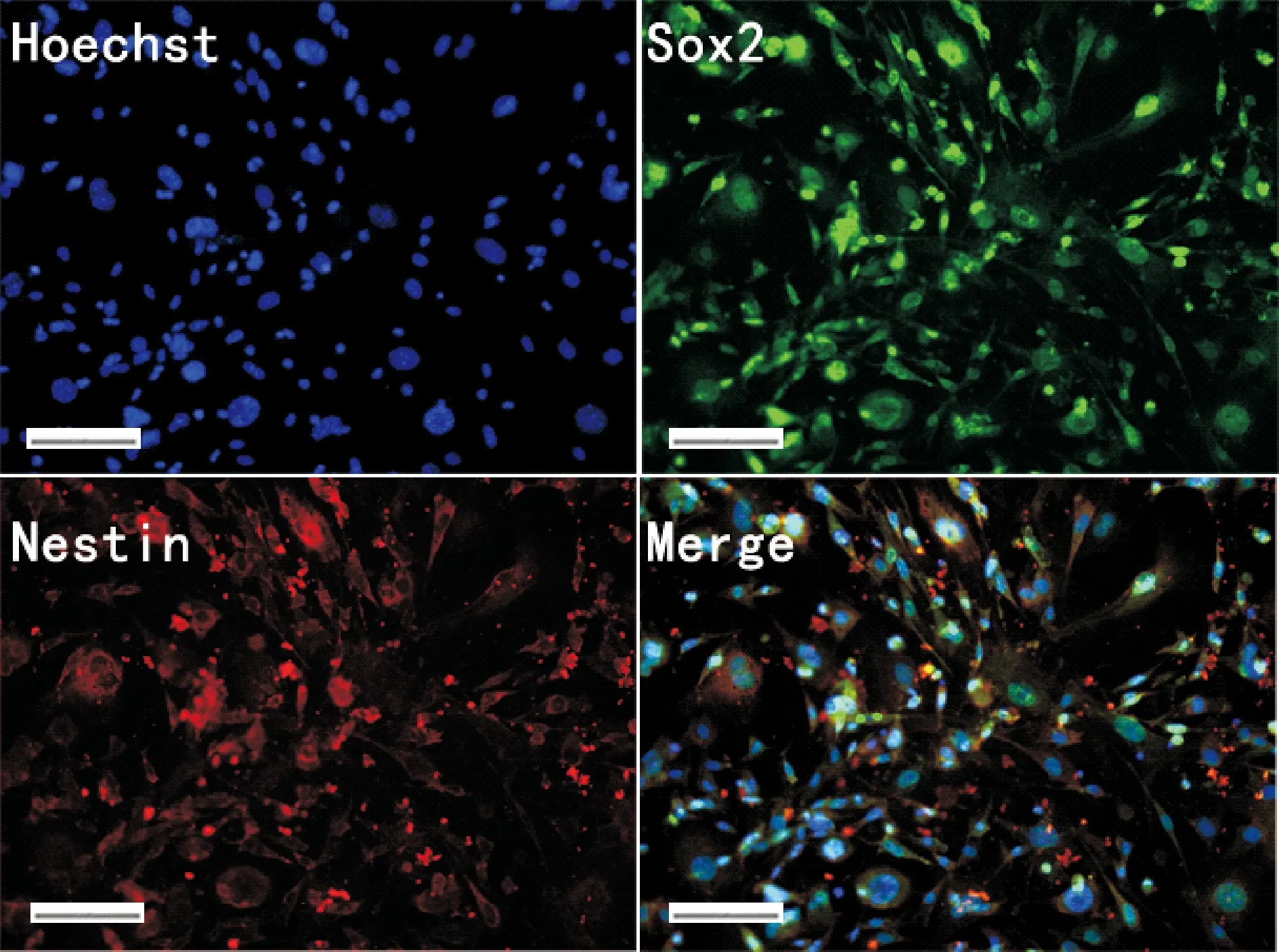
Figure 2.NSC markers were assessed by immunofluorescence, including Sox2 and nestin. Scale bar=100 μm.
2 Real-time PCR鉴定iNSCs
MEFs直接重编程的iNSCs表达多种NSC标志基因,包括nestin、Pax6、zbtb16和Blbp,表达水平较未感染的MEFs组明显增高(P<0.05)。另外,与iPSCs相比,iNSCs不表达多潜能相关基因如Oct4、Nanog和Zfp42(P<0.05),见图4、5。
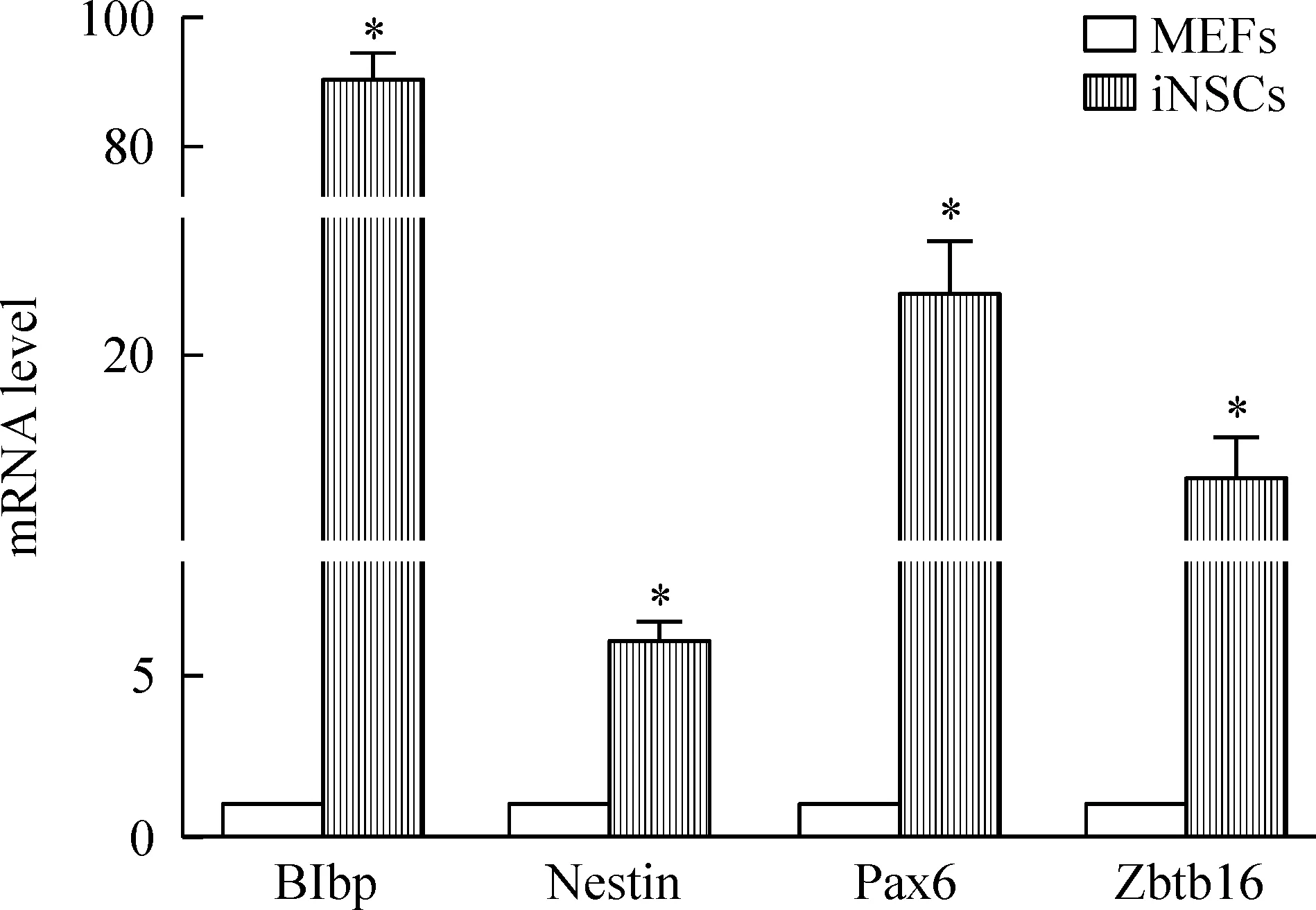
Figure 4.The expression of NSC markers in iNSCs was significantly increased compared with MEFs. Mean±SD.n=3. *P<0.05 vs MEFs.
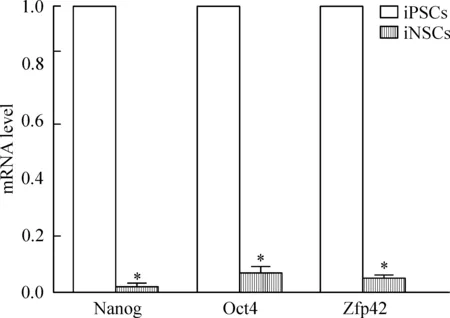
Figure 5.The iNSCs did not express pluripotency-related genes. Mean±SD. n=3.*P<0.05 vs iPSCs.
3 iNSCs在体外具有多分化潜能
在NSC分化培养基(去除生长因子的NSC培养基)中贴壁培养iNSCs。1周后,可见贴壁的神经球周围有神经元爬出(图6)。免疫荧光显示有不成熟神经元标记物神经元Ⅲ类β微管蛋白(neuronal class Ⅲ β-tubulin,Tuj1)染色阳性(图7A)。培养2周,可以观察到成熟神经元(MAP2)染色阳性(图7B)。另外,与wt-NSCs相似,iNSCs也具有分化星形胶质细胞和少突胶质细胞的能力。在特定的培养条件下,7~20 d可以观察到GFAP和MBP染色阳性(图7C、D)。因此,iNSCs具有多分化潜能,可以分化为神经元和多种胶质细胞。
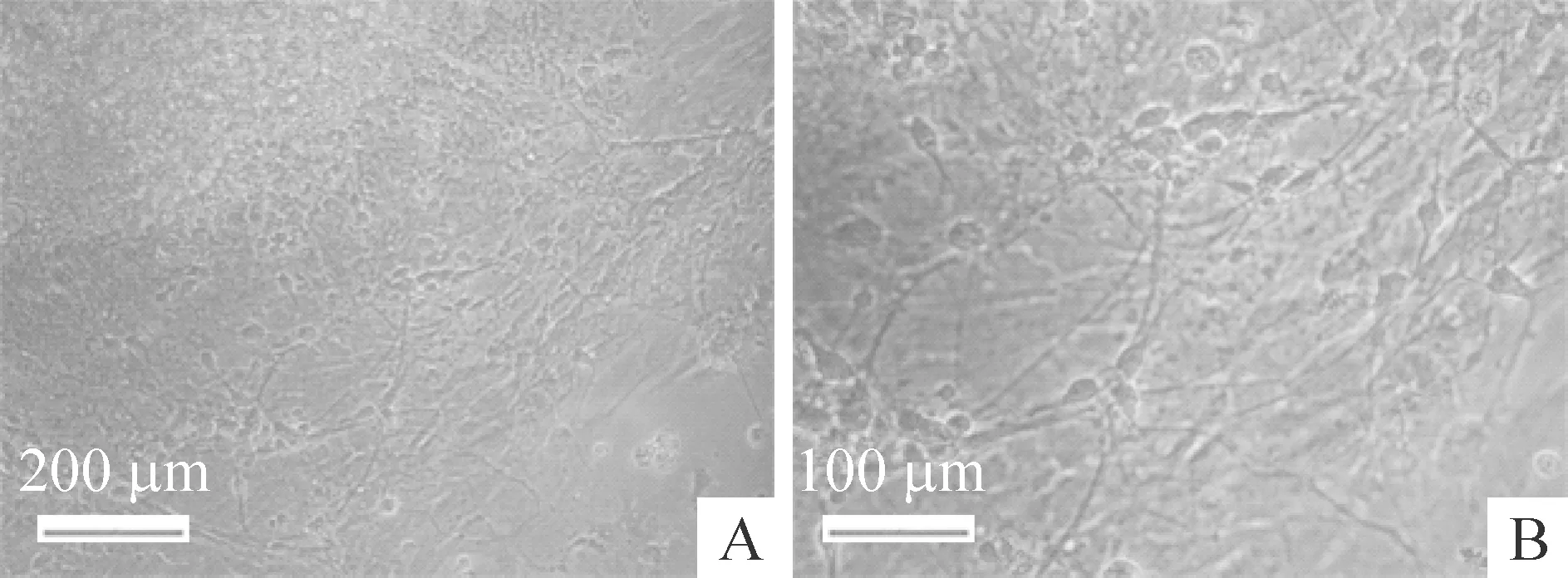
Figure 6.Neurites and neuron-like cells were observed under microscopic observation after neurosphere adherence.
4 iNSCs可以在体内存活和分化
小鼠大脑冰冻切片免疫荧光显示,细胞注射7 d后,可见GFP标记的nestin染色阳性的神经干细胞和MAP2染色阳性的神经元细胞。除此之外,还可以观察到GFAP、MBP染色阳性的星形胶质细胞及少突胶质细胞。这说明iNSCs可以在体内存活且具有多分化潜能,见图8。
讨 论
体细胞直接重编程为具有自我增殖和分化能力的iNSCs对于再生医学的发展有着重大的意义。它可以作为疾病研究的模型来揭示发病机制,可以用于药物筛选和毒性试验,同样还可以作为移植治疗的种子细胞[12]。近几年,很多关于NSCs的研究都把重点放在从ESCs和iPSCs分化获得NSCs。然而伦理学问题和实际应用难度大的短板如ESCs的来源问题和iPSCs的致瘤性[1]始终阻碍了这些方法的发展[13]。利用直接重编程技术诱导体细胞转化为iNSCs是近几年兴起的新技术。该方法很好地规避了iPSCs潜在致瘤性的危险,也比ESCs更容易取材和操作且不会涉及伦理道德问题。直接重编程是取代以上2种方法一个更好的选择。
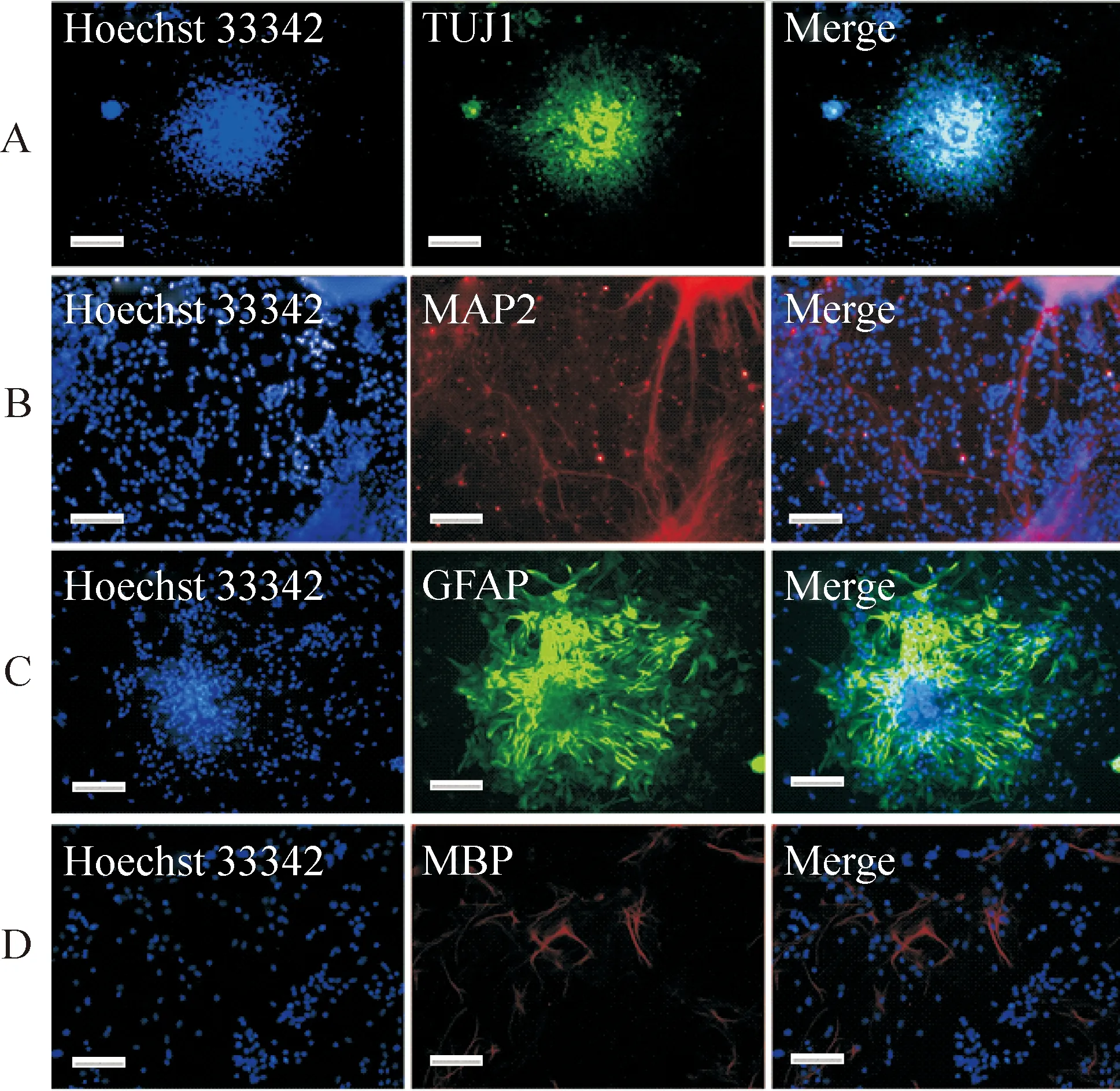
Figure 7.Immunofluorescence staining of differentiated iNSCs in vitro. Neurons, oligodendrocytes and astrocytes were assessed by immunofluorescence for Tuj1 (A), MAP2 (B), GFAP (C) and MBP (D). Scale bar=200 μm.
近几年,有多篇研究报道了体细胞可以直接重编程为iNSCs,不同组合的转录因子被用于诱导体细胞直接重编程为iNSCs。相比其它学者使用多种转录因子诱导直接再编程的发生,本研究仅仅使用了一种转录因子Sox2就成功诱导得到iNSCs。使用更少的转录因子其潜在风险就更小,例如,c-myc是一种原癌基因,且被认为是iPSCs引起畸胎瘤的主要原因。本研究使用的单因子诱导方法更加有利于iN-SCs在未来更为安全地应用于临床。
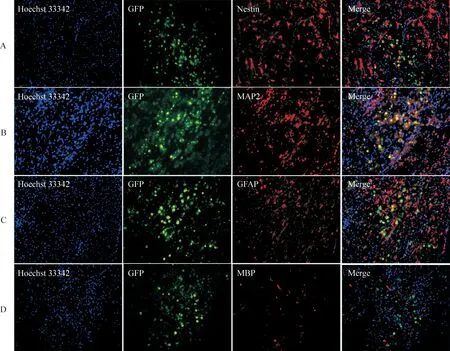
Figure 8.Immunofluorescence staining of iNSCs and differentiated iNSCs in vivo (×200). Neural stem cells, neurons, oligodendrocytes and astrocytes were assessed by immunofluorescence for nestin (A), MAP2 (B), GFAP (C) and MBP (D).
通过直接重编程技术,成纤维细胞可以诱导转化为神经细胞[8-9]。但是,这些终末分化的细胞并不具备干细胞的特性。它们不能高效率的增殖和分化。因此,它很难为未来的细胞移植治疗提供足够的细胞数量。这将严重限制其应用。除此之外,iNCs的细胞表型太过单一,它只表现出神经元或者胶质细胞的特性[7]。然而,神经系统功能的修复往往需要多样化神经元和胶质细胞的共同作用。iNSCs的成功诱导很好地克服了iNCs不能增殖和表型单一的缺点。它具有干细胞特性和多分化潜能。iNSCs可以提供足够的细胞量和丰富的细胞表型。本研究诱导得到iNSCs可以在体内外增殖且具有多分化潜能。
iNSCs是细胞移植治疗很好的种子细胞。然而,要想把iNSCs在最佳治疗窗期间应用于病人,需要继续去探索更多且更有效的提高转化效率的方法[14],足够高的转化效率将是未来学者们努力的一大目标。另外,直接重编程中的另外一个不可忽视的问题是外源基因与细胞基因组的整合问题。无一例外,目前任何一种直接重编程的方法都用到了不同的转录因子和病毒载体[10],其中,慢病毒和逆转录病毒是目前应用最广泛的载体。病毒载体与细胞的整合也可能会带来一些难以预料的后果。不同程度基因插入和染色体整合也可能会给宿主带来不利的影响。因此,需要寻找更好的方法去替代病毒载体转染等方法,那么就有可能建立更加安全、有效、标准化的转化体系。也将更加有利于iNSCs早日成功应用于临床。
[1] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126(4):663-676.
[2] Dimos JT, Rodolfa KT, Niakan KK, et al. Induced pluripotent stem cells generated from patients with ALS can be differentiated into motor neurons[J]. Science, 2008, 321(5893):1218-1221.
[3] Ebert AD, Yu J, Rose FJ, et al. Induced pluripotent stem cells from a spinal muscular atrophy patient[J]. Nature, 2009, 457(7227):277-280.
[4] Park IH, Arora N, Huo H, et al. Disease-specific induced pluripotent stem cells[J]. Cell, 2008, 134(5):877-886.
[5] 庞 卯,杨 阳,刘 斌,等. 小鼠来源诱导多能干细胞定向分化为神经元的体外实验研究[J]. 中国病理生理杂志, 2014, 30(4):763-768.
[6] Ambasudhan R, Talantova M, Coleman R, et al. Direct reprogramming of adult human fibroblasts to functional neurons under defined conditions[J]. Cell Stem Cell, 2011, 9(2):113-118.
[7] Caiazzo M, Dell’Anno MT, Dvoretskova E, et al. Direct generation of functional dopaminergic neurons from mouse and human fibroblasts[J]. Nature, 2011, 476(7359):224-227.
[8] Pang ZP, Yang N, Vierbuchen T, et al. Induction of human neuronal cells by defined transcription factors[J]. Nature, 2011, 476(7359):220-223.
[9] Qiang L, Fujita R, Yamashita T, et al. Directed conversion of Alzheimer's disease patient skin fibroblasts into functional neurons[J]. Cell, 2011, 146(3):359-371.
[10]Han DW, Tapia N, Hermann A, et al. Direct reprogramming of fibroblasts into neural stem cells by defined factors[J]. Cell Stem Cell, 2012, 10(4):465-472.
[11]Lujan E, Chanda S, Ahlenius H, et al. Direct conversion of mouse fibroblasts to self-renewing, tripotent neural precursor cells[J]. Proc Natl Acad Sci U S A, 2012, 109(7):2527-2532.
[12]Ramon-Cueto A, Cordero MI, Santos-Benito FF, et al. Functional recovery of paraplegic rats and motor axon regeneration in their spinal cords by olfactory ensheathing glia[J]. Neuron, 2000, 25(2):425-435.
[13]陶 靖,葛 坚,黄 冰,等. 体外诱导小鼠胚胎干细胞分化为神经干细胞的实验研究[J]. 中国病理生理杂志, 2003, 19(3):289-292.
[14]Brown AK, Woller SA, Moreno G, et al. Exercise therapy and recovery after SCI: evidence that shows early intervention improves recovery of function[J]. Spinal Cord, 2011, 49(5):623-628.
Sox2 induce mouse embryonic fibroblasts direct reprogramming into neural stem cells
LIU Chang, RONG Li-min, LIU Bin
(DepartmentofSpineSurgery,TheThirdAffiliatedHospital,SunYat-senUniversity,Guangzhou510630,China.E-mail:johnliu2001@sina.com)
AIM: To study the direct reprogramming method of mouse embryonic fibroblasts (MEFs) converted into induced neural stem cells (iNSCs). METHODS: Sox2-infected MEFs were cultured in NSCs culture medium for 10 d. Subsequently, repeated suspension and adherent culture were performed for 3 times for the purification of iNSCs. The iNSCs were cultured in suspension medium. Real-time PCR was used to detect the expression of neural stem cell marker genes and pluripotent marker gene.Invivo, iNSCs were microinjected into the mouse cerebral cortex. Immunofluorescence was performed to detect the expression of neural stem cell, neuron, oligodendrocyte and astrocyte markersinvitroandvivo. RESULTS: A variety of neural stem cell marker gene expression was significantly increased in iNSCs detected by real-time PCR. Immunofluorescence confirmed that iNSCs expressed nestin and differentiated into neurons, oligodendrocytes and astrocytesinvitroandvivo. CONCLUSION: Sox2 is sufficient to trigger the direct reprogramming from MEFs to iNSCs. iNSCs have the ability of self-renew and 3 differentiation potentialsinvivoandvitro. iNSCs are the suitable seed cells of SCI.
Sox2; Mouse embryonic fibroblasts; Direct reprogramming; Neural stem cells
1000- 4718(2015)01- 0087- 06
2014- 07- 14
2014- 11- 10
国家自然科学基金资助项目(No. 31170947; No. 31470949; No. 81472122);广东省自然科学基金资助项目(No. S2012020011099; No. S2013010016413); 广东省科技计划(No. 2012B060300008); 教育部博士点新教师基金资助项目(No. 20100171120088); 广州市科技计划(No. 2013J4100062)
△通讯作者 Tel: 020-85252900; E-mail: johnliu2001@sina.com
Q813.5; R318
A
10.3969/j.issn.1000- 4718.2015.01.017
