波动性葡萄糖对胰岛细胞凋亡及PTEN表达的影响*
2015-04-15李晓琳王涤非李国娇曲必成
李晓琳, 王涤非, 邵 晨, 费 宁, 李国娇, 曲必成
(中国医科大学附属第一医院内分泌科,辽宁 沈阳 110001)
波动性葡萄糖对胰岛细胞凋亡及PTEN表达的影响*
李晓琳#, 王涤非△, 邵 晨, 费 宁, 李国娇, 曲必成
(中国医科大学附属第一医院内分泌科,辽宁 沈阳 110001)
目的: 研究细胞凋亡是否与PTEN表达升高相关,并探讨PTEN表达升高是否通过活性氧簇(ROS)进行调控。方法:细胞分为5组:恒定低糖组(L组)、恒定高糖组(H组)、葡萄糖波动组(F组)、高糖后低糖组(HL组)及波动后低糖组(FL组)。检测各组ROS水平、细胞凋亡率、细胞内钙离子浓度、胰岛素水平和PTEN蛋白的表达。结果:F组较H、L组钙离子浓度升高,胰岛素分泌减少,ROS水平升高,PTEN蛋白表达增加,细胞凋亡增多(P<0.05)。HL组较H组钙离子浓度、ROS水平、PTEN蛋白表达和凋亡率有所下降,但仍高于L组(P<0.05)。FL组较F组钙离子浓度、ROS水平、PTEN蛋白表达和凋亡率有所下降,但仍高于低糖组(P<0.05)。结论:波动性葡萄糖较恒定高糖更易导致胰岛细胞凋亡,可能与细胞内钙离子浓度变化,加重氧化应激促进PTEN表达增加有关。葡萄糖浓度恢复可一定程度解除氧化应激,使PTEN表达减少,细胞损伤减轻。
葡萄糖波动; 胰岛细胞; 氧化应激; 细胞凋亡; PTEN
糖尿病是一种慢性代谢性疾病,胰岛素抵抗或缺乏是其主要特征。高血糖可以造成胰岛β数量减少功能减低,以波动性高血糖尤为严重[1]。目前认为可能与血糖波动导致氧化应激密切相关。第10号染色体同源缺失性磷酸酶及张力蛋白(phosphatase and tensin homolog deleted on chromosome ten,PTEN)基因是目前唯一具有双特异磷酸脂酶活性的抑癌基因,是机体细胞生长、分化和维持生命活动的重要生物抑制分子[2-3]。本文将研究胰岛β细胞凋亡是否与PTEN表达升高相关,并探讨PTEN表达升高是否通过活性氧簇(reactive oxygen species,ROS)进行调控。
材 料 和 方 法
1 细胞和材料
胰岛β细胞为大鼠离体胰岛组织提取细胞株,由中国医科大学生物化学实验室刘莹教授馈赠。
无糖1640培养基、1640培养基购自Gibco;活性氧检测试剂盒、Hoechst 33342染色剂和DiI染色剂购自碧云天公司;兔抗鼠PTEN多克隆抗体购自SAB;C肽全自动化学发光测定试剂盒购自深圳市新产业生物医学工程有限公司。
2 方法
2.1 细胞培养 分离的大鼠胰岛β细胞株于含10%胎牛血清、葡萄糖浓度为2 g/L的1640培养基中,5% CO2、37 ℃培养。
2.2 实验分组 本实验分为5组:(1)恒定低糖(low glucose,L)组:在葡萄糖浓度为5.5 mmol/L 的1640培养基中培养72 h;(2)恒定高糖(high glucose,H)组:在葡萄糖浓度为33.3 mmol/L的1640培养基中培养72 h;(3)葡萄糖波动(glucose fluctuation,F)组:在葡萄糖浓度为33.3 mmol/L与5.5 mmol/L的1640培养基每12 h交替培养72 h;(4) 高糖后低糖(HL)组:在葡萄糖浓度为33.3 mmol/L的1640培养基中培养36 h后在葡萄糖浓度为5.5 mmol/L的1640培养基中培养36 h;(5) 波动后低糖(FL)组:按F组方法波动培养36 h后用5.5 mmol/L葡萄糖的1640培养基中培养36 h。
2.3 指标检测 (1)PI和Annexin V双标记法检测细胞凋亡:取1×109/L的悬浮细胞500 μL,离心、弃上清、吹打悬浮,反复3~4次后,加入200 μL binding buffer、10 μL Annexin V室温避光反应15 min,再加入300 μL binding buffer和5 μL PI,1 h内上流式细胞仪检测;并且为观察细胞生长变化置于倒置显微镜下观察细胞形态。(2)化学发光法检测胰岛素水平:离心收集培养细胞后12 h上层培养基,各组取30 μL上机检测胰岛素水平。(3)活性氧检测试剂盒检测各组细胞ROS水平:无血清培养液稀释DCFH-DA至浓度为10 μmol/L,6孔板培养细胞,每孔加DCFH-DA≥1 mL,37 ℃孵育20 min,无血清培养基洗涤3遍,收集细胞于流式细胞仪检测。(4)Fluo3-AM测定细胞内钙离子浓度及荧光显微镜下观察:每组细胞HBSS缓冲液洗涤3次后加入Fluo3-AM工作液,37 ℃孵育30 min;HBSS溶液洗涤3次,HBSS溶液覆盖细胞,37 ℃孵育20分钟。悬浮细胞,分光光度计进行检测,通过公式[Ca2+]i(nmol/L)=Kd(F-Fmin)/(Fmax-F),Kd=450 nmol/L,计算出细胞内钙离子浓度;并于荧光显微镜下观察荧光表达。(5)免疫印迹法(Western blotting)检测各组细胞中PTEN蛋白表达:Folin-酚试剂方法进行蛋白定量;制胶、电泳、转膜、封闭、洗膜,抗兔多克隆PTEN抗体(1∶500)4 ℃孵育过夜。洗膜,1∶10 000辣根过氧化物酶标记山羊抗兔IgG(Ⅱ抗)常温孵育2 h,洗膜,ECL显影曝光。GraphPad Prism 5软件进行灰度值分析。(6)PTEN免疫荧光染色:固定细胞,封闭液封闭, PTEN I抗(1∶100)4 ℃孵育过夜。洗涤,Ⅱ抗(抗兔FITC,1∶500稀释)避光反应2 min,洗涤,DiI避光反应5 min,洗涤,Hoechst 33342 4 ℃避光反应20分钟,洗涤,抗淬灭后倒置荧光显微镜下观察。
3 统计学处理
每组数据留取20组样本,取平均值,并采用SPSS 17.0软件进行数据分析,数据以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 细胞凋亡
PI和Annexin V双标记法检测细胞凋亡,结果如表1所示。L、H、F组细胞凋亡率呈阶梯增高,两两比较均有统计学意义(P<0.05),HL组较H组、FL组较F组凋亡率下降(P<0.05)。
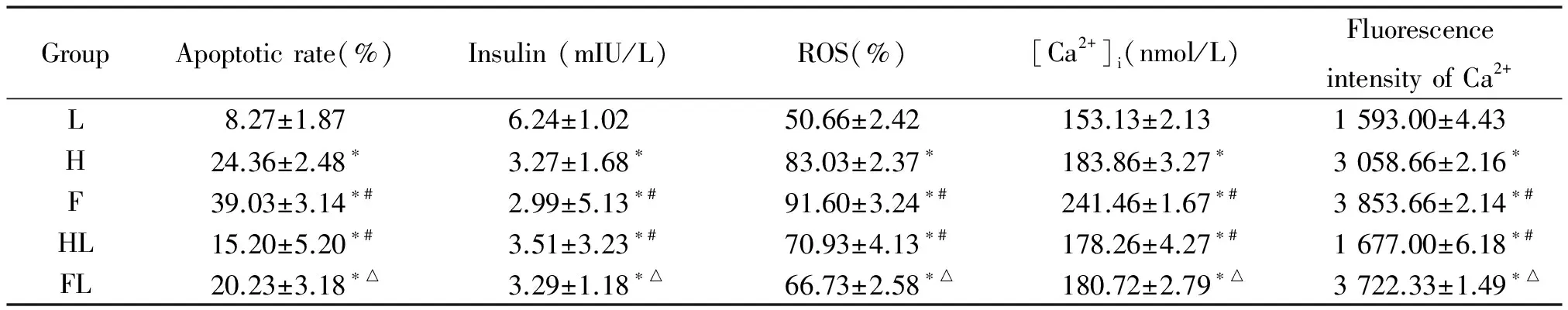
表1 胰岛β细胞经不同处理其细胞凋亡率、胰岛素分泌水平、ROS生成、细胞内钙离子浓度和钙观察荧光强度的变化
*P<0.05vsL;#P<0.05vsH;△P<0.05vsF.
40倍相差显微镜下观察,L组细胞团呈圆形或椭圆型, 大小不一,有完整而清晰的被膜;H组形状不规则,被膜不完整,出现发泡现象,细胞核固缩,细胞数量减少;F组细胞形成凋亡小体,坏死细胞呈簇状漂浮;HL组及FL组细胞凋亡分别较H、F组有所减轻,细胞数目增多,见图1。

Figure 1.The morphological changes of the islet cells with different treatments observed under inverted microscope (×40).
2 胰岛素水平检测
如表1所示,相同数目的细胞在不同环境培养后,其分泌蛋白胰岛素水平受到不同程度影响。
3 氧化应激
L、H、F组细胞ROS水平呈阶梯增高(P<0.05),HL组较H组、FL组较F组ROS水平降低(P<0.05)。
4 细胞内钙离子浓度测定及荧光显微镜观察并定量分析
L、H、F各组细胞内钙离子浓度逐渐升高,两两比较均有统计学意义(P<0.05),葡萄糖浓度恢复后钙离子浓度降低,见表1。
Fluo3-AM染色后在20倍荧光显微镜下观察荧光强度并用流式细胞技术定量分析,结果显示低糖组与恒定高糖组及葡萄糖波动组比较细胞染色数量及荧光强度依次递增;高糖后低糖组较恒定高糖组荧光数量减少,荧光强度减低;波动后低糖组较葡萄糖波动组荧光数量减少,荧光强度减低,见图2、表1。
5 细胞中PTEN蛋白的表达及免疫荧光观察
F组及H组较L组PTEN蛋白表达水平增加(P<0.05),F组较H组增加(P<0.05),HL、FL组PTEN蛋白表达分别较H、F组下降(P<0.05),见图3。
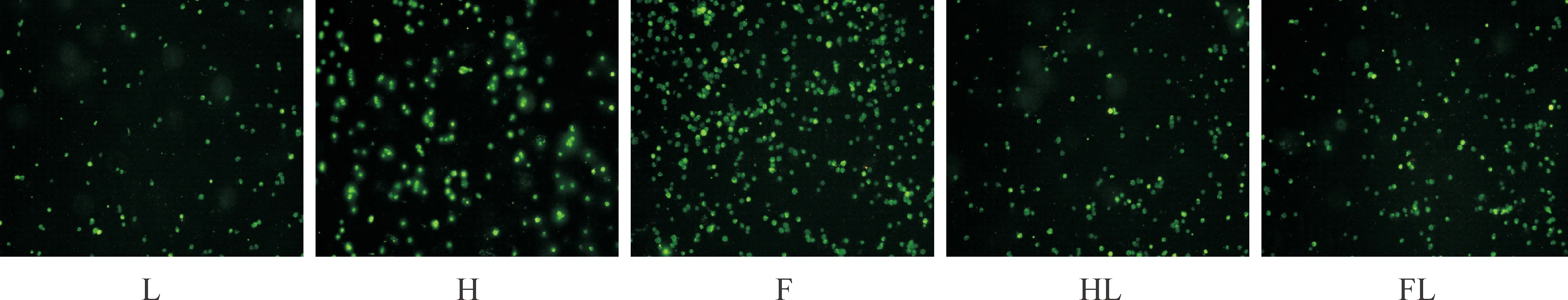
Figure 2.The morphological changes of the islet cells with different treatments observed under fluorescence microscope with Fluo3-AM staining (×20).
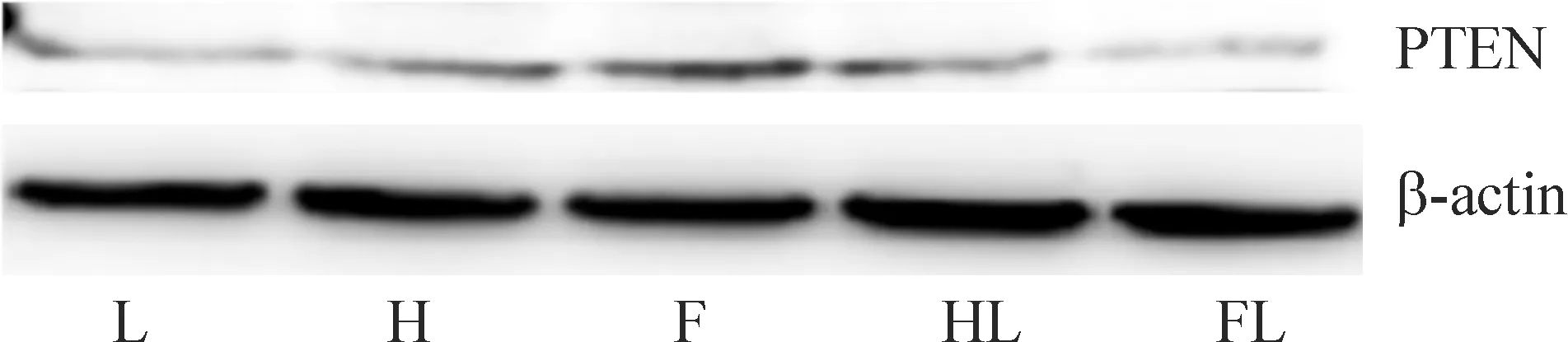
Figure 3.The protein expression of PTEN in the islet cells with different treatments detected by Western blotting.
在荧光纤维镜下观察胰岛β细胞PTEN表达,可见Hoechst 33342可以将细胞核染成蓝色,DiI将细胞膜染成橙红色,含有FITC标记的山羊抗兔IgG抗体可以将细胞标记成绿色。40倍倒置荧光显微镜观察L、H、F组细胞核及胞浆处PTEN表达逐渐增多,高糖后低糖各组PTEN表达减少,荧光强度减弱。此结果与Western blotting方法检测各组细胞中PTEN蛋白产物表达含量相一致,见图4。
讨 论
糖尿病(diabetes mellitus,DM)是常见的内分泌代谢性疾病,以血浆葡萄糖水平增高为特征。任何一种糖尿病都离不开胰岛细胞凋亡所致的胰岛素缺乏[4-5]。临床上慢性高血糖有2种表现形式,即慢性持续性高血糖(sustained high glucose,SHG)和波动性高血糖(intermittent high glucose,IHG)。有研究表明血糖波动对糖尿病患者的影响可能大于单纯性高血糖[6-7]。Hou等[8]研究发现波动性高血糖可进一步放大高血糖对β细胞造成的氧化应激损伤,加重β细胞凋亡及功能障碍[9]。本实验针对高血糖引起胰岛细胞凋亡进行研究,以进一步论证细胞在恒定、波动高糖以及高糖后低糖条件下通过氧化应激诱导细胞凋亡的情况。
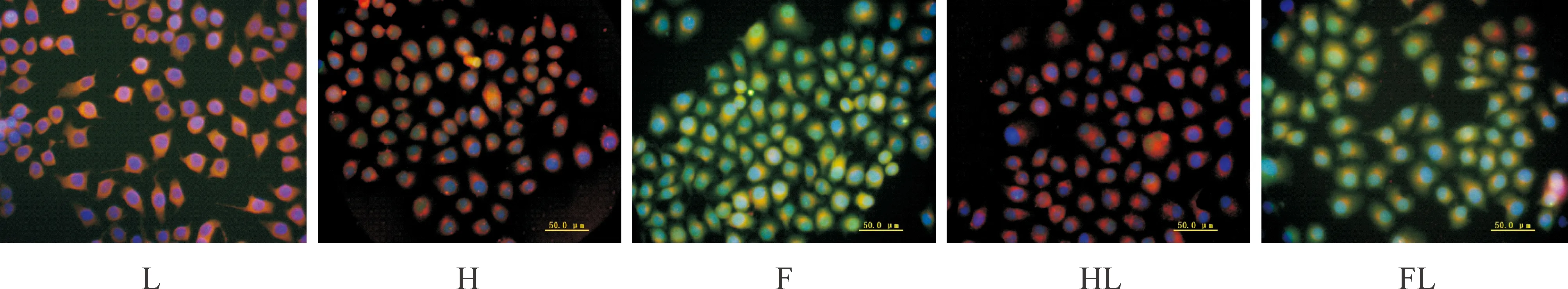
Figure 4. The protein expression of PTEN in the islet cells with different treatments observed under fluorescence microscope (×40).
氧化应激是指机体在遭受各种有害刺激时体内氧化剂和抗氧化剂平衡被打破,产生潜在伤害。机体抗氧化剂减少或者抗氧化能力下降时,可产生ROS。过量的ROS会使脂质发生过氧化、引起蛋白质变性交联、DNA断裂等,直接导致细胞损伤[10]。线粒体是ROS形成的主要场所,也是最早和最容易受到 ROS攻击的细胞器[11],线粒体功能紊乱时,细胞膜脂质过氧化,引起线粒体膨胀及外膜破裂,炎症介质外漏,激活细胞凋亡通路,产生更多的ROS,形成恶性循环[12]。总之,氧化应激是造成胰岛β细胞“葡萄糖毒性”的重要机制之一[13]。
葡萄糖代谢使胞内ATP/ADP 的比值增加,关闭钾离子通道,钙离子通道开放,胞内Ca2+浓度的升高,导致含胰岛素囊泡的释放。由此可见,细胞内Ca2+作为第二信使,在胰岛素分泌过程中起着重要的作用。作为氧化应激主要场所的线粒体也同样受到胞内钙离子浓度的影响。当葡萄糖浓度升高时,Ca2+流入细胞内的同时氧化应激产生大量ROS,可破坏线粒体内膜两侧的电化学梯度,阻止线粒体对Ca2+的进一步摄取,胰岛素分泌下降。当葡萄糖浓度持续升高,胰岛β细胞凋亡,功能障碍,数量减少,胰岛素分泌进一步减少。当葡萄糖浓度恢复至正常一段时间后,线粒体内外膜两侧及氧化应激恢复平衡,实验结果提示ROS水平降低,细胞内Ca2+浓度下降,胰岛素分泌增多,细胞凋亡减少,细胞状态是可逆的,但仍无法恢复至低糖培养的细胞状态。
PTEN基因是1997年由美国3个独立研究小组在人类第10号染色体上发现的一个新的抑癌基因[14]。PTEN蛋白的结构包括3个部分,其中尾区是PTEN的磷酸化区域,PTEN磷酸化后其活性减低,稳定性增强,处于失活状态,相反则可增强PTEN活性。对于PTEN的细胞定位,长期以来存在争论,而近些年来,不同细胞的研究结果表明,PTEN主要分布于细胞质中,细胞核内也有表达,而只有很少的蛋白存在于细胞质膜上[15]。
PTEN蛋白主要通过PI3K/Akt、局部黏着斑激酶(focal adhesion kinase,FAK)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)3条信号通路发挥作用,调控细胞迁移、增殖及生长[16]。目前研究比较多的是第1条通路。磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)在细胞生长因子的作用下在细胞膜产生3,4,5-三磷酸磷脂酰肌醇(phosphatidylinositol 3,4,5-trisphosphate,PIP3)和4,5-二磷酸磷脂酰肌醇(phosphatidylinositol 4,5-bisphosphate,PIP2),PIP2可在PI3K的作用下磷酸化为PIP3,PIP3使Akt与细胞膜结合锚定并释放下来,活化的Akt与其它相关蛋白能启动一系列蛋白激酶的级联反应,通过磷酸化下游不同的底物调控着细胞周期、细胞生长及细胞代谢等。研究发现,PTEN蛋白主要是针对底物PIP3的调节,对PI3K通过脂质磷酸酶活性发挥负调控的功能。而PTEN使PIP3脱磷酸,使PIP2向PIP3的转化发生逆转,使PIP3含量减少,抑制Akt及其下游激酶的活性,抑制细胞生长和促进凋亡,因此PTEN是一个很有效的PI3K信号通路的负性调节因子[17-18]。
也有报道称氧化应激产生的H2O2可以氧化抑制PTEN的活性,使细胞内PI3K活性增强和PIP3浓度升高;而在敲除PTEN基因后,H2O2刺激则对PI3K活性和PIP3浓度无影响[19]。目前认为该作用与PTEN蛋白络氨酸磷酸酶活性有关,氧化失活成为调节PTEN活性的重要方式[20]。
PIP2是一个重要的内源性的ATP敏感性钾离子通道调节因子,因此PTEN可能通过PIP2间接使KATP通道开放,减少胰岛素分泌。同时三磷酸脂肌醇激酶和Akt的活化还参与胰岛素介导的葡萄糖摄入和糖原合成。本实验也证实了在PTEN高度表达的细胞组细胞胰岛素分泌量下降,细胞凋亡率增加。由此可以进一步说明PTEN与2型糖尿病疾病的发生发展关系密切。
本课题以大鼠β细胞为研究对象,通过设定不同的培养条件,检测相关指标,旨在通过研究波动高糖下PTEN对胰岛细胞氧化应激及凋亡相关因素的影响。研究发现,ROS可以诱导细胞凋亡,通过细胞内钙离子浓度的变化影响氧化应激,胰岛素分泌。本研究也证实了高糖后葡萄糖浓度恢复正常后胰岛细胞凋亡率下降,胰岛细胞功能恢复。PTEN通过脂质磷酸酶活性和蛋白酪氨酸磷酸酶活性对细胞的生长及凋亡进行调节,PTEN能够通过PI3K/Akt途径促进细胞凋亡,同时氧化应激也参与PTEN活性的表达,在胰岛细胞,还能间接影响胰岛素受体底物通路,减少胰岛素分泌,影响胰岛细胞功能。
综上所述,胰岛β细胞凋亡的机制十分复杂,尤其对于PTEN蛋白的研究还不够深入,比如PTEN在诱导胰岛细胞钙离子内流机制及胰岛细胞高糖后恢复机制还有待研究。了解胰岛β细胞凋亡的病因学机制对于人们更深入地认识糖尿病的发生发展,更好地防治糖尿病具有重要的临床意义。
[1] Li Volti G, Sorrenti V, Murabito P, et al. Pharmacological induction of heme oxygenase-1 inhibits iNOS and oxidative stress in renal ischemia-reperfusion injury[J]. Transplant Proc, 2007, 39(10):2986-2991.
[2] Cotter L, Ozçelik M, Jacob C, et al. Dlg1-PTEN interaction regulates myelin thickness to prevent damaging peri-pheral nerve overmyelination[J]. Science, 2010, 328(5984):1415-1418.
[3] Rigoutsos I, Furnari F. Gene-expression forum: Decoy for microRNAs[J]. Nature, 2010, 465(7301):1016-1017.
[4] Ashkenazi A, Dixit VM. Death receptoes: signaling and modulation[J]. Science, 1998, 281(5381):1305-1308.
[5] Rhodes CJ. Type 2 diabetes-a matter of β-cell life and death?[J]. Science, 2005, 307(5708):380-384.
[6] Azuma K, Kawamori R, Toyofuku Y, et al. Repetitive fluctuations in blood glucose enhance monocyte adhesion to the endothelium of rat thoracic aorta[J]. Arterioscler Thromb Vasc Biol, 2006, 26(10): 2275-2280.
[7] Piconi L, Corqnali M, Da Ros R, et al. The protective effect of rosuvastatin in human umbilical endothelial cells exposed to constant or intermittent high glucose[J]. J Diabetes Complications, 2008, 22(1):38-45.
[8] Hou ZQ, Li HL, Gao L, et al. Involvement of chronic stresses in rat islet and INS-l cell glucotoxicity induced by intermittent high glucose[J]. Mol Cell Endocrinol, 2008, 291(1-2):71-78.
[9] Finkel T. Oxidant signals and oxidative stress[J]. Curr Opin Cell Biol, 2003, 15(2):247-254.
[10]Schumacker PT. Reactive oxygen species in cancer cells: live by the sword, die by the sword[J]. Cancer Cell, 2006, 10(3):175-176.
[11]Krauss S, Zhang CY, Scorrano L, et al. Superoxide-me-diated activation of uncoupling protein 2 causes pancreatic beta cell dysfunction[J]. J Clin Invest, 2003, 112(12):1831-1842.
[12]Robertson RP, Harmon J, Tran PO, et al. Glucose toxicity in beta-cells: type 2 diabetes, good radicals gone bad, and the glutathione connection[J]. Diabetes, 2003, 52(3):581-587.
[13]Leslie NR, Downes CP. PTEN: the down side of PI3-kinase signalling[J]. Cell Siqnal, 2002, 14(4):285-295.
[14]Okumura K, Mendoza M, Bachoo RM, et al. PCAF modulates PTEN activity[J]. J Biol Chem, 2006, 281(36):26562-26568.
[15]Tamura M, Gu J, Danen EH, et al. PTEN interactions with focal adhesion kinase and suppression of the extracellular matrix-dependent phosphatidylinositol 3-kinase/Akt cell survival pathway[J]. J Biol Chem, 1999, 274(29):20693-20703.
[16]Trotman LC, Wang X, Alimonti A, et al. Ubiquitination regulates PTEN nuclear import and tumor suppression[J]. Cell, 2007, 128(1):141-156.
[17]Baker SJ. PTEN enters the nuclear age[J]. Cell, 2007, 128(1):25-28.
[18]Backman SA, Stambolic V, Suzuki A, et al. Deletion of PTEN in mouse brain causes seizures,ataxia and defects in soma size resembling Lhermitte-Duclos disease[J]. Nat Genet, 2001, 29(4):396-403.
[19]Cho SH, Lee CH, Ahn Y, et al. Redox regulation of PTEN and protein tyrosine phosphatases in H2O2-mediated cell signaling[J]. FEBS Lett, 2004, 560(1-3):7- 13.
[20] Lee SR, Yang KS, Kwon J, et al. Reversible inactivation of the tumor suppressor PTEN by H2O2[J]. J Biol Chem, 2002, 277(23):20336-20342.
Effects of intermittent high glucose on apoptosis and PTEN expression in islet cells
LI Xiao-lin, WANG Di-fei, SHAO Chen, FEI Ning, LI Guo-jiao, QU Bi-cheng
(DepartmentofEndocrinology,TheFirstHospitalofChinaMedicalUniversity,Shenyang110001,China.E-mail:wdf8lm@163.com)
AIM: To investigate whether the increase in PTEN expression is related to apoptosis, and whether it is regulated by reactive oxygen species(ROS). METHODS: The rat islet cells were divided into constant low glucose group (group L), constant high glucose group (group H), glucose fluctuation group (group F), low glucose after high glucose group (group HL) and low glucose after fluctuation group (group FL). The ROS level, apoptotic rate, intracellular calcium, insulin release and PTEN protein expression were analyzed. RESULTS: Compared with groups H and L, the insulin secretion decreased, and intracellular calcium, ROS level, PTEN protein expression and apoptotic rate increased in group F (P<0.05). Compared with group H, the intracellular calcium, ROS level, PTEN protein expression and apoptotic rate in group HL decreased, but were still higher than those in group L (P<0.05). Compared with group F, the intracellular calcium, ROS level, PTEN protein expression and apoptotic rate in group FL decreased, but were still higher than those in group L (P<0.05). CONCLUSION: Glucose fluctuation can cause the apoptosis of islet cells more easily than constant high glucose. This may be related to the change of intracellular calcium and increase in oxidative stress which promotes PTEN expression. The recovery of glucose level to some extent relieves oxidative stress, decrease PTEN expression and reduce cell damage.
Glucose fluctuation; Islet cells; Oxidative stress; Apoptosis; PTEN
1000- 4718(2015)03- 0557- 05
2014- 04- 02
2015- 01- 08
辽宁省科技计划(No.2012225079;No.2012225020);沈阳市科技计划项目(No.F13-221-9-02)
△通讯作者 Tel: 024-83283765; E-mail: wdf8lm@163.com
#现工作单位:沈阳医学院附属第二医院内分泌科
R363.2; R587.1
A
10.3969/j.issn.1000- 4718.2015.03.031
