阿尔茨海默病患者尿液细胞向诱导多能干细胞及神经细胞的诱导转化*
2015-04-15蔡秀娟雷清锋
韦 睿, 李 中, 蔡秀娟, 何 露, 雷清锋
(1中山大学附属第六医院神经科,广东 广州 510655; 2中国科学院广州生物医药与健康研究院,广东 广州 510530)
阿尔茨海默病患者尿液细胞向诱导多能干细胞及神经细胞的诱导转化*
韦 睿1,2, 李 中1△, 蔡秀娟2, 何 露1, 雷清锋1
(1中山大学附属第六医院神经科,广东 广州 510655;2中国科学院广州生物医药与健康研究院,广东 广州 510530)
目的: 获得阿尔茨海默病(Alzheimer disease,AD)患者来源的诱导多能干细胞(induced pluripotent stem cells,iPSCs)。方法: 选取3例临床诊断明确的AD病例,收集病人尿液,分离出尿路上皮细胞,对所得细胞进行原代培养。利用电转染的方法将带有Oct4、Sox2、Klf4和SV40LT的质粒导入原代细胞内,将其重编程为iPS细胞。随后利用双向抑制Smad通路的方式继续诱导其神经分化。结果: AD病人尿液来源的细胞(以下称为尿液细胞)均成功诱导成iPS细胞,其诱导效率与正常人来源的细胞无明显差异。且病人的iPS细胞可成功分化为神经细胞,分化效率亦与正常人来源细胞相近。结论: 阿尔茨海默症患者来源的尿液细胞可重编程为iPS细胞,所得到的iPS细胞可成功分化成有功能的神经元以及神经胶质细胞。
阿尔茨海默病; 诱导多能干细胞; 神经分化
随着老龄化社会的到来,阿尔茨海默病(Alzheimer disease,AD)的发病率逐年增高,但迄今为止AD的病因与致病机制仍不明,治疗方面也无重大突破。散发性AD(sporadic AD,sAD),占AD发病人数的90%以上,虽有一定的家族聚集倾向,但其发病无法归咎于某个特定基因的异常。截至2009年,人们通过全基因组关联分析(genome-wide association study,GWAS)共发现20多个sAD相关基因[1],但这些基因如何致病仍然不清楚。目前sAD的发病被归结于遗传与环境等多因素作用的结果。
2006年底,诱导多能干细胞(induced pluripotent stem cells, iPSCs)技术由日本学者Takahashi等[2]首次在Cell杂志上发表,在生物及医学界引起了巨大轰动。由于iPSCs能够携带某些疾病患者特异性基因,并且有向各种组织分化的潜能,因此很快被广泛用于建造包括AD在内的多种疾病模型[3-6]。2012年,Israel等[7]同时用2例淀粉样蛋白前体基因突变的家族性AD(familial AD, FAD)患者及2例sAD患者来源的iPS细胞分化成为神经细胞,FAD检测出了与其基因突变相一致的病理表型,包括Aβ、p-tau的高表达等。有意思的是,2例sAD患者中有1例也出现了与FAD一致的表型,而这例病人并没有任何FAD相关的基因异常。2013年,Kondo等[8]也在1例sAD患者iPSCs分化来源的神经细胞中发现了AD相关病理表型——Aβ寡聚体升高。这些发现提示在sAD患者的基因组中,或许还存在着某些未知的致病因素导致了与FAD类似的病理过程,有待我们进行进一步的探究。因此,我们选择了临床上所见的3例典型的sAD患者,取得他们的尿液细胞诱导成IPS细胞,并初步探究这些iPS细胞向神经方向分化的能力。为今后sAD的机制研究,甚至临床早期诊断以及药物筛查打下基础。
材 料 和 方 法
1 一般资料
选取了3例典型散发性阿尔茨海默病患者,分别来自中山大学附属第六医院和佛山市第一人民医院,入组的AD患者均符合目前临床上广泛运用的美国国家衰老研究所和阿尔茨海默病学会诊断标准:(1)存在早期、显著的情景记忆损害,简短精神状态检查(min-mental state examination,MMSE)得分低于24分;(2)MRI分析显示海马、内嗅区、杏仁核等结构的萎缩;(3) 排除额颞叶痴呆、路易体痴呆以及血管性痴呆等非AD性痴呆。经患者或家属同意并签字,见表1。
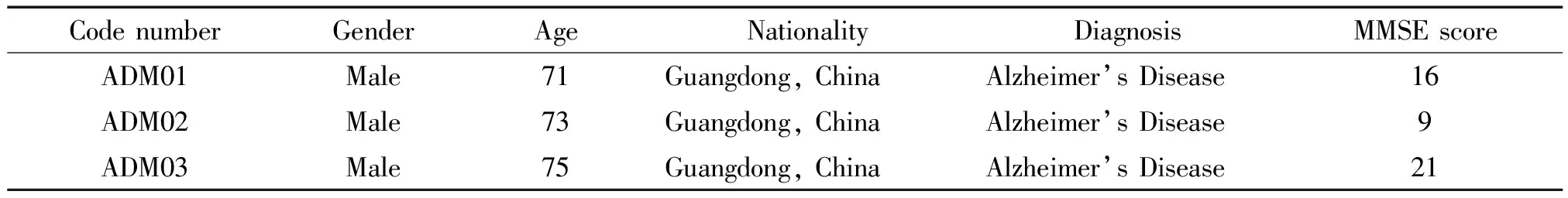
表1 患者信息
2 细胞、质粒和主要试剂
2.1 细胞和质粒 人胚胎干细胞(human embryonic stem cells,hESCs)H1、正常人iPS细胞UC05及质粒PCEP4-E02ST2K、PCEP4-miR-302 cluster均由中国科学院广州生物医药与健康研究院潘光锦研究组惠赠。
2.2 培养基及配方 尿细胞原代培养基为REGM Bullet Kit,购自Lonza;hESCs及iPSCs培养基为mTeSR1,购自Stem Cell;N2B27培养基为 (1% N-2 supplement+99% DMEM/F12)+(2% B-27 supplement+98% Neurobasal);KSR培养基:10% 血清替代物(Knockout serum replacement, KSR)+39% DMEM/F12+0.5% L-GlutaMax+0.5% NEAA+0.1% β-巯基乙醇;N-2 supplement、B-27 supplement、Neurobasal基础培养基购自Life Technologies;DMEM/F12基础培养基、KSR、L-GlutaMax、NEAA、β-巯基乙醇购自Gibco。
2.3 其它主要试剂 DFBS、0.25% 胰酶-EDTA消化液、胶原酶IV购自Gibco;Matrigel购自BD;明胶(Gelatin)、Accutase细胞消化液、Smad通路抑制剂SB431542水合物和dorsomorpin、微管相关蛋白2(microtuble-associated protein 2, MAP2)、胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、tubulin抗体购自Sigma;Oct-4抗体、阶段特异性胚胎抗原4(stage-specific embryonic antigen 4,SSEA4)抗体、TRA-1-60抗体、TRA-1-81抗体购自Abcam;Pax6抗体、Sox1抗体、Sox2抗体购自Millipore;成纤维细胞生长因子、表皮细胞生长因子购自Invitrogen;Dispase消化酶购自Life Technologies。
3 主要方法
3.1 尿液细胞的收集与培养 预先用1%的明胶铺于6孔板中,1 mL每孔,置于培养箱中包被20 min以上。用无菌瓶收取200 mL左右尿液,400×g离心10 min,去上清,剩余约2~3 mL,加50 mL PBS洗1遍,400×g离心10 min,用2 mL REGM培养基重悬,接种于明胶包被好的6孔板中。将处理好的细胞置于37 ℃培养箱中,隔天半换液,约3~5 d可见细胞贴壁。当细胞长至每孔60%以上(7~14 d左右)时予以传代。用0.25%的胰酶消化,接种于10 cm盘内。隔1~2 d换液1次,约 1 周时间可见细胞长满10 cm盘。
3.2 利用非病毒方法进行iPS细胞的重编程 将准备好的10 cm盘细胞用0.25%胰酶消化,离心去上清;根据说明书准备好电转溶液和质粒(PCEP4-E02ST2K、PCEP4-miR-302 cluster),按仪器(NucleofectorTM2b Device,Lonza)说明进行瞬时转染,导入带有Oct4、Sox2、Klf4和SV40LT的质粒。电转后第 1 天用REGM培养,根据细胞密度,1 个10 cm盘细胞接种于6孔板2~3个孔。第2 天换成mTeSR1培养基继续培养。隔天换液,注意观察细胞形态变化。
3.3 iPS细胞的培养及纯化 约2周左右可见原代细胞出现较明显形变,18 d左右可见iPS克隆形成。成熟的iPS克隆细胞之间联系紧密,与原代细胞的分界较为清晰。此时可在显微镜下挑取iPS细胞克隆,重新接种于Matrigel包被的24孔板内,待克隆长大后再逐渐传代到12孔板和6孔板中。扩增过程中注意观察细胞形态,当混杂有其它非iPS细胞时要及时纯化。纯化方法主要有以下几种:当分化细胞较少且位置局限时,可用细针于显微镜下刮除,或者直接用吸引器吸除;分化细胞较多且位置分散时,可用胶原酶Ⅳ消化30~60 min,iPS细胞由于贴壁较松,更容易被消化下来,以此达到纯化目的。
3.4 定向诱导iPS细胞向神经方向分化 将无分化的iPS细胞接种于Matrigel包被的 6 孔板中,待细胞密度达到60%~70%时更换诱导培养基[N2B27培养基+SB431542(5 μ/L)+dorsomorpin(1 μmol/L)]。第8 天撤掉SB431542和dorsomorpin。约第16 天可见神经花环结构形成,挑取花环结构的细胞,悬浮培养并进行鉴定。
3.5 Real-time PCR鉴定各基因的表达 Trizol裂解细胞,提取总RNA。使用SYBR Premix EX Taq试剂盒进行real-time PCR,扩增多能性基因Oct-4、Sox2、Nanog及神经干细胞相关基因PAX6、Nestin、Sox1、Sox2、Vimentin。GAPDH作为内参照。引物序列见表1。

表1 引物序列表
4 统计学处理
使用Graphpad Prism 6.0软件对实验数据进行分析处理。数据用均数±标准差(mean±SD)表示。各基因在不同细胞中的表达差异采用单因素方差分析检验。以P<0.05为差异有统计学意义。
结 果
1 AD患者尿液来源的细胞均能成功诱导成为iPS细胞
按上述步骤收取患者尿液细胞后,约3 d可见细胞贴壁(图1)。至第8 天细胞长至每孔60%以上。传代到10 cm盘内继续扩增,约 12 d时可见细胞布满10 cm盘。对扩增好的尿细胞进行电转染,转染后10 d AD患者来源的原代细胞可见不同程度的形变,镜下见原代细胞逐渐由梭型转变成圆形,聚集成团,细胞核比例增大。18 d左右可见成簇的iPS克隆形成,AP染色可初步判断这些细胞存在干细胞特性(图2)。这些克隆挑出后可进行扩增和稳定传代。对所得到的iPS细胞(图3A)进行real-time PCR鉴定(图3B),病人来源的iPS细胞均有内源性干性基因Oct4、Sox2、Nanog的表达。我们以人胚胎干细胞H1作为阳性对照,其中Oct4表达量较H1相近,Sox2表达量略低,而Nanog表达普遍比H1高。免疫荧光鉴定(图3D)也发现Oct4、SSEA4、TRA1-60、TRA1-81的蛋白表达,Oct4、SSEA4的表达与H1相近,而TRA1-60、TRA1-81的表达量略低,在同样参数下激发的荧光强度较弱。核型鉴定均未出现异常(图3C)。结果表明所有AD病人尿液来源的原代细胞均成功重编程为iPS细胞,这些细胞形成存在类似于人胚胎干细胞的特性,但也有一定区别。
2 AD患者来源的iPS细胞均能够向神经方向分化,形成有功能的神经元
为了观察AD患者来源的iPS是否能够正常进行神经分化,我们参照文献,在N2B27培养体系加入2个Smad通路的抑制剂SB431542和dorsomorpin,定向诱导iPSCs向神经方向分化[9-10]。第8 天时观察细胞核质比变小,已基本失去干细胞形态,诱导第14~16 天可见神经花环形成,将花环挑出后悬浮培养,形成透亮的神经球(图4A)。取神经球进行real-time PCR鉴定(图4C),结果显示这些神经球已基本无胚胎干细胞特异的基因Oct4和Nanog表达,而表达神经干细胞相关基因如Pax6、vinemtin、nestin等,且同一个基因不同细胞间的表达量无明显差异(P>0.05)。发现将神经球消化贴壁后进行免疫荧光鉴定,可见患者来源的神经干细胞均有表达Pax6、Sox1、Sox2等特异性蛋白(图4B)。贴壁分化14d后进行免疫荧光鉴定,可见MAP2、tubulin、GFAP等神经细胞标志物的表达,说明这些神经具备分化成为神经元以及神经胶质细胞的能力(图4D)。继续分化至30 d,膜片实验可检测到与正常神经元类似的钠钾电流活动以及动作电位情况(图4E、F),表明分化形成的神经元具有正常电生理活性。
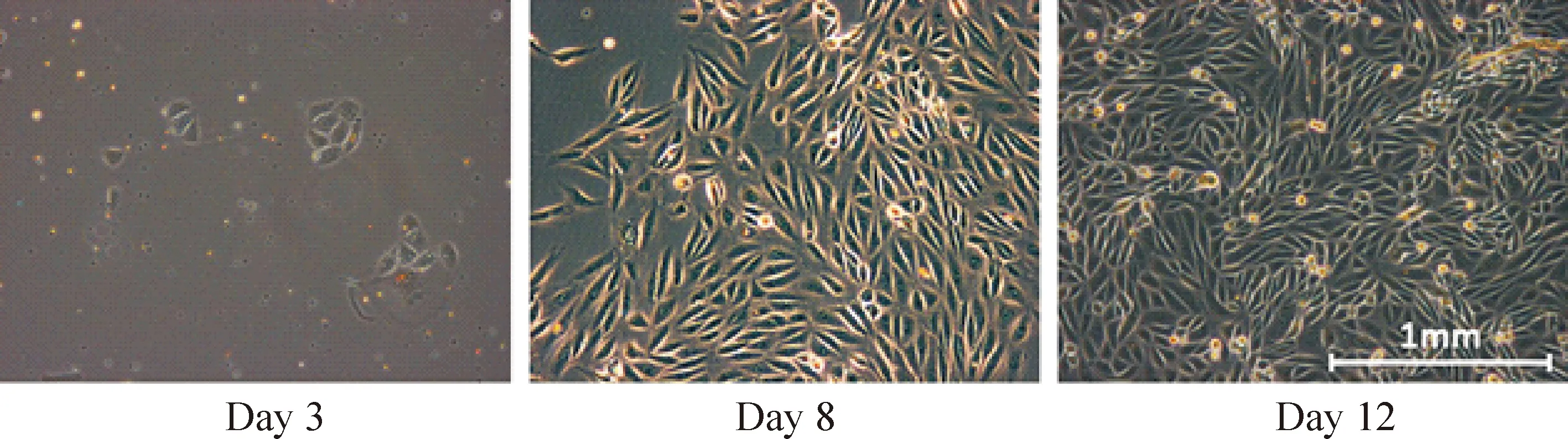
Figure 1.The primary cultured urine-derived cells from the AD patients.
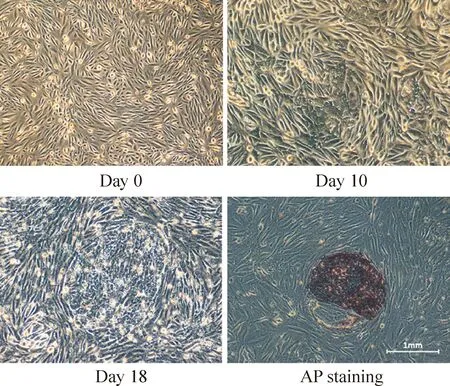
Figure 2.Generation of iPSC lines. The transformation of primary cells during reprogramming.
讨 论
阿尔茨海默病是长期以来困扰科学家们的一大难题。早期的AD研究主要局限于尸检来源的大体模型、动物模型以及一些非人类神经元的细胞模型。然而大体模型只能展现疾病的终末状态;鉴于种属之间的巨大差异,动物模型难以重复人类AD的病程。我们在以往的工作中也使用过转入swAPP基因(一种FAD相关的突变基因)的HEK293细胞以及秀丽线虫作为AD的疾病模型[11-12]进行相关的药物研究。然而仅仅导入1个突变基因的细胞并不能很好地代表这个疾病,尤其是sAD,线虫模型亦是如此。因此,我们一直致力于寻找和建立更具代表性的疾病模型,以便更好地探究AD的发病机制和治疗手段。诱导多能干细胞的出现为AD研究提供了新的思路,许多研究发现,由iPS细胞诱导分化的神经元细胞能够特异性表达AD的相关病理表型[7-8, 13]。我们认为构建AD患者来源的iPS细胞并诱导其神经分化将为AD研究提供很大帮助。
本实验中得到的典型sAD患者的iPS细胞,具备类似于胚胎干细胞的形态、类似的基因以及蛋白表达,且其诱导过程中细胞形态、各种干性基因的表达均未发现异常。虽然结果中iPSCs的干性基因表达与人胚胎干细胞存在差异,但这些差异并不显著(在0.5~2倍之间);且对照组正常人来源的iPS细胞UC05细胞的干性基因表达与人胚胎干细胞之间同样存在细微差异,因此可以认为这些差异来源于iPS细胞本身,与AD疾病无直接关系。综上,此次所获取的患者来源的细胞均可正常进行重编程。
所有患者的原代细胞直接从尿液中分离[14],不同于以往常用的取皮肤或者身体其它部分的组织进行原代细胞分离和培养,尿液来源不仅充足方便,而且把对患者的伤害降到了最小,更加利于临床应用。同时也验证了AD患者尿液中来源的细胞可以正常重编程为iPS细胞。在诱导方法上,经典的iPS重编程使用逆转录病毒方法,然而逆转录病毒可随机整合到宿主染色体中,干扰宿主其它基因的功能,甚至激活癌基因,有致癌的危险。本次实验中iPS细胞的重编程采用电转化方法,避开了病毒的随机插入问题,得到的iPS细胞相对更为安全,为今后进一步的临床应用打下基础。
为了观察这几例患者来源的iPS细胞是否能够正常进行神经分化,我们参照文献,利用成熟的单层贴壁诱导的方式,定向诱导iPS细胞向神经方向分化。结果表明所有患者的iPS细胞均能正常向神经方向分化。对于这几例iPS初步分化结果显示,在iPS细胞向神经细胞分化的阶段其分化效率与正常人来源的无异,且定向分化形成的神经干细胞以及神经元与UC05及hESCs来源的细胞在各项神经细胞标志物的表达,以及电生理活性方面没有明显区别。许多其它实验也得到过类似的结果[7, 15-16]。这表明AD虽然以神经元的过度凋亡为重要表型之一[17],但在神经系统形成的早期阶段对神经发育并无影响。另外,也可能由于样本量的不足和检测手段的局限,未能发现其中更为细微的差别。
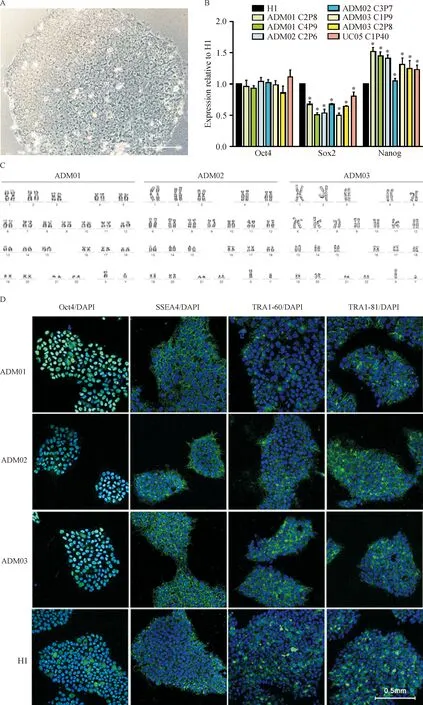
Figure 3.The identification of iPSCs. A: the characteristics of iPSC clones; B: mRNA expression of Oct4, Sox2 and Nanog relative to H1 cells; C: karyotype identification; D: immunofluorescence identification. AMD01~03: AD patients 01~03; C1~C4: clones 1~4; P6~P9: passages 6~9; P40: passage 40. Mean±SD. n=3. *P<0.05 vs H1.

Figure 4.Neural conversion of human iPS cells. A: the transformation of iPSCs during neural differentiation; B: immunofluorescence shows most of these were Pax6, Sox1, Sox2 positive cells; C: the expression of neural related genes (Sox1, Sox2, Pax6, nestin, vinemtin) were detected by real-time PCR (Mean±SD.n=3); D: after 2 weeks of spontaneous differentiation, the tubulin (+) /MAP2 (+) neurons and GFAP (+) neural glial cells were observed; E: current-clamp recording showing voltage-gated ion channels from a neuron differentiated from patients-derived iPSCs; F: a representative train action potentials in a neuron.
sAD的发病机制众说纷纭。近几年利用iPS技术进行AD的研究中发现,sAD患者iPSCs分化来源的神经细胞表现出多种不同表型,包括细胞外Aβ40、p-tau的升高[7],细胞内Aβ寡聚体的升高[8],或是不表现病理特征,与正常对照一致。这便提示我们在如今的sAD的人群中,可能存在不同的分型。本实验只是初步鉴定了所获得的AD患者来源细胞的iPSCs重编程以及神经分化能力,对于AD相关的其它表型还有待进一步探究。接下来我们希望继续寻找更多典型AD病例,扩大样本量,建立sAD患者特异性的iPS细胞库,从而为今后深入研究AD的致病机制甚至找到sAD不同亚型、开发新型安全治疗药物以及寻找更优化的治疗方案提供便利。与此同时,干细胞治疗是神经系统退行性疾病的一个新治疗方向。iPS细胞由于其免疫排斥低及来源广泛的巨大优势,为干细胞治疗广泛应用于临床带来了希望[18]。这些AD患者经iPSCs来源的神经细胞经初步检测,可以确定其具有正常神经元的生理功能。经过进一步检测后,那些不带有AD相关表型的神经细胞则可能成为今后干细胞治疗的一大细胞来源。
致谢: 本工作得到中国科学院广州生物医药与健康研究院提供的重编程所需质粒PCEP4-E02ST2K、PCEP4-miR-302 cluster;广州生物医药与健康研究院的潘光锦老师、蔡秀娟老师,以及苏整会、李迪、马宁、单永礼等同学在细胞培养技术和分子生物实验技术方面给予了宝贵的指导和帮助,在此一并致以由衷的感谢!
[1] Lambert JC, Ibrahim-Verbaas CA, Harold D, et al. Meta-analysis of 74,046 individuals identifies 11 new susceptibility loci for Alzheimer's disease[J]. Nat Genet, 2013, 45(12):1452-1458.
[2] Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126(4):663-676.
[3] Abdelalim EM, Bonnefond A, Bennaceur-Griscelli A, et al. Pluripotent stem cells as a potential tool for disease modelling and cell therapy in diabetes[J]. Stem Cell Rev, 2014, 10(3):327-337.
[4] Dolmetsch R, Geschwind DH. The human brain in a dish: the promise of iPSC-derived neurons[J]. Cell, 2011, 145(6):831-834.
[5] Carvajal-Vergara X, Sevilla A, D’Souza SL, et al. Patient-specific induced pluripotent stem-cell-derived models of LEOPARD syndrome[J]. Nature, 2010, 465(7299):808-812.
[6] Lee G, Papapetrou EP, Kim H, et al. Modelling pathogenesis and treatment of familial dysautonomia using patient-specific iPSCs[J]. Nature, 2009, 461(7262):402-406.
[7] Israel MA, Yuan SH, Bardy C, et al. Probing sporadic and familial Alzheimer's disease using induced pluripotent stem cells[J]. Nature, 2012, 482(7384):216-220.
[8] Kondo T, Asai M, Tsukita K, et al. Modeling Alzheimer's disease with iPSCs reveals stress phenotypes associated with intracellular Aβ and differential drug responsiveness[J]. Cell Stem Cell, 2013, 12(4):487-496.
[9] Shi Y, Kirwan P, Livesey FJ. Directed differentiation of human pluripotent stem cells to cerebral cortex neurons and neural networks[J]. Nat Protoc, 2012, 7(10):1836-1846.
[10]Chambers SM, Fasano CA, Papapetrou EP, et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling[J]. Nat Biotechnol, 2009, 27(3):275-280.
[11]Liu H, Li Z, Qiu D, et al. The inhibitory effects of different curcuminoids on beta-amyloid protein, beta-amyloid precursor protein and beta-site amyloid precursor protein cleaving enzyme 1 in swAPP HEK293 cells[J]. Neurosci Lett, 2010, 485(2):83-88.
[12]何 露,李 中,韦 睿,等. 姜黄素类化合物提高线虫的抗氧化应激能力[J]. 中国病理生理杂志, 2014, 30(1):154-158.
[13]Yagi T, Ito D, Okada Y, et al. Modeling familial Alzheimer's disease with induced pluripotent stem cells[J]. Hum Mol Genet, 2011, 20(23):4530-4539.
[14]Zhou T, Benda C, Dunzinger S, et al. Generation of human induced pluripotent stem cells from urine samples[J]. Nat Protoc, 2012, 7(12):2080-2089.
[15]Choi SH, Tanzi RE. iPSCs to the rescue in Alzheimer's research[J]. Cell Stem Cell, 2012, 10(3):235-236.
[16]Yagi T, Kosakai A, Ito D, et al. Establishment of induced pluripotent stem cells from centenarians for neurodegenerative disease research[J]. PLoS One, 2012, 7(7):e41572.
[17]Blennow K, de Leon MJ, Zetterberg H. Alzheimer's disease[J]. Lancet, 2006, 368(9533):387-403.
[18]郭晓令,刘 庆,王 婵,等. 重编程诱导多功能干细胞的研究进展[J]. 中国病理生理杂志, 2014, 30(7):1218-1222,1227.
Generation of induced pluripotent stem cells and neural cells from urine-derived cells of Alzheimer disease patients
WEI Rui1, LI Zhong1, CAI Xiu-juan2, HE Lu1, LEI Qing-feng1
(1DepartmentofNeurology,TheSixthAffiliatedHospital,SunYat-senUniversity,Guangzhou510655,China;2GuangzhouInstitutesofBiomedicineandHealth,ChineseAcademyofSciences,Guangzhou510530,China.E-mail:zslyjohn@163.com)
AIM: In this study, we aim to obtain the induced pluripotent stem cells (iPSCs) from the patients with sporadic Alzheimer disease (AD). METHODS: Three typical Alzheimer’s patients were chosen, and the epithelial cells were isolated from their urine. We reprogrammed these cells into induced pluripotent stem cells by transfection of 4 factors (Oct4, Sox2, Klf4 and SV40LT) with the technique of electro-transfection. After getting these iPSCs, we continue to differentiate them into neural cells by a specific method—dual inhibition of Smad signaling. RESULTS: The primary cells from 3 AD patients were successfully reprogrammed to iPSCs, and these patients-derived iPSCs were differentiated into neural cells. There was no significant difference, during iPSCs reprogramming and neural differentiation, between cells from AD patients and normal people. CONCLUSION: The urine cells from AD patients were able to transfer to iPSCs, functional neurons and neurogliocytes.
Alzheimer disease; Induced pluripotent stem cells; Neural differentiation
1000- 4718(2015)03- 0421- 07
2014- 09- 05
2014- 10- 28
广东省医学科学研究基金资助项目(No. A2012211);天河区2014年度科技计划项目(No.201404kw028)
△通讯作者 Tel: 020-38274637; E-mail: zslyjohn@163.com
R749.1+6
A
10.3969/j.issn.1000- 4718.2015.03.007
