高浓度CO2入侵包气带对土壤微生物的影响
2015-04-14张帆李春荣邓红章张徽李发明张慧慧
张帆,李春荣,邓红章,张徽,李发明,张慧慧
(1.旱区地下水文与生态效应教育部重点实验室 长安大学 环境科学与工程学院,陕西 西安 710054;2.中国地质调查局水文地质环境地质调查中心,河北 保定 071051)
煤转油是解决石油资源短缺的重要途径,通过该技术可以将煤炭直接或间接液化[1-2],最终生产出汽油、柴油或者相关的石油化工产品,以满足日益增长的能源需求[3]。但这一过程会产生大量的CO2,如果直接排放将会加重温室效应。为解决煤转油过程中CO2的排放问题,世界各国相继采用了地质封存等手段[4-6]。然而,由于地质盖层结构的复杂性及地震等主观和客观因素,可能会造成CO2渗漏,对生态及人类生存环境产生不利影响。一般而言,当CO2浓度超过39 280 mg/m3,将会严重影响人的呼吸系统,而且长期存在CO2渗漏的陆地表面附近,植物一般很难生长[7]。
目前,有关CO2浓度升高对土壤微生物群落的影响研究主要集中在大气CO2浓度升高所产生的影响[8-18],而且由于供试土壤、供试植物以及实验方案等的不同,最终所得实验结论也不尽相同。与大气CO2浓度升高相比地质封存CO2泄漏入侵土壤包气带具有以下特点:①入侵的CO2浓度较高;②由于土壤的相对封盖作用使CO2处于微压或超常压状态;③CO2入侵方向不同,土壤中CO2由下向上沿垂向浓度逐渐降低,这点与大气CO2浓度升高引起包气带中CO2浓度变化方向相反。所以逃逸CO2入侵包气带时,其对植物及土壤微生物所产生的影响更为直接、强度更大。
本文通过原位模拟实验,研究高浓度CO2入侵包气带对土壤微生物量、群落分布及多样性的影响规律,从而揭示微生物群落变化与入侵包气带CO2浓度之间的相关性,为地质封存CO2泄漏甄别与安全性评价提供理论和技术支持。
1 实验部分
1.1 材料与仪器
选取鄂尔多斯境内黄土,土壤基本理化性质:pH 值8.8,全氮250 mg/kg,全钾258 mg/kg,有机质含量15 mg/kg,水溶性盐含量283.79 mg/kg;黑麦草;小麦;CO2(钢瓶气)。
LDZX-40BI 立式自动电热压力蒸汽灭菌器;HH·B11·420-S-II 电热恒温培养箱;SW-CJ-1D 单人净化工作台;BT 224 S 电子天平;SHA-C 恒温振荡器。
1.2 实验方法
模拟实验在四间用绝热材料相互分隔的温室内进行。每间温室作为一个独立的实验区域,面积24 m2,其中分别埋设9 个实验桶;各实验区CO2施加 浓 度 依 次 设 定 为:0,98 210 ,196 430,294 640 mg/m3,分别用CK、01、02 和03 表示;每个实验区内均设3 个平行实验桶和无植被对照实验桶。
实验桶由1 cm 厚木板加工成100 cm ×100 cm×100 cm 立方体,埋于地下,上口与地表平齐,桶内、外表面用防腐涂料处理。桶底平置环形气体分布盘(其材质PVC,直径2 mm,四周钻有均匀小孔,环间距8 mm),分布盘管上铺垫双层80 目的树脂网,气体分布盘与CO2输入管相连。桶内填充供试土壤,在距地表30 cm 处埋设土壤气相CO2浓度监测探头,且每一个实验桶输气口连接一只CO2压力控制表。充分喷淋润湿土层,保证土壤含水率20%左右。放置48 h,取土壤样品测定土壤基本理化性质,开起供气系统,调节供气压力使各个实验桶30 cm 埋深处CO2浓度达到设定浓度要求,继续运行至各个实验桶CO2浓度基本稳定。下种,常规田间管理。模拟实验于2013 年5 月至2013 年10 月在旱区地下水文与生态效应教育部重点实验室、陕西省地下水与生态环境工程中心原位试验场进行。
1.3 分析方法
实验运行90 d 后,于30 cm 深处用已消毒的取样铲取土样,过1 mm 筛,带回实验室进行微生物数量及DGGE 分析。细菌选用牛肉膏蛋白胨培养基培养;真菌采用马丁氏培养基培养;放线菌采用高氏I 号培养基培养。微生物数量分析采用CFU 菌落计数法(活细胞计数法);DGGE 分析方法参见文献[19]。
2 结果与讨论
2.1 CO2 浓度对土壤微生物数量的影响
无植被(即裸地)实验桶及有植被实验桶细菌、真菌、放线菌数量监测结果见表1、表2。
由表1 可知,裸地实验桶内,随着CO2浓度的升高,真菌、细菌和放线菌活菌数量与对照区相比均呈减少趋势,说明土壤CO2浓度的增高对微生物活性产生了一定的抑制作用。
由表2 可知,同一水平CO2处理下,有植被实验区土壤真菌、细菌及放线菌数量均高于裸地实验区。其原因可能是逃逸的CO2可增加其在地表的浓度,从而在加速植物光合作用的同时,促进了植物根际分泌物的产生,使根系生物量、细根周转、地下可利用碳分配量等增加;根系分泌物的增加势必会影响根际土壤微生物C、N 源在数量和结构等方面的改变[20],因此丰富了微生物可利用营养物,从而促进了微生物的生长[21-22]。表明植物对土壤微生物在高浓度CO2入侵条件下的适应性有调节作用,可提高其抗逆性。
黑麦草、小麦实验区细菌、放线菌数量虽然高于相应裸地实验区,但仍然低于有植被对照区,表明在高浓度CO2入侵条件下,植物对微生物环境适应性的调节能力是有限的。
CO2浓度施加到294 640 mg/m3时,黑麦草实验区真菌数量为3.16 ×104CFU/g 与裸地实验区真菌相近;而细菌、放线菌数量较裸地实验区分别提高了13.22 倍和1.90 倍。表明植物对细菌抗逆性的调节能力最强,其次是放线菌,对真菌抗逆性调节能力较弱。原因可能是真菌对C 源利用的条件较细菌要求高[21]。
在98 210,196 430,294 640 mg/m3处理条件下,放线菌在黑麦草实验区的数量较裸地实验区分别提高13.94%,4.91%和90.43%,而小麦实验区依次提高19.52%,123.66%和279.90%,表明不同植被对土壤微生物抗逆性调节作用差异较大。
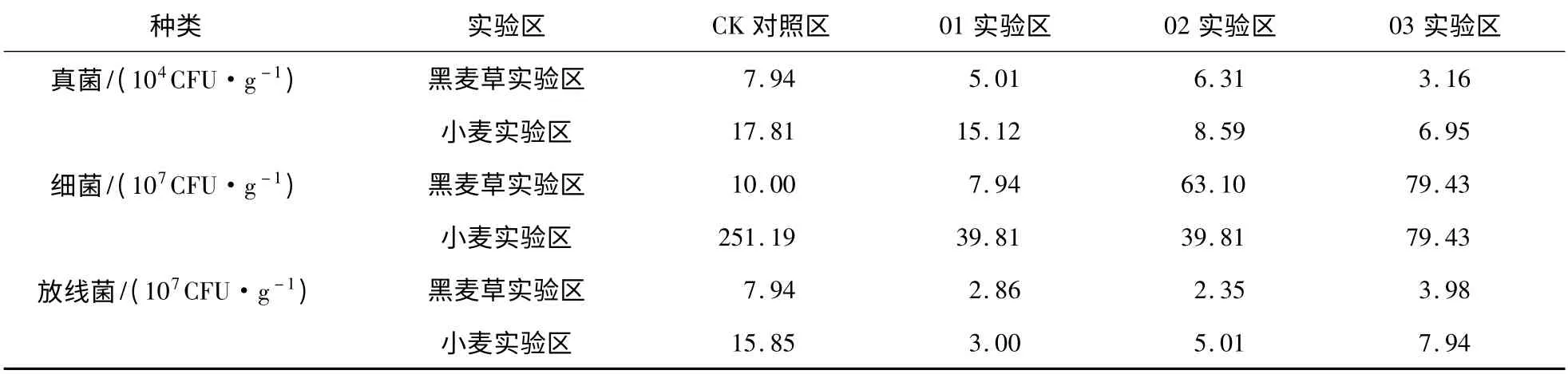
表2 有植被实验区土壤微生物数量分析结果Table 2 Effect of elevated CO2 concentration on soil microbial number in plant test area
2.2 CO2 浓度入侵对土壤细菌群落多样性的影响
对CO2施加浓度分别为98 210,196 430,294 640 mg/m3及相应对照区的黑麦草实验区(分别用h1、h2、h3 和CK 表示)土壤样品的16S rDNA V3区PCR 产物进行DGGE 分析,结果见图1。

图1 黑麦草实验区土壤细菌16S rDNA-DGGE 图谱Fig.1 16S rDNA-DGGE fingerprint patterns of the soil bacteria in Perennial ryegrass area
由图1 可知,随着土壤CO2浓度升高,7,9,23号等条带亮度变暗,12,20 号等条带消失,即一些原有物种数量被大幅度消减或部分物种消失,表明土壤CO2浓度升高对一些土壤细菌的生长有抑制作用;18,19 号条带亮度增强,表明随着土壤CO2浓度增加,一些原有物种数量较少的细菌被丰富,土壤CO2浓度升高对另一些土壤细菌的生长繁殖有刺激作用;当土壤CO2浓度达到98 210 mg/m3时,出现了新生条带(即1,8,10,12,20 号条带),表明土壤CO2浓度升高可能会导致某些细菌的遗传基因发生变化或产生新物种;3,4,5,6,11,16,22,24 号条带具有较高同源性,13,14 及15 号条带同源且优势,表明土壤CO2浓度的升高对土壤主要建群种无显著的影响。
各样品中的细菌多样性指数(H)、丰度(S)和均匀度(EH)等指标进行综合分析[23],结果见表3。

表3 不同实验区样品DGGE 条带多样性指数(H)、丰度(S)及均匀度(EH)Table 3 The diversity index (H),abundance (S)and evenness (EH)of DGGE strip in different test zone
由表3 可知,98 210 mg/m3黑麦草实验区(h1)细菌多样性指数、丰度均高于对照区(CK);进一步增加CO2浓度,土壤细菌多样性指数及丰度较对照区均有所降低;各个实验区细菌均匀度(EH)相同。表明低浓度CO2入侵包气带对部分细菌生长有刺激作用,使其多样性及丰度有所增加,高浓度CO2入侵使一些土壤细菌生长受到抑制,其多样性指数及丰度显著降低。
2.3 主要细菌菌种测序结果
从每个样品DGGE 谱图中选取主要条带进行克隆测序,得到的部分条带的16s rDNA 片段测序分析结果见表4。
由表4 并结合图1 可以看出,高浓度CO2入侵时,优势且同源性高的细菌主要是Catellibacterium(微单狍菌科)、Arthrobacter sp(节细菌属)、Bacteroides sp(拟杆菌属)。在98 210 mg/m3CO2浓度条件下可能产生的新生细菌物种主要是Flavobacterium denitrificans(黄杆菌属)、Haematobacter(红杆菌属)、Ferrithrix(热袍菌门);高浓度CO2能够促进Pedobacter (地杆菌属)、Akkermansia(疣微菌门)的生长繁殖,而对unclassified_Betaproteobacteria(β-变形菌属)、Subdivision3_genera_incertae_sedis 等细菌的生长繁殖产生明显抑制作用。细菌Thauera aminoaromatica(陶厄氏菌属)及Nitrospira(硝化螺菌属)等对CO2反应敏感,当土壤CO2浓度达到196 430 mg/m3时,不能正常生长繁殖,导致该群落消失。

表4 条带序列菌种鉴定结果Table 4 Identification results of the bands sequence
当土壤CO2浓度不高于294 640 mg/m3时,随着土壤CO2浓度的增加,土壤细菌、真菌、放线菌数量均呈减少趋势。徐国强等[11]发现,开放式空气CO2浓度增加,土壤细菌随作物生长呈现先减后增的趋势,但对真菌数量影响不大。李杨等[15]的研究也有类似的结果。贾夏等[16]发现,大气CO2浓度升高对非根际土壤细菌有刺激作用,使其数量增多,而对真菌则表现出抑制作用,同时贾夏等[21]也发现,大气CO2浓度升高对根际土壤细菌、真菌数量的影响也有类似的结果。导致不同结论的原因可能是模拟地层释放CO2入侵包气带的途径、强度及对土壤微生物的影响机理有别于大气CO2浓度变化的影响。大气CO2浓度升高对土壤微生物群落的影响在很大程度上是通过对地表植被的光合作用、生理生化、生长代谢等过程的影响间接表现的,而植被的这些作用过程会因土壤的性质与结构、植物的种类与长势、水分与养料的供给等因素的变化而变化。地质封存CO2泄漏入侵包气带,则可以通过对土壤气相组成、水盐平衡、可利用无机与有机养分结构形式及土壤结构等的改变对土壤微生物生长产生影响,也可以利用释放进入大气中的CO2通过地表植被产生间接影响。与大气CO2浓度升高对土壤微生物群落影响相比,地质封存泄漏的CO2与土壤作用强度更高,诸多因素导致了不同研究条件所得到的结论有所不同。
另外,在外界环境胁迫的条件下,植物可以通过自身根际分泌物组成、结构的调节作用提高土壤微生物的抗逆性,使其环境适应性显著增强,这一研究结果对环境保护和污染土壤的生物修复具有一定的指导意义。
3 结论
(1)高浓度CO2入侵包气带,对土壤微生物生长产生一定抑制作用,土壤细菌多样性及丰度均降低。
(2)植被可以提高CO2入侵条件下土壤微生物的抗逆性,使其适应性显著增强;不同植被对土壤微生物抗逆性调节作用差异显著,而且与植被的生长周期、根际发育情况相关。
(3)同种植被对不同土壤微生物抗逆性调节作用差异显著,对细菌抗逆性调节能力最强,使得低浓度CO2入侵条件下其丰度有所增加。
(4)高浓度CO2入侵包气带对土壤微生物群落结构影响显著,但土壤微生物主要建群种未变。
[1] 丰洋. 煤制油的现状和进展[J]. 中国石油和化工,2005(4):73-76.
[2] 宜晓光,赵林,汪如朗.对中国石油对外依存度问题的思考[J].经济与管理研究,2009(1):60-65.
[3] 黄清.煤化工的最高境界——煤制油[J]. 中国能源,2004,26(3):45-47.
[4] Holloway S. Underground sequestration of carbon dioxide available greenhouse gas mitigation opting[J]. Energy Conversion Management,2005,30(11/12):231-333.
[5] 许志刚,陈代钊,曾荣树.CO2地质埋存渗漏风险及补救对策[J].地质评论,2008,54(3):373-385.
[6] 刁玉杰,张森琦,郭建强.深层咸水层CO2地质安全性评价方法研究[J].中国地质,2006,38(3):786-792.
[7] Jill Wildaya,Mike Wardmana,Michael Johns. Hazards from carbon dioxide capture transport and storage[J].Process Safety and Environmental Protection,2011,89:482-491.
[8] Cardon Z G. Influence of rhizodeposition under elevated CO2on plant nutrition and soil organic matter[J]. Plant Soil,1996,187:277-288.
[9] Pregitzer K S,Zak D R,Curtis P S,et al. Atmospheric CO2soil nitrogen and turnover of fine roots[J]. New Physiol,1995,129:579-585.
[10] Paterson E,Rattray S,Killham K. Effect of elevated atmospheric CO2concentration on C-partitioning and rhizosphere C-flow for three plant species[J]. Soil Biology &Biochemistry,1996,28:195-201.
[11]徐国强,李杨,史奕,等. 开放式空气CO2浓度增高(FACE)对稻田土壤微生物的影响[J]. 应用生态学报,2002,13(10):1358-1359.
[12]Korner C,Arnone J A.Responses to elevated carbon dioxide in artificial tropical ecosystems[J]. Science,1992,257:1672-1675.
[13]Rice C W,Garcia F O,Hampton C O,et al.Soil microbial response in tall grass prairie to elevated CO2[J]. Plant Soil,1994,165:67-74.
[14]Diaz S,Grime J P,Harris J,et al.Evidence for a feedback mechanism limiting plant response to elevated carbon dioxide[J].Nature,1993,364:616-617.
[15]李杨,徐国强,黄国宏,等. 开放式空气二氧化碳浓度增高(FACE)对稻麦轮作土壤微生物数量的影响[J].应用生态学报,2004,15(10):1847-1850.
[16]贾夏,韩士杰,赵永华,等.大气CO2浓度升高对红松和长白赤松幼苗非根际土壤微生物的影响[J]. 西北林学院学报,2007,22(6):44-47.
[17]Bruce K D,Jones T H,Bezemer T M,et al.The effect of elevated atmospheric carbon dioxide levels on soil bacterial communities[J].Global Change Biology,2000,6(4):427-434.
[18]Kampichler C,Kandeler E,Richard D,et al.Impact of elevated atmospheric CO2concentration on soil microbial biomass and activity in a complex weedy field model ecosystem[J].Global Change Biology,1998,4:335-346.
[19] Li Chunrong,Wang Wenke,Deng Hongzhang,et al.Effects of elevated carbon dioxide on soil bacterial community structure[J]. Advanced Materials Research,2014:1010/1011/1012:422-428.
[20]周玉梅,韩世杰,张军辉,等.不同CO2浓度下,长白山三种树幼苗的光合特征[J]. 应用生态学报,2002,13(1):41-44.
[21]贾夏,韩士杰,周玉梅,等. 不同二氧化碳浓度条件下红松和长白赤松幼苗根际土壤微生物数量研究[J].应用生态学报,2005,16(7):1295-1298.
[22]贾夏,赵永华,韩世杰.全球大气CO2浓度升高对土壤微生物的影响[J]. 生态学杂志,2007,26(3):443-448.
[23]秦胜红,李新宇,李旭,等. 不同土壤细菌种群结构对氯嘧磺隆胁迫的响应及降解菌系的获得[J]. 生态学杂志,2012,31(7):1724-1732.
