一株产普鲁兰酶芽孢杆菌的筛选鉴定及发酵条件优化
2015-04-14宋勇强胡先望张鸣明严晓娟沙芮梁宁
宋勇强,胡先望,张鸣明,严晓娟,沙芮,梁宁
(甘肃省商业科技研究所,甘肃 兰州 730010)
普鲁兰酶(pullulanase,EC.3.2.1.41)是应用最广泛的一类脱支酶[1],因为能水解普鲁兰糖分子中的α-(1→6)糖苷键而得名[2],能够专一性地作用于糊精分子和支链淀粉,有效地切开其中分支点处的α-(1→6)糖苷键,将各分子支链脱落[3],最终使糊精分子或支链淀粉转变为只含有α-(1→4)糖苷键的直链低聚糖或支链淀粉。由于这类脱支酶能够分解最小单位的支链,有效地提高了淀粉利用率,因此在淀粉加工工业中有着重要的应用价值和广阔的市场前景,是实际应用非常广泛、市场需求量相对较大的一类酶[4-5]。
在1943 年,科学家Myrback 首次发现植物普鲁兰酶,1961 年,微生物普鲁兰酶被Wallenfels 和Bender 通过产气气杆菌Aerobacter aerogenes(典型菌为肺炎克雷伯氏杆菌)发酵获得[5]。之后,各国微生物及酶工程领域的相关专家和科研人员开始对微生物普鲁兰酶及其应用展开了更为深入的研究,并且在不同地区陆续发现了许多能够产生该类酶的不同种属的微生物,并筛选出了其中一些适用于工业化大生产的优良菌株,如热球菌属的Thermococcus hydrothermalis[6]、链霉菌属的Streptomyces flavochromogenes[7]、厌 氧 分 支 杆 菌 属 的Anaerobranca gottschalkii[8]、克雷伯氏菌属的Klebsislla aerogenes[9]、芽孢杆菌属的Bacillus flavocaldarius[10]、火球菌属的Pyrococcus woesei[11]、链球菌属的Streptococcus pneumonia[12]等。
目前,国内淀粉工业中使用的普鲁兰酶大多都是从国外进口,价格昂贵、成本太高,迫切需要国内科研人员筛选出能够应用于工业化生产的优良普鲁兰酶酶源菌并对其发酵生产的普鲁兰酶进行应用研究工作,力争研究和开发出我国自主知识产权的普鲁兰酶酶产品,以摆脱对国外进口的依赖。经过这些年的努力和研究,国内已有一些实验室通过纯培养或者基因重组的方法筛选得到了一些产普鲁兰酶优势酶源菌,包括产气气杆菌[13]、嗜热厌氧菌[14]、厌氧古细菌[15]、嗜热芽孢杆菌[16]、栖热水生菌、多粘芽孢杆菌等,但是还未见报道通过实验方法筛选获得解淀粉芽孢杆菌属来源的普鲁兰酶,本研究从甘肃定西淀粉加工厂附近的土壤中分离得到一株产普鲁兰酶优势菌株AI-1,经鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),并对其发酵产酶条件做了进一步的研究。
1 实验部分
1.1 材料与仪器
以甘肃省定西市某淀粉加工厂附近的土壤作为试验分离材料,分离出一株产酶活性较高的普鲁兰酶酶源菌AI-1。
酵母膏、牛肉膏、蛋白胨均为生物试剂;曲里苯蓝、普鲁兰糖均为优级纯;氢氧化钠、氯化钠、可溶性淀粉、无水葡萄糖、硫酸镁、磷酸氢二钾均为分析纯。
DK-S12 电热恒温水浴锅;FA1204B 电子分析天平;LDZM-75 型立式智能压力蒸汽灭菌器;SW-CJ-1FD 型单人单面净化工作台;HG303-4A 电热恒温培养箱;TU-1800pc 紫外可见分光光度计;GL-21M湘仪离心机;PHS-3C 型酸度计;eppendorf 移液枪;THZ-82N 台式恒温振荡器培养箱。
1.2 培养基
1.2.1 平板分离培养基(LBSP 培养基) 蛋白胨1%,酵母膏0.5%,NaCl 1%,琼脂1.5%,普鲁兰糖0.01%,曲里苯蓝0.01%,用5 mol/L NaOH 调pH至7.0,0.1 MPa 灭菌30 min。
1.2.2 分离纯化培养基 可溶性淀粉1%,蛋白胨1%,NaCl 0. 5%,K2HPO40. 1%,MgSO4·7H2O 0.05%,酵母膏1%,琼脂2%,pH 7.0,0.1 MPa 灭菌30 min。
1.2.3 种子培养基 酵母膏1%,蛋白胨1%,NaCl 0.5%,pH 7.0 ~7.2,0.1 MPa 灭菌30 min。
1.2.4 摇瓶发酵培养基 可溶性淀粉1%,蛋白胨1%,NaCl 0. 5%,K2HPO40. 1%,酵 母 膏1. 5%,MgSO4·7H2O 0. 05%,pH 7. 0,0. 1 MPa 灭 菌30 min。
1.2.5 斜面保藏培养基 蛋白胨1%,NaCl 0.5%,K2HPO40.1%,MgSO4·7H2O 0.05%,酵母膏1%,琼脂2%,pH 7.0,0.1 MPa 灭菌30 min。
1.3 菌株筛选[17]
装有9 mL 无菌水的试管中,加入含土样的菌液1.0 mL,梯度稀释获得浓度分别为10-4,10-5,10-6,10-7的菌悬液。从中任意选取3 个稀释度,用Eppendorf 移液枪准确吸取1 mL 于干净无菌的培养皿中(每一个稀释梯度做2 个平行),将温度冷却到45 ℃左右的平板分离培养基溶液倒入无菌培养皿中,每个培养皿倒入12 ~15 mL,摇匀,待培养皿中的琼脂培养基凝固后,在恒温恒湿培养箱中30 ℃下倒置培养48 h。采用曲里苯蓝法筛选产普鲁兰酶酶源菌。当产普鲁兰酶酶源菌代谢产生普鲁兰酶时,会水解培养基成分中的普鲁兰多糖,使得菌株周围的蓝色褪去,出现透明圈。从分离培养基上挑取菌落形态一致,H/C 值(透明圈直径与菌落直径的比值)较大的单菌落,划线纯化后于接种于斜面保藏培养基上保藏。进行酶活力测定和形态及生理化鉴定。
普鲁兰酶活性定义:在50 ℃,pH 值6.0 条件下,每分钟催化分解普鲁兰糖产生1 μmol 葡萄糖所需的酶量为1 个酶活单位,以U/mL 表示。
1.4 制作葡萄糖标准曲线
精确称量葡萄糖(105 ℃温度下干燥恒重)0.100 0 g,在 100 mL 容 量 瓶 中 配 制 成 浓 度1.0 mg/mL的母液。用移液枪准确量取0,0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6 mL 母液于9 支试管中,用pH 6.0 浓度0.02 mol/L 的醋酸-醋酸钠缓冲液补充至2 mL。加入1.0 mL DNS(3,5-二硝基水杨酸)溶液,在沸水浴中放置5 min。冷却,定容到15 mL,用紫外分光光度计测量波长540 nm 下的OD540nm值(每管中的溶液做3 次平行,取平均值)。以葡萄糖的浓度(mg/mL)为横坐标、OD540nm值为纵坐标,绘制葡萄糖标准曲线图(图1),得到回归方程Y =0.926 2X+ 0.032,R2=0.997 2。

图1 葡萄糖含量标准曲线Fig.1 Standard curve of glucose
1.5 普鲁兰酶酶活力测定
采用DNS 法(3,5-二硝基水杨酸法)测定普鲁兰酶活性。装有1.0 mL 0.5%的普鲁兰糖溶液的试管中,加入1.0 mL 浓度0.02 mol/L pH 6.0 的醋酸-醋酸钠缓冲液,1.0 mL 普鲁兰酶酶液(即处理后的菌种发酵液),在恒温水浴锅中50 ℃下反应20 min。加入1.0 mL DNS 溶液,沸水浴5 min。冷却后,加蒸馏水定容至15 mL,振荡摇匀后测OD540nm值。
酶活力(U/mL)=[(Y-0.032)/0.926 2]×Df×1 000/(180 ×t)
式中,Y 为吸光度值OD540nm;Df 为待测酶液的稀释倍数;t 为反应时间(min);180 为葡萄糖的分子量;1 000 为单位换算倍数。
1.6 形态及生理生化鉴定
依据《常见细菌系统鉴定手册》[18]和《伯杰细菌鉴定手册(第八版)》[19]对产普鲁兰酶菌株进行初步鉴定。
1.7 菌株16S RNA 序列鉴定及系统发育树构建[20]
挑取纯化后的普鲁兰酶酶源菌单菌落接种于装有10 mL 发酵培养基的三角瓶中,放入恒温振荡培养箱中,在温度30 ℃,转速150 r/min 的条件下振荡培养24 h。用移液枪准确的吸取2 mL 菌液,在低温高速冷冻离心机中以12 000 r/min 离心2 min,去除上清液,按照生工SK1201-UNIQ-10 柱式细菌基因组DNA 抽提试剂盒说明书的试验步骤提取菌株的基因组DNA,作为模板。
首先进行16S rDNA 的扩增,采用引物(上游:5’-CAGAGTTTGATCCTGGCT-3’;下游:5’-AGGAGGTGATCCAGCCGCA-3’),建 立 PCR 反 应 体 系(25 μL):上游引物0.5 μL;下游引物0.5 μL;Template(基因组)1 μL;dNTP 0.5 μL;Taq (5 U/μL)0.2 μL;10 ×反应缓冲液2.5 μL;最后加水补充至25 μL。
设定PCR 程序:在高温94 ℃下预变性5 min 后进入循环程序:94 ℃下变性30 s,55 ℃下退火35 s,72 ℃下延伸1 min,共计35 个循环,最后在72 ℃下保温8 min。
用Eppendorf 移液枪准确地吸取50 μL 进行2% 琼脂糖凝胶电泳,根据PCR 产物电泳结果切割所需DNA 目的条带,纯化以后进行后续DNA 的测序工作,将提取的基因组DNA 委托上海生工生物工程有限公司进行16S rDNA 基因扩增序列测序。在GenBank 数据库中提交测序结果,通过BLAST 程序提交得到的16S rRNA 序列,最后在NCBI 在线数据库中进行同源序列检索。将目标菌株的16S rDNA和在BLAST 程序中检索到的与之有较高同源性的模式菌株的16S rDNA 作最大同源性比较分析,并利用系统发育软件MEGA 4.0 采用邻位相邻法构建系统发育树,同时进行重复次数为1 000 次的Bootstrap 测试,最终确定目标菌株的分类地位。
2 结果与讨论
2.1 产普鲁兰酶菌株筛选
在所采集的土壤中,共分离出在曲里苯蓝培养基上产生透明圈的菌株12 株,其中菌株AI-1 的H/C 值最大。
将产普鲁兰酶酶源菌经分离纯化后,接种到摇瓶发酵培养基中30 ℃、150 r/min 振荡培养72 h,测定发酵液中普鲁兰酶的酶活,结果见图2。

图2 菌株发酵产酶能力比较Fig.2 The comparison of several strains in fermentation enzyme
由图2 可知,所选菌株在摇瓶发酵液体培养时都能产生胞外普鲁兰酶,其中,菌株AI-1 的酶活达到了2.45 U/mL,而其他菌株所产的普鲁兰酶酶活均低于2.0 U/mL;故选取菌株AI-1 作为目标菌株,进行发酵条件优化等一系列后续研究。
2.2 菌株鉴定
2.2.1 AI-1 菌株个体形态 菌株AI-1 革兰氏染色呈阳性,其显微镜下的镜检形态见图3。
2.2.2 菌落群体形态 在平板培养基上生长的菌株AI-1 的菌落呈白色(图4),单个菌落近似圆形,边缘较整齐,半透明,菌落表面光滑湿润。

图3 菌株AI-1 的镜检形态Fig.3 The micrograph of bacterial strain AI-1
图4 AI-1 的平板培养菌落形态Fig.4 Colonial morphology of bacterial strain AI-1
由图3 可知,菌体形态为长杆状,大小为0.8 μm×3.2 μm,形成芽孢,芽孢呈现卵圆形,单个或成链排列。
2.2.3 菌株生理生化鉴定 菌株AI-1 的生理生化特征见表1。

表1 菌株AI-1 的生理生化特征Table 1 The physiological and biochemical characteristics of bacterial strain AI-1
参照《伯杰氏细菌鉴定手册》(第八版)中提供的检索表和《常见细菌系统鉴定手册》分类系统中的描述,对比菌株AI-1 的镜检、平板形态特征及其一系列菌株生理生化鉴定结果,初步鉴定菌株AI-1属于芽孢杆菌属。
2.2.4 菌株16S rRNA 基因序列鉴定及构建系统发育树 由图5 可知,经电泳检测,其PCR 产物为一个大小约为1 400 bp 的特异性片段,菌株AI-1 的16S rRNA 全长序列大小为1 451 bp。在NCBI 在线数据库中进行序列比对的过程中发现,其与Bacillus属中编号为HE716936.1 的菌株Bacillus amyloliquefaciens 的同源性高达到99.6%,借助构建系统发育MEGA 4.0 软件生成直观清晰的系统发育树见图6。

图5 菌株AI-1 的PCR 产物电泳图谱Fig.5 The electrophoresis pattern of PCR products of bacterial strain AI-1

图6 菌株AI-1 的系统发育树Fig.6 The system evolutionary tree of strain AI-1
由图6 可知,菌株AI-1 与Bacillus amyloliquefaciens(KJ009413.1)处在同一个分支上,通过1 000次bootstrap 测试分析支持该分支;并且在GenBank数据库比对过程中发现,菌株AI-1 与模式菌株Bacillus amyloliquefaciens(KJ009413.1)的16S rRNA 基因序列相似度为99.6%。由此推断,菌株AI-1 为Bacillus 属中的Bacillus amyloliquefaciens。
综上所述,结合菌株形态学特征、生理生化试验结果和菌株16S rRNA 序列分析鉴定及系统发育分析结果,最终将菌株AI-1 鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
2.3 发酵产酶培养基及发酵条件的优化

图7 不同碳源对产酶的影响Fig.7 The effect of different carbon sources on enzyme production
2.3.1 碳源种类对发酵产酶的影响 在培养基中加入不同类型的碳源对菌株产生普鲁兰酶的影响见图7。由图7 可知,在培养基中加入可溶性淀粉的效果最好,可以使胞外酶活达到4.16 U/mL 的水平;其次是支链淀粉,酶活达3.86 U/mL;而在使用葡萄糖或者蔗糖作为碳源时,酶活却很低。此外,使用普鲁兰糖、马铃薯淀粉或者玉米淀粉作为碳源时,也能产生较高酶活的普鲁兰酶。因此,也间接的证明了普鲁兰酶是一种诱导型的酶,只有当环境中存在含有α-(1→6)糖苷键的诱导物时,普鲁兰酶才能得到合成,并具有较高的酶活。
2.3.2 可溶性淀粉浓度对发酵产酶的影响 可溶性淀粉的添加量对菌株产酶能力的影响见图8。

图8 可溶性淀粉浓度对产酶的影响Fig.8 Effect of different concentrations of soluble starch on Pullulanase production
由图8 可知,可溶性淀粉的添加量(即碳源的浓度)对菌株产酶能力有显著影响,添加量过少,不仅满足不了菌体生长所需要的能量,而且也不能充分地诱导菌株发酵产生普鲁兰酶;添加量过多,同样不利于普鲁兰酶的积累,虽然理论上可以为菌株产酶提供更多的作用底物和生长所需能量,但高浓度的碳源底物反而会由于底物抑制的缘故对菌株产酶产生抑制作用。当可溶性淀粉的浓度到达1.5 g/mL 时,酶活最高,继续增加可溶性淀粉的浓度,酶活则开始降低。
2.3.3 不同种类的氮源对发酵产酶的影响 几种常见的有机氮源和无机氮源对菌株产酶的影响见图9。

图9 不同种类氮源对产酶的影响Fig.9 The effect of different nitrogen sources on enzyme production
由图9 可知,有机氮源中的酵母膏对菌体的生长和产酶优于其他氮源,蛋白胨其次;与无机氮源如硝酸铵、醋酸铵等相比,有机氮源(如酵母膏、蛋白胨)更有利于菌体发酵产酶,而在试验过程中也发现,当在发酵培养基中添加了无机氮源以后,随着无机氮源的被利用,发酵培养基的pH 值也会发生变化,从而引起菌体生长环境酸碱度的变化,对菌体发酵产酶产生一定的影响。所以,为了避免菌体生长环境pH 发生变化,宜选取有机氮源作为菌体生长和发酵所需的氮源。
2.3.4 酵母膏浓度对发酵产酶的影响 酵母膏的添加量对普鲁兰酶产生的影响见图10。

图10 酵母膏浓度对产酶的影响Fig.10 Effect of different concentrations of yeast extract on Pullulanase production
由图10 可知,随着酵母膏浓度的增大,菌体所产普鲁兰酶的酶活也随之增大,浓度1.0 g/mL 时,酶活达到最大;之后随着酵母膏浓度的继续增大,普鲁兰酶的酶活开始呈下降趋势,这可能是由于加入的氮源量过多时,会导致微生物菌体的生长繁殖过快,不利于代谢产物普鲁兰酶的积累。
有关研究表明[21],产酶微生物添加复合氮源时,产酶的效果要优于单一氮源,而且有机氮源优于无机氮源,并且在考察不同氮源对普鲁兰酶的影响中发现,蛋白胨与其他有机氮源如酵母膏、牛肉膏等组合作为微生物菌体氮素的来源时,菌体在培养基中的生长代谢更旺盛、发酵产酶能力更佳,而且蛋白胨不仅富含有机氮化合物,也含有一些维生素和糖类,作为微生物培养基的成分,十分有利于微生物菌株的生长代谢[22]。因此,本研究也考察了单一有机氮源与复合有机氮源对菌株发酵产酶的影响,即在单一氮源的基础上添加1%的蛋白胨作为复合有机氮源的组合,结果见图11。
由图11 可知,产酶微生物在添加复合氮源的发酵培养基中产酶效果要优于只添加单一碳源的培养基,而其中酵母膏和蛋白胨的组合对于菌株产酶效果最佳,酶活可达4.0 U/mL 以上。

图11 复合氮源对产酶的影响Fig.11 The effect of complex nitrogen sources on enzyme production
2.3.5 培养温度对发酵产酶的影响 培养温度对普鲁兰酶产量的影响见图12。

图12 培养温度对产酶的影响Fig.12 The effect of temperature on enzyme production
由图12 可知,当温度从30 ℃升高到36 ℃左右时,菌体发酵液中的酶活力随着温度的升高而增大,之后,随着温度的继续升高酶活力呈急剧下降趋势,到达50 ℃时发酵液中的普鲁兰酶接近失活。
2.3.6 发酵培养基的初始pH 对发酵产酶的影响培养基初始pH 对产酶的影响见图13。

图13 发酵培养基初始pH 对产酶的影响Fig.13 The effect of initial pH culture medium on enzyme production
由图13 可知,菌株所产普鲁兰酶的酶活随着pH 的增大而增大,pH 为7.0 左右时,酶活力达到最大;之后,随着pH 的继续增大,酶活呈现急剧下降趋势。
2.3.7 发酵时间对发酵产酶的影响 将接种菌株AI-1 的种子液接入装有100 mL 摇瓶发酵培养基的250 mL 容量三角瓶中,在30 ℃、150 r/min 恒温振荡培养箱中进行培养,每隔6 h 取样在600 nm 波长下测定培养液的吸光值(以OD600 表示),以未加菌液的培养液作为空白液,结果见图14。

图14 菌株AI-1 生长曲线Fig.14 The growth curve of strain AI-1
由图14 可知,解淀粉芽孢杆菌AI-1 在经历了短暂的延迟期之后,在培养18 h 之后进入对数生长期(18 ~60 h),菌体生长速率加快、代谢旺盛,培养基中的菌数倍增;之后菌株进入生长稳定期(60 ~84 h),通常在此时期,大多数细菌开始进行一系列的次级代谢反应,从而产生大量的次生代谢物(如抗生素、乳酸等),因此此时期又可以被称作代谢产物合成期,一般在生产实践中稳定期的生长规律具有重要的指导意义;继续培养84 h 以后,菌株的生长进入衰亡期,菌体数量开始呈现下降趋势,个体死亡速度超过新生速度,整个群体呈现负生长状态。
根据上述测定结果,试验中将种子培养液以2%的接种量接入装有100 mL 摇瓶发酵培养基的250 mL 容量三角瓶中,在前面筛选的最佳发酵条件下分别培养42,48,54,60,66,72,78,84 h,测定不同发酵时间段内发酵液中的酶活力,以确定最佳发酵周期,结果见图15。

图15 发酵时间对产酶的影响Fig.15 The effect of fermentation time on enzyme production
由图15 可知,在菌株发酵培养的开始阶段,发酵所产的普鲁兰酶活力较低,但是随着菌体大量生长繁殖,发酵液中所产生的普鲁兰酶酶活力也随着菌体细胞数量的增加而不断地增大,在发酵60 h 以后,菌体细胞的生长繁殖进入稳定期,此时酶活仍然呈现出增大的趋势,直到在发酵72 h 时,发酵液中的酶活力达到最大,此后酶活力略有下降。
2.3.8 接种量对发酵产酶的影响 菌体接种量对发酵产酶的影响见图16。
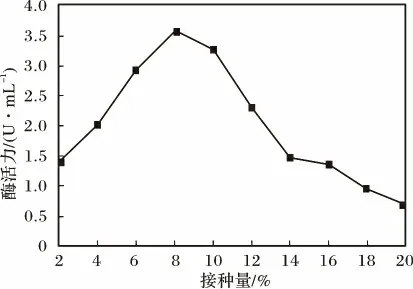
图16 菌体接种量对发酵产酶的影响Fig.16 The effect of amount of inoculation on enzyme production
由图16 可知,当菌体的接种量小于8%时,发酵液中普鲁兰酶酶活会随着接种量的增大而增高;接种量8%时,发酵液中的普鲁兰酶酶活达到最高,继续增大接种量,酶活力呈现出明显的下降趋势。这是因为接种量的高低会影响到接种后微生物在培养基中营养物质消耗的速率,从而影响菌株发酵产酶。当接种量过小时,菌体细胞密度小,菌体生长繁殖缓慢,发酵迟缓,产酶受限;当接种量过大时,由于菌体数量太大,导致培养基中的营养物质和能量消耗过快,容易造成培养环境缺氧和菌体过快衰老,从而不利于代谢产物酶的积累。因此,选择接种量8%(V/V)为最适接种量。
2.3.9 摇床转速对发酵产酶的影响 摇床转速对发酵产酶的影响见图17。

图17 摇床转速对产酶的影响Fig.17 The effect of shaker speed on enzyme production
由图17 可知,菌株AI-1 发酵液中的普鲁兰酶酶活随着摇床转速的增大而增高,当摇床转速150 r/min 时,酶活达到最大;之后,随着摇床转速的继续增大,酶活略有下降,但基本趋于稳定。其原因是当摇床转速达到150 r/min 时,发酵液中溶液氧的浓度已经能够满足菌体的生长需求,即达到了溶解氧的供需平衡。因此,菌株AI-1 发酵的最适摇床转速确定为150 r/min。
综上所述,菌株AI-1 的最适培养基和最佳发酵培养条件为:可溶性淀粉1.5%,酵母膏1%,蛋白胨1%,NaCl 0. 5%,K2HPO40. 1%,MgSO4·7H2O 0.05%,培养温度36 ℃,发酵培养基初始pH 7.0,接种量8%(V/V),摇床转速150 r/min,发酵周期72 h。在此优化发酵条件下,对菌株AI-1 进行培养发酵产酶酶活测定,重复3 次,结果见表2。

表2 优化条件下菌株AI-1 的产酶酶活Table 2 The enzyme activity produced by strain AI-1 under optimal conditions
由表2 可知,通过对菌株发酵培养及成分的调整与发酵条件的优化[23],菌株AI-1 所产普鲁兰酶酶活力由最初的2.35 U/mL 提高到了4.52 U/mL。
3 结论
从甘肃省定西市境内某淀粉加工厂附近的土壤中分离得到一株产普鲁兰酶优势酶源菌AI-1,通过形态学、生理生化试验及16S rRNA 序列鉴定并对其进行系统发育分析,最终鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。其最佳产酶发酵培养基为:可溶性淀粉1.5%,酵母膏1%,蛋白胨1%,NaCl 0.5%,K2HPO40.1%,MgSO4·7H2O 0.05%;最佳发酵条件为:培养温度36 ℃,发酵培养基初始pH 7.0,接种量8%(V/V),摇床转速150 r/min,发酵周期72 h。在此优化条件下,菌株AI-1 发酵所产普鲁兰酶的酶活由最初的2. 45 U/mL 提高到4.52 U/mL,酶活提高84.5%,为我国淀粉加工工业的酶制剂生产提供了新的菌种资源,并为传统发酵生产酶制剂工艺的现代化改造和技术升级提供理论依据和参考。
[1] 马海蓉,李艳,高文慧,等. 普鲁兰多糖生产菌种及其在农产品保鲜中的应用[J]. 河北省科学院学报,2000,17(2):124-128.
[2] Kang Jinho,Kyung-Min Park,Kyoung-Hwa Choi,et al.Molecular cloning and biochemical characterization of a heat-stable type I Pullulanase from Thermotoga neapolitana[J]. Enzyme and Microbial Technology,2011,48:260-266.
[3] Monika Doman-Pytka,Jacek Bardowski. Pullulan degrading enzymes of bacterial origin[J].Critical Review in Microbiology,2004,30:107-121.
[4] 程景伟,景建洲,杨雪鹏,等. 普鲁兰酶产生菌的筛选鉴定及其发酵条件优化与酶学性质研究[J]. 广东化工,2012,39(6):37-39.
[5] Brock T D,Freeze H. Thermus aquaticus gen. n. and sp.n.a nonsporulating extreme thermophile[J]. Journal of Bacteriology,1969,98(1):289-297.
[6] Gantelet H,Duchiron F. Purification and properties of a thermoactive and thermostable Pullulanase from Thermococcus hydrothermalis,a hyperthermophiles archaeon isolated from a deep-sea hydrothermalvent[J].Appl Microbiol Biotechnol,1988,49:770-777.
[7] Ohba R,Chaen H,Hayashi S,et al. Immobilization of streptomyces flavochromogenes pullulanase on tannic acid and TEAE-cellulose[J]. Biotechnol Bioeng,1987,20(5):665-676.
[8] Bertolado C,Armbrecht M,Becker F,et al. Cloning,sequencing,and characterization of a heat-and alkali-stable type I Pullulanase from Anaerobranca gottschalkii[J].Appl Environ Microbiol,2004,70(6):3407-3416.
[9] Konishi Y,Amemura A,Tanabe S,et al. Immunological study of Pullulanase from klebsiella strains and the occurrence of this enzyme in the enterobacteriaceae[J]. Int J Syst Bact,1979,29(1):13-18.
[10]Suzuki Y,Hatagaki K,Oda H,et al.A hyperthermostable pullula-nase produced by an extreme thermophile,Bacillus flavocadarius KP1228,and evidence for the proline theory of increasing protein thermostability[J]. Appl Microbiol Biotechnol,1991,34:707-777.
[11] Rudiger A,Jorgenson P L,Antranikian G,et al. Isolation and characterization of a heat-stable Pullulanase from the hyperthermophilic archaeon Purococcus woesei after cloning and expression of its gene in E.coli[J].Appl Environ Microbiol,1995,61:567-575.
[12]Bongaerts R J M,Heinz H P,Hadding U,et al.Antigenicity,expression,and molecular characterization of surfacelocated pullulanase of Streptococcus pneumoniae[J].Infec Immunity,2000,68(12):7141-7143.
[13]朱梦,孙海彦,彭明.普鲁兰酶产生菌的筛选鉴定与发酵条件的研究[J].食品研究与开发,2011,32(7):136-140.
[14]Saha B C,Lamed R,Lee C Y,et al.Characterization of an endo-acting amylopullulanase from Thermoanaerobacter strain B6A[J]. Appl Environ Microbiol,1990,54(4):881-886.
[15]Brown S H,Kelly R M.Characterization of amylolytic enzymes,having both α-1,4 and α-1,6 hydrolytic activity,from the Thermophilic Archaea Pyrococcus furiosus and Thermococcus litoralis[J].Appl Environ Microbiol,1993,59(8):2614-2621.
[16]Suzukl Y,Hataga K I,Oda H.A hyperthermostable Pullulanase produced by an extreme thermophile,Bacillus flavocaldarius KP 1228,and evidence for the proline theory of increasing protein thermostability[J]. Appl Environ Microbiol,1991,34(6):707-714.
[17]马向东,柯涛,熊兰,等.一种鉴定多糖水解酶类及其产生菌的新方法[J]. 微生物学报,2007,47(6):1102-1104.
[18]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[19]R.E.布坎南,N.E.吉布斯.伯杰细菌鉴定手册[M].8版.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984.
[20]宋勇强.甘肃传统酿造食醋中醋酸菌多样性研究及优良醋酸菌的筛选[D].兰州:甘肃农业大学,2013.
[21]乔宇,丁宏标,闫俊艳,等.一株普鲁兰酶产生菌的分离鉴定及发酵条件的优化[J].中国农业科技导报,2012,14(4):81-86.
[22]魏炳卓,孙杰,王晶,等.普鲁兰酶产生菌的筛选、鉴定及其发酵条件优化[J]. 化学与生物工程,2008,25(10):35-38.
[23]宋勇强,贠建民,安志刚,等.基于正交设计与人工神经网络模型的醋酸菌A3 菌株醋酸发酵条件优化[J].食品工业科技,2013,34(5):142-150.
