糖化酶发酵生产中溶解氧的研究
2015-04-12毕静
毕 静
(江苏经贸职业技术学院科技处,江苏 南京 211168)
21世纪科技与经济发展的关键技术是生物技术,以工业生物催化技术为重点的工业生物技术在其中占有极其重要的地位,而工业生物催化的核心是生物酶的发现和高效生产。糖化酶是生物酶中应用最广和产量最大的一种酶制剂。糖化酶发酵过程主要是黑曲霉经深层通风培养后菌体生长和代谢产物积累。在菌体生长、代谢产物积累的过程中,发酵液中溶解氧都需控制在一定范围内,以达到发酵产酶转化率的最佳水平,以最低的能源消耗达到最大的产出,即高效生产[1-2]。本试验主要研究在不改变原糖化酶发酵条件的基础上通过优化无菌空气中氧的含量达到改变溶解氧的水平对糖化酶发酵的影响。对于采用高产菌株的好氧发酵来说,溶氧浓度是极其重要的参数,发酵时若溶解氧水平低,微生物就处于缺氧状态,生长、代谢将受到抑制,代谢产物将减少;若溶解氧过饱和,菌体细胞生长、代谢将处于旺盛状态,但同样不利于菌体持续产酶,容易造成菌体衰老[3-5]。
在糖化酶常规发酵过程中,发酵接种前定标相对溶解氧水平为100%,接种后溶解氧开始快速下降,8~12 h后,逐步下降至20%~30%,直至发酵结束。影响溶解氧的因素有很多,与发酵过程中的各种参数有关,同时与发酵罐中各种物理、化学和微生物因素的影响有关,但主要集中在氧的溶解和传递这两个方面。控制溶氧量通常应用通入纯氧的方式提高氧分压;控制氧传递速率包括发酵温度、罐压、通风量、搅拌转速、发酵液的黏度、表面张力、流动状态、发酵罐的结构、各部分尺寸的比例、空气分布器的形式等[6-8]。本研究利用3因素3水平正交试验法,通过对罐压、搅拌速度和压缩空气中氧浓度这3个对发酵液溶解氧有重大影响作用的因素进行发酵产酶条件优化,以提高糖化酶的发酵酶活,为糖化酶的高效生产提供一种新的思路。
1 材料与方法
1.1 材料与试剂
糖化酶生产用菌为黑曲霉(Aspergillus niger):实验室保藏。
乙酸-乙酸钠缓冲溶液(pH 4.6)、硫代硫酸钠标准溶液(0.05 mol/L)、碘溶液(0.1 mol/L)、氢氧化钠溶液(0.1 mol/L)、200 g/L可溶性氢氧化钠溶液、硫酸溶液(2 mol/L)、可溶性淀粉溶液(分析纯):江苏博立公司。发酵培养基:淀粉30%,豆饼粉5%,玉米浆5%,(NH)2SO40.5%,自然pH值。
1.2 仪器与设备
FZ-E型2吨发酵罐:江苏博立公司。
1.3 方法
1.3.1 发酵方式
发酵条件:发酵温度34 ℃,搅拌转速180 r/min,罐压0.1 MPa,发酵时间120 h,接种量10%。
种子培养条件:培养温度32 ℃,搅拌转速240 r/min,罐压0.05 MPa,发酵时间48 h。
1.3.2 酶活力的测定方法
吸取发酵液1.00 mL移入250 mL容量瓶中,用乙酸缓冲液定容至刻度,摇匀。通过4层纱布过滤,滤液供测定用。
于甲、乙两支50 mL比色管中,分别加入可溶性淀粉25mL及缓冲液5mL,摇匀后,于40℃恒温水浴中预热5 min。在甲管(样品)中加入待测酶液2 mL,立刻摇匀,在此温度条件下准确反应30 min,立刻各加入氢氧化钠溶液(200 g/L)0.2 mL,摇匀,将两管取出迅速冷却,并于乙管(空白)中补加待测酶液2 mL,吸取上述反应液与空白液各5 mL,分别置于碘量瓶中,准确加入碘溶液10 mL,再加氢氧化钠溶液15 mL,摇匀,密塞,于暗处反应15 min。取出,加硫酸溶液2 mL,立即用硫代硫酸钠标准溶液滴定,直至蓝色刚好消失为其终点。通过计算得出酶活力,计算公式如下:

式中:X为样品的酶活力,U/mL;A为空白消耗硫代硫酸钠溶液的体积,mL;B为样品消耗硫代硫酸钠溶液的体积,mL;c为硫代硫酸钠溶液的浓度,mol/L;90.05为与1 mL硫代硫酸钠标准溶液(1 mol/L)相当的以克表示的葡萄糖的质量;32.2为反应液的总体积,mL;5为吸取反应液的体积,mL;2为吸取酶液2 mL,换算为1 mL;n为稀释倍数;2为反应30 min,换算成1 h[9-10]。
1.3.3 单因素试验
(1)罐压对酶活的影响
在发酵温度34℃、搅拌转速为180 r/min、发酵时间120 h,接种量10%、氧浓度为25%的条件下,调节罐压分别为0.05 MPa、0.10 MPa、0.15 MPa、0.20 MPa进行发酵试验。
(2)搅拌转速对酶活的影响
在发酵温度34 ℃、罐压为0.10 MPa、发酵时间120 h,接种量10%、氧浓度为25%的条件下,调节搅拌转速分别为120 r/min、180 r/min、240 r/min、300 r/min进行发酵试验。
(3)氧浓度对酶活的影响
在发酵温度34 ℃、搅拌转速为180 r/min、发酵时间120 h,接种量10%、罐压为0.10 MPa的条件下,调节氧浓度为21%、23%、25%、27%进行发酵试验。
1.3.4 正交试验设计
根据前期的研究,选取罐压、搅拌速度和压缩空气中氧浓度作用为考察因素,酶活力为评价指标进行3因素3水平的正交试验设计。发酵时间均为120 h,即时取样测定发酵醪糖化酶活力,正交试验因素与水平见表1。

表1 操作条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for operation conditions optimization
2 结果与分析
2.1 单因素试验结果
2.1.1 罐压对酶活的影响
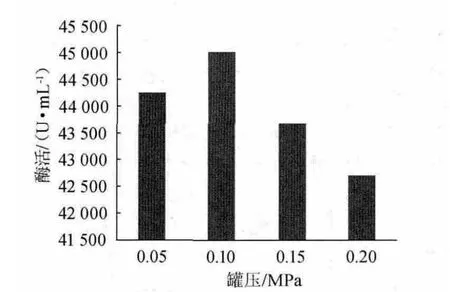
图1 罐压对酶活的影响Fig.1 Effect of vessel pressure on enzyme activity
罐压对酶活的影响见图1。由图1可知,罐压对发酵结果影响不大,随着罐压的增加,酶活呈先上升后下降的趋势,在罐压0.10 MPa时酶活达到最大。保持一定的罐压,即可保证发酵水平。究其原因,增加罐压确能提高溶解氧水平,但同时也增加了其余气体(如CO2)的浓度,且CO2在水中的溶解度比氧高30倍,在较高的罐压下,不利于液相中CO2的排除,会影响到菌体的生长、代谢。因此,在实际发酵过程中,盲目增加罐压而提高通气量不一定就能提高发酵转化率,反而会增加空气过滤器的负担和增加染菌的可能性。故单因素试验选择罐压为0.10 MPa[11-12]。
2.1.2 搅拌转速对酶活的影响
搅拌转速对酶活的影响见图2。由图2可知,搅拌转速对发酵结果影响显著,随着搅拌转速的增加,酶活呈先上升后下降的趋势,在搅拌转速为180 r/min时酶活最高,超过180 r/min后,发酵转化率反而开始下降,因为高转速的搅拌,产生了很大的剪切力,有可能导致微生物菌种受损,造成菌体生长缓慢和产物的失活,而且搅拌功率过大,将导致系统能耗的增加,造成资源浪费。故单因素试验中选择搅拌转速为180 r/min。
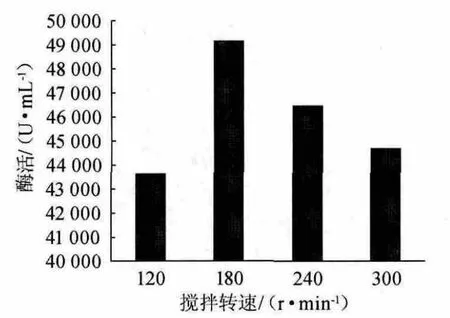
图2 搅拌转速对酶活的影响Fig.2 Effect of stirring speed on enzyme activity
2.1.3 氧浓度对酶活的影响
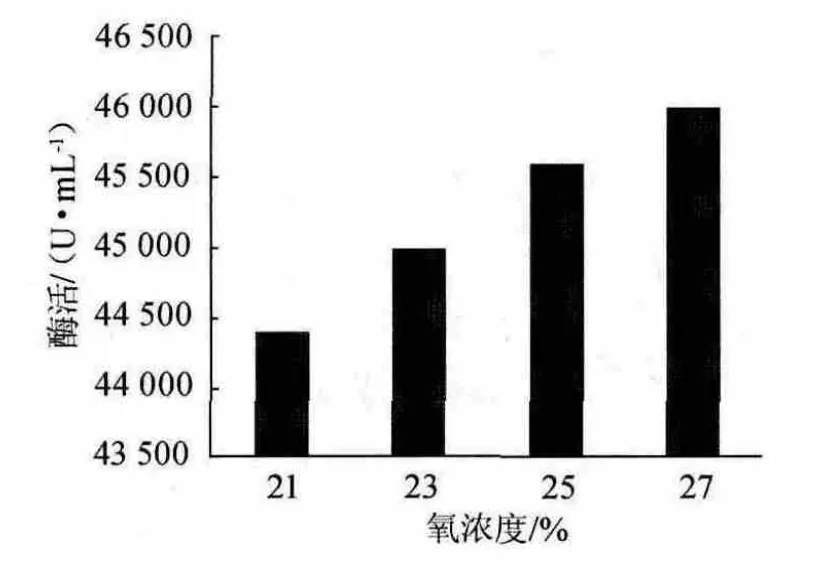
图3 氧浓度对酶活的影响Fig.3 Effect of oxygen concentration on enzyme activity
氧浓度对酶活的影响见图3。由图3可知,酶活随着氧浓度的升高呈一直上升的趋势,提高压缩空气中氧浓度,增加发酵罐内的氧分压,可以提高发酵转化率,即提高了氧传递推动力,但并不是氧浓度越高越好,如果在大生产中采用纯氧来提高压缩空气中氧浓度,增加发酵罐内的氧分压,将既费事又不经济,且纯氧易引起爆炸,因此采用富氧发生器直接接入管道,产生的氧气将直接进入压缩空气系统,只要调节富氧发生器,就可很好地控制压缩空气中的氧浓度,是一条经济的方法。但如果氧浓度超过27%,将会显著增加成本,故在正交试验时采用23%、25%和27%这3个水平。
2.2 正交试验结果
对罐压、搅拌速度和压缩空气中氧浓度3个因素进行3因素3水平的正交试验,结果见表2,方差分析见表3。
由表2可知,RB>RC>RA,最佳水平的参数为A2B2C3,即罐压0.10 MPa、搅拌转速180 r/min和氧浓度27%,此条件下酶活为49 610 U/mL。由表3方差分析可知,搅拌转速对酶活影响最大,有显著影响,其次为氧浓度,影响最小的是罐压[13-15]。
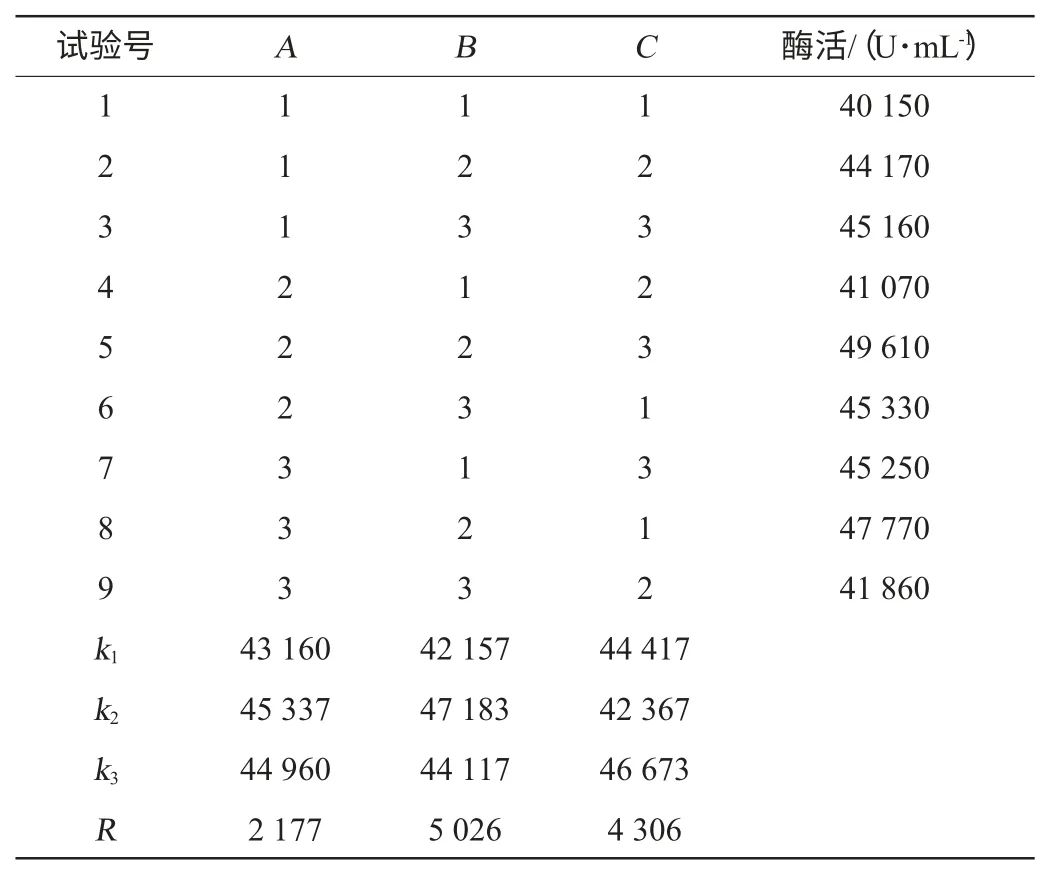
表2 操作条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for operation conditions optimization
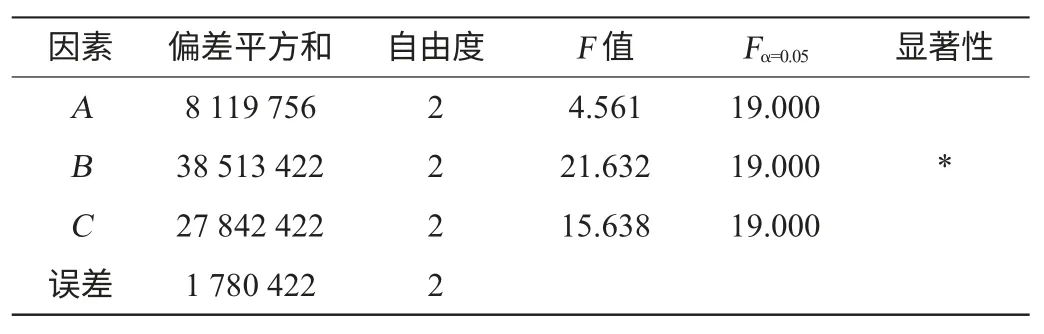
表3 正交试验方差分析Table 3 Variance analysis of orthogonal experiment
2.3 验证试验
根据最佳水平的参数进行了3批验证试验,酶活分别为49 100 U/mL、49 900 U/mL和51 000 U/mL,平均酶活为50 000 U/mL。由此可见,此方法可行,能提高糖化酶的发酵转化率。
3 结论
本研究利用3因素3水平正交试验法,通过对罐压、搅拌速度和压缩空气中氧浓度这3个对发酵液溶解氧有重大影响作用的因素进行发酵产酶条件优化,得到糖化酶的最优发酵条件为搅拌转速180 r/min,罐压0.1 MPa,无菌空气为富氧无菌空气,其氧气通过富氧发生器产生,含量为27%,在此条件下,糖化酶的酶活可达50 000 U/mL。
[1]毕 静.利用富氧发生装置提高糖化酶发酵转化率的研究[J].中国酿造,2012,31(8):143-144.
[2]王 营,董 亮,张雁铃,等.谷氨酸发酵标准溶解氧水平的确定[J].食品与发酵工业,2005,31(9):42-44.
[3]刘晓波,李宗伟,闫世梁,等.溶氧控制对氨基酸发酵的影响[J].安徽农业科学,2008(19):7977-7979.
[4]张海龙,张 帜,刘 倩.提高发酵过程中溶解氧浓度的探讨[J].山东教育学院学报,2009(3):70-72.
[5]陶国琴.谷氨酸发酵最佳供氧水平的研究[J].食品科学,1998(5):31-33.
[6]张 智,滕婷婷,王 淼,等.工业发酵中溶氧因素的探讨[J].中国酿造,2008,27(23):4-6.
[7]王宏龄,张国峰.溶解氧在谷氨酸发酵中的应用[J].发酵科技通讯,2005(1):4-7.
[8]王 粟,姜发堂.微生物发酵过程溶解氧控制[J].湖北工业大学学报,2005(4):20-22.
[9]刘咏梅,王仲石,王焕章,等.溶解氧控制与发酵过程摄氧率及鸟苷积累的关系[J].华东理工大学学报,2002(3):246-248.
[10]马晓丹,张红星,钟思琼,等.枯草芽孢杆C3 产抗菌物质发酵培养基的优化[J].中国酿造,2012,31(5):10-14.
[11]焦 龙,于宏伟,郭润芳,等.毕赤酵母工程菌pk53 产纤溶酶发酵条件的优化[J].食品与发酵工业,2011,37(3):95-99.
[12]洒荣波,石贵阳,唐瑜菁.不同补料发酵方式对重组毕赤酵母高密度培养的影响[J].食品工业科技,2010,31(11):210-212.
[13]杨穗珊,易国辉,屠发志,等.高密度发酵P.pastoris诱导表达葡聚糖外切酶[J].生物技术,2010(6):64-66.
[14]夏 姗,武福军,赵洪亮,等.毕赤酵母工程菌高密度发酵的研究进展[J].生物技术通讯,2013(1):109-112.
[15]李鹏飞,孙红兵,游丽金,等.利用毕赤酵母系统直接分泌表达具有活性的谷氨酰胺转胺酶[J].生物工程学报,2013,29(2):180-188.
