几种破除獐茅种子休眠的化学方法
2015-04-08张进红杨秋玲王国良盛亦兵
吴 波,张进红,杨秋玲,王国良,盛亦兵
(山东省农业可持续发展研究所,山东 济南250100)
獐茅(Aeluropus littoralis)是禾本科泌盐盐生植物,所具备的特殊盐腺结构使其表现出较强的耐盐性,加之其蔓延迅速,抗旱、抗病性强,耐践踏,固土护坡能力强,在绿化盐碱地、保护生态环境等方面具有巨大作用;同时獐茅还具有一定的饲用价值和药用价值[1-3]。但獐茅种子休眠性强,发芽率低,种子建植成坪困难。因此,如何打破种子休眠,提高其发芽率,已成为种子繁殖生物学中的研究热点。目前,对种子繁殖能力弱的羊草(Leymus chinensis)[4-8]、结缕草(Zoysia japonica)[9-11]等种子发芽研究较多,对獐茅研究较少。对于禾本科有休眠的种子通常采用H2SO4、NaOH、KNO3、NaCl、NaHCO3等化学试剂来处理,可在一定程度上打破种子休眠,促进种子萌发[12-15]。为此,本研究利用H2SO4、NaOH 和KNO33种化学试剂处理獐茅种子,旨在探索既能有效提高獐茅种子的发芽率,又便于在生产中推广应用的处理方法,这对提高獐茅繁殖效率、保护獐茅资源及人工建植獐茅草地具有重要意义。
1 材料与方法
1.1 试验材料
供试种子于2009 年9 月采于山东省商河县,为野生獐茅群体,室温下自然干燥后置于-2 ℃条件下保存备用。供试种子的生活力为73.3%,初始发芽指数和发芽率分别为0.11 和4.4%。
1.2 试验设计
试验分别采用3 种化学试剂处理獐茅种子:(1)将种子用98% H2SO4分别浸泡2、5、10、20、30和60 min,用水冲洗干净后置于芽床做发芽试验;(2)将獐茅种子分别用浓度为0.5%、1%、5%、10%和20%的NaOH 溶液浸种30 min,然后用水冲洗干净置于芽床做发芽试验;(3)将獐茅种子分别用浓度为0.2%、0.6%、1%、2%和5%的KNO3溶液浸种24 h 后直接置于水润湿过的滤纸芽床上进行发芽试验。对照(CK),直接将种子置于润湿芽床进行发芽试验。本试验设定发芽时间为种子置床后21 d。
参考《牧草种子检验规程——发芽试验》(GB/T 2930.4 -2001),采用直径为12 cm 的培养皿,纸质芽床,每个培养皿置入30 粒种子,每处理3 次重复,以未处理的种子为对照,发芽试验在光照培养箱内进行,15 ℃/25 ℃变温处理,高温、低温各12 h,保持芽床湿润。有明显的胚根“露白”认定为发芽,当有种子发芽时开始记录,每天观察记录1 次。试验结束时测定根长和苗长。
1.3 测定项目与方法
发芽率= (发芽种子数/供试种子总数) ×100%;
发芽指数=∑(Gt/Dt)[9];
活力指数=发芽指数×S[9]。
式中,Gt为t 日的发芽数,Dt为相应的发芽日数,S为苗平均长度。
1.4 数据分析
试验数据用Excel 2003 进行整理与绘图,用统计软件SPSS 16.0 进行差异显著性检验。
2 结果与分析
2.1 3 种化学试剂对獐茅种子发芽动态的影响
98% H2SO4浸种2 ~20 min 处理下的獐茅种子发芽率均高于对照(图1),5 min 处理发芽率最高,为13.3%,延长浸种时间,种子发芽率降低;5 ~20 min 浸种处理的种子发芽时间也早于对照,17 d 后20 min 处理发芽率与对照趋于一致;30 和60 min 浸种处理无种子发芽(图1)。
不同浓度NaOH 处理的獐茅种子发芽率均高于对照,发芽时间均早于对照,且种子发芽率随NaOH浓度的增加呈递增趋势,10% NaOH 处理种子发芽率达到42.2%(图1)。
不同浓度KNO3溶液处理的獐茅种子均在置床7 d 后开始发芽,早于对照2 d(图1)。除1% KNO3处理的獐茅种子发芽率与对照接近外,其他不同浓度KNO3处理的獐茅种子发芽率均高于对照,5%浓度处理种子发芽率最高,达到26.7%,但这些浓度处理之间差异较小。
2.2 3 种化学试剂对獐茅种子发芽指标的影响
98% H2SO4浸种5 min 处理的獐茅种子发芽指数和活力指数均最高,显著高于其他处理(P <0.05),分别为0. 49 和0. 38(表1)。浸种时间越长,獐茅种子的发芽指数和活力指数越低,浸种20 min 时与对照无显著差异(P >0.05),浸种30 和60 min 处理无发芽。不同浓度NaOH 浸种处理与对照相比,均显著提高了獐茅种子的发芽指数和活力指数,且两者均随NaOH 浓度的增加而提高,10%和20%浓度处理的种子发芽指数和活力指数无显著差异,两者均约为对照的10 倍。1% KNO3浓度处理下的獐茅种子发芽指数最低,仅为0.18,与对照无显著差异,其他浓度处理发芽指数均显著高于对照,但各处理之间差异不显著。活力指数随KNO3浓度的变化规律与发芽指数类似。
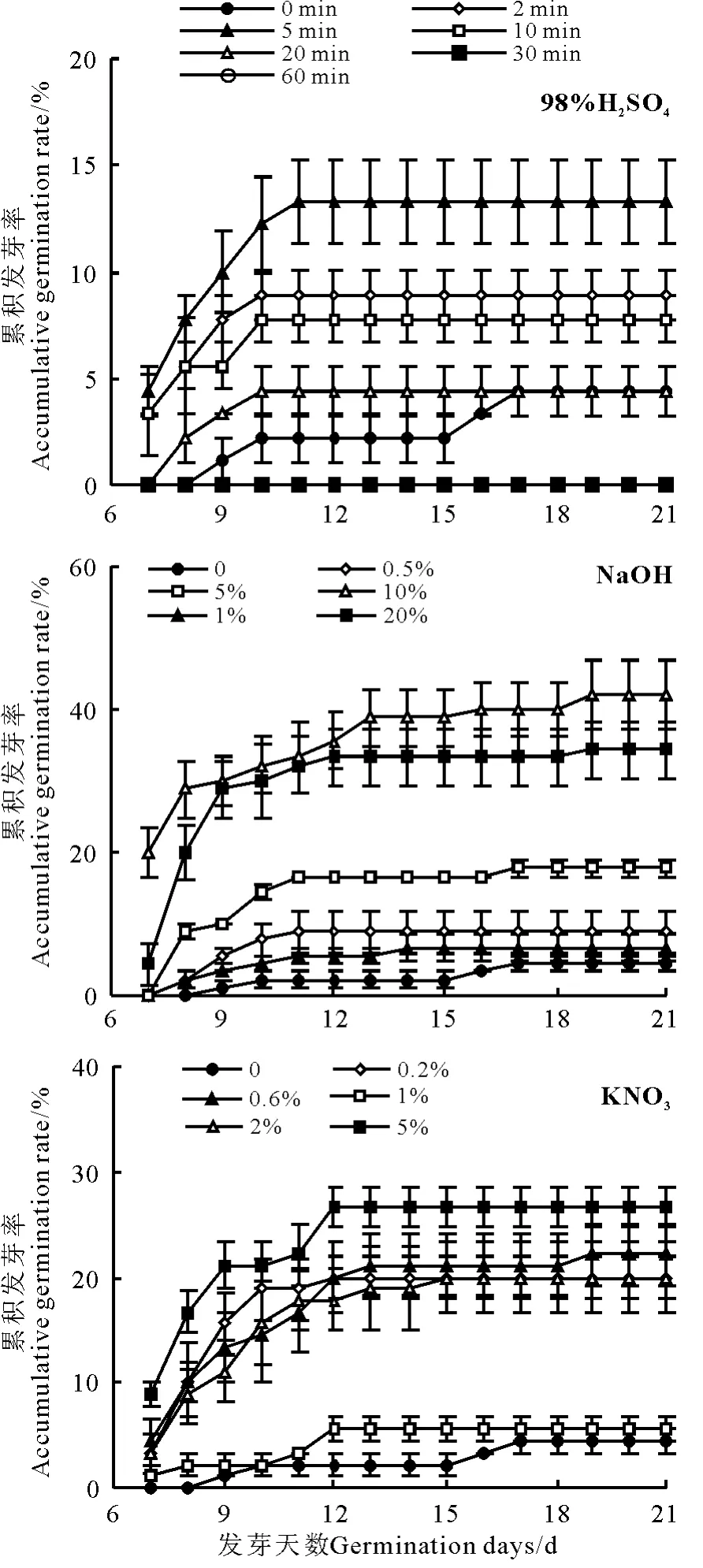
图1 3 种化学物质处理对獐茅种子发芽率的影响Fig.1 Effects of three chemical reagents on germination rate of Aeluropus littoralis
2.3 3 种化学试剂处理对獐茅幼苗生长的影响
同一化学试剂处理下,獐茅幼苗的苗长和根长变化趋势相同,3 种试剂均促进了獐茅幼苗的生长,且根的生长速度大于苗(表2)。
随着98% H2SO4浸种时间的延长,獐茅种子的苗长和根长明显减小,5 min 浸种处理下的苗长和根长显著高于对照和20 min 处理(P <0.05),分别为对照的3.19 倍和2.60 倍。1% NaOH 处理幼苗生长缓慢,增加NaOH 浓度,幼苗生长速度加快,10%和20%浓度处理效果最好,与其他处理的苗长和根长差异显著。1% KNO3浸种处理獐茅种子幼苗长势最弱,随着浓度的增加,苗长和根长增加,但处理间差异较小(图2)。总体而言,NaOH 溶液处理对促进獐茅幼苗生长的影响最大,KNO3溶液处理次之,98% H2SO4浸种处理最小。

表1 3 种化学试剂处理对獐茅种子发芽指标的影响Table 1 Effects of chemical reagents on the germination index of Aeluropus littoralis
3 讨论与结论
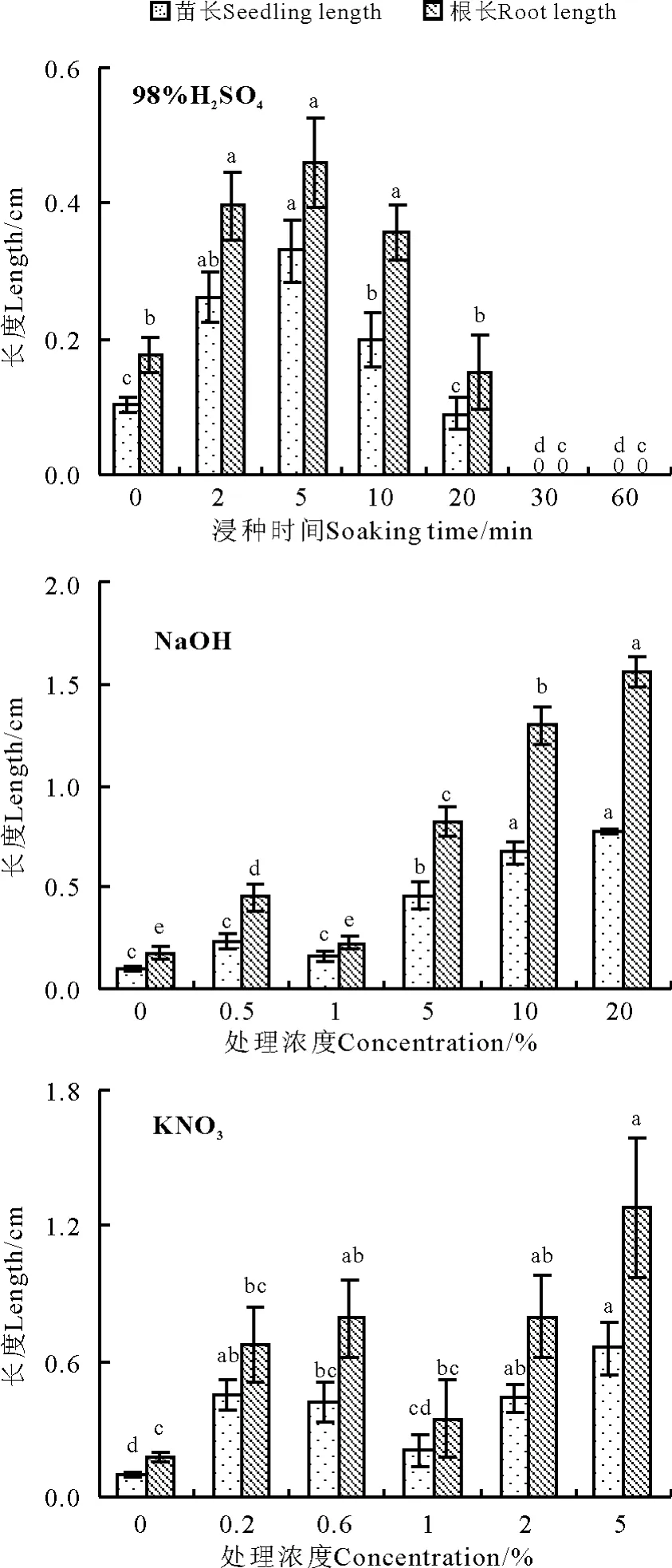
图2 3 种化学物质处理对獐茅幼苗生长的影响Fig.2 Effects of three chemical reagents on seeding growth of Aeluropus littoralis
有研究者认为,种子内部一般含有大量的抑制物质,进而引起种子的休眠,降低发芽率,而通过化学试剂浸种通常会影响种内抑制物质的含量,从而改变种子的发芽率[12]。本研究结果显示,未经处理的獐茅种子发芽率仅为4%,自然发芽率低,3种化学试剂(98% H2SO4浸种30 和60 min 除外)均在一定程度上提高了獐茅种子的发芽率、发芽指数和活力指数,可见,獐茅种子有一定的休眠特性,3 种化学试剂均可在一定程度上打破獐茅种子休眠,提高其发芽指数。但不同浸种时间或不同浓度处理对种子内部抑制物质的影响有区别,因此打破獐茅种子休眠、提高发芽率和促进幼苗生长的效果也有差异。
98% H2SO4通过其氧化性腐蚀颖壳而增强种皮透性,短时间浸种处理促进了獐茅种子萌发,发芽率和幼苗长势均随浸种时间的延长而降低,长时间处理使种子炭化严重,不能发芽,本研究结果与王继朋等[16]关于H2SO4处理对结缕草种子发芽影响的研究结果一致,但效果最好的5 min 浸种处理獐茅种子发芽率、苗长和根长,分别仅为13.3%、0.33 和0.46 cm,可见,98% H2SO4浸种处理对獐茅种子伤害较大,同时由于98% H2SO4具有强腐蚀性,因此,不便于在实际生产中应用[17]。
NaOH 浸种处理可显著提高獐茅种子的发芽率、发芽指数及活力指数,促进幼苗生长,与韩建国等[18]、王微[19]关于结缕草种子的研究结果一致,一方面可能是因为NaOH 浸种使抑制物渗出,另一方面NaOH 具有腐蚀性,可更好地增加种子的通透性,利于抑制物渗出[13]。俞飞飞和丁增成[20]在恒温下进行结缕草种发芽试验,发现NaOH 溶液浸种低浓度处理比高浓度效果好,而本研究的变温发芽条件下,高浓度NaOH(10%)处理下的獐茅种子发芽指标较高,幼苗长势较好。
KNO3能够促进种子细胞代谢,从而破除种子休眠状态[8],并且KNO3溶液中的K+可参与诱导植物体内生长促进性激素(如生长素、赤霉素)的生物合成及其活力调控[21],从而提高种子活力,促进发芽。国际种子检验规程中处理种子的KNO3浓度为0.2%[22],王彦荣和曾彦军[14]研究也认为0.2%KNO3浸种兰引Ⅲ号结缕草种子可显著提高其发芽率,与之相同,本研究也显示,该浓度处理幼苗长势良好,与其他浓度处理差异较小。
整体而言,NaOH 溶液处理对促进獐茅种子发芽和幼苗生长的影响最大,KNO3溶液次之,98%H2SO4最小。其中10% NaOH 处理对促进獐茅种子发芽幼苗生长效果最好,且简单易行。
[1] 刘志华,时丽冉,赵可夫.獐茅盐腺形态结构及其泌盐性[J].植物生理与分子生物学学报,2006,32(4):420-426.
[2] 刘志华,赵可夫.盐胁迫对獐茅生长及Na+和K+含量的影响[J].植物生理与分子生物学学报,2005,31(3):311-316.
[3] 李兴东.獐茅种群地上生物量及光合面积等的生长季动态[J].生态学杂志,1992,11(3):56-58.
[4] 齐冬梅,张卫东,刘公社.羊草种子生活力测定技术研究[J].草业学报,2004,13(2):89-93.
[5] 范天恩,高利伟,郭伊乐.羊草种子萌发条件的探讨[J].内蒙古草业,2005,17(4):62-64.
[6] 刘彩红,李成云.GA3浸种对羊草种子发芽和幼苗生长的影响[J].草业科学,2011,28(5):797-801.
[7] 刘彩红,李成云,朴光一,张帆. IAA 和NAA 对不同羊草种子发芽和幼苗生长的影响[J]. 黑龙江畜牧兽医,2011(5):79-81.
[8] 王萍,周天,刘建国,王斌,周彤.提高羊草种子发芽能力的研究[J].东北师大学报自然科学版,1998(1):54-57.
[9] 郭海林,刘建秀.结缕草种子的休眠机理及其打破休眠的方法[J].种子,2003,22(3):46-48.
[10] 赵昕,李玉霖.结缕草种子打破休眠的研究[J].种子,2002,21(1):22-25.
[11] 孙雨珍,胡小荣,陈辉.结缕草种子发芽温度及打破休眠方法的研究[J].中国草地,1996(1):42-45.
[12] 蔺吉祥,邵帅,隋丹,穆春生,王永翠,王颖.几种提高羊草种子发芽率方法的比较[J].中国草地学报,2014,36(3):47-51.
[13] 何学青,胡小文,王彦荣.羊草种子休眠机制及破除方法研究[J].西北植物学报,2010,30(1):120-125.
[14] 王彦荣,曾彦军.浸种对提高兰引Ⅲ号结缕草种子发芽的影响[J].草业学报,1997,6(2):41-46
[15] 鱼小军,王芳,龙瑞军.破除种子休眠方法研究进展[J].种子,2005,24(7):46-49.
[16] 王继朋,王贺,张福锁,毛达如.打破结缕草种子休眠的方法研究[J].草业科学,2004,21(2):25-29.
[17] 王文强,付玲玲,白昌军,李志丹. 兰引Ⅲ号结缕草种子直播建坪研究——Ⅰ打破种子休眠[J]. 中国农学报,2007,23(9):577-580.
[18] 韩建国,倪小琴,毛培胜,浦心春,杜光璞.结缕草种子打破休眠方法的研究[J].草地学报,1996,4(4):246-251.
[19] 王微.NaOH 处理对结缕草种子萌发及生理特性的影响[J].种子,2010,29(1):11-14.
[20] 俞飞飞,丁增成.提高结缕草种子发芽率的研究[J].安徽农学通报,1999,5(3):55-56.
[21] 张菊平,张艳敏,康业斌,张兴志.硝酸钾处理对不同贮藏年限辣椒种子发芽的影响[J].种子,2005,24(4):28-30.
[22] 国际种子检验协会.国际种子检验规程[M].颜启传,毕辛华,译.北京:农业出版社,1996:146-152.
