醉马草-内生真菌共生体中生物碱的抑菌活性
2015-04-08孙一丹张兴旭古丽君李秀璋王萍李春杰
孙一丹,张兴旭,古丽君,李秀璋,王萍,李春杰
( 草地农业生态系统国家重点实验室兰州大学草地农业科技学院,甘肃兰州730020)
禾草-内生真菌(Fungal endophyte or Endophytic fungi)是指生长在植株体内并完成大部分或全部生活史周期,而宿主植物不显示其外部症状的一类真菌[1-2],包括香柱菌(Epichloë)属及其无性型Neotyphodium 属[2]。禾草-内生真菌共生体的双重特性已经成为近年来研究的热点领域之一。内生真菌侵染禾草形成互惠互利的共生体,内生真菌自宿主禾草体内获取营养物质和生存空间,同时还提高了禾草的抗虫性[3]和抗旱性[4],促进禾草生长,提高禾草竞争能力[5];但是共生体中通常也会产生一些有毒的次生代谢产物,如生物碱类物质可引致家畜中毒,给草地畜牧业生产造成了巨大的损失[5-7]。有关禾草内生真菌共生体和家畜的研究,主要集中在内生真菌侵染的高羊茅(Festuca arundinacea)和多年生黑麦草(Lolium perenne)等禾草,如美国的“牛狐茅中毒症”是由于内生真菌(E. coenophiala)侵染高羊茅产生麦角酸Ergovaline 所致[6],新西兰的“绵羊黑麦草蹒跚病”是由内生真菌(E. festucae var. lolii)侵染多年生黑麦草产生吲哚双萜类Lolitrem B所致[7]。
近年来,兰州大学草地农业科技学院对醉马草-内生真菌共生体开展了系统研究,南志标和李春杰课题组对醉马草(Achnatherum inebrians)中内生真菌带菌率检测和共生体的分布[8-9];内生真菌侵染提高醉马草的抗旱性[10]、耐盐碱性[11]、抗寒性[12]、耐重金属胁迫[13-14]和抗虫性[15];内生真菌和病原真菌互作[8,16]、共生体的生物碱[17-19]和动物饲喂试验[20-21]等诸多方面进行了研究。有关醉马草-内生真菌共生体中生物碱的研究,目前主要集中在共生体中麦角新碱和麦角酰胺的时空分布和季节动态[8,17]、影响共生体产碱的因素[19,22]及其对胁迫的响应[18]等。
有关黑麦草内生真菌的研究发现,黑麦草内生真菌可以显著抑制细交链孢(Alternaria alternata)、燕麦镰刀菌(Fusarium avenaceum)、小孢壳二孢(Ascochyta leptospora)、燕麦镰孢(Fusarium avenaceum)
和新月弯孢(Curvularia lunata)等多种植物病原真菌的菌落繁殖和孢子萌发,从而提高黑麦草离体叶片的抗病性[23-24]。有关醉马草内生真菌的抗病性研究亦发现,E. gansuensis 可显著抑制包括锐顶镰孢(F. acuminatum)、细交链孢和新月弯孢在内的多种植物病原真菌的菌落扩张及孢子萌发[16]。杨松等[25]和张兴旭[26]的研究结果也表明,醉马草草粉浸提液和粗提物各部分浸膏对常见植物病原真菌具有很强的抑菌活性。本研究旨在通过比较带内生真菌(E+)和不带内生真菌(E -)的醉马草生物碱提取液对8 种常见的植物病原真菌,麦角菌(Clavieps purpurea)、德氏霉(Drechslera erythrospila)、燕麦镰孢、根腐离蠕孢(Bipolaris sorokiniana)、新月弯孢、半裸镰孢(F. semitectum)、腐皮镰孢(F. solani)和细交链孢的抑菌活性,明确内生真菌侵染醉马草产生生物碱的抑菌作用。
1 材料与方法
1.1 材料
1.1.1 植物 试验所用的醉马草种子于2013 年10 月采自兰州大学榆中校区温室(103°36'52″ E,36°28'42″ N)种植的带内生真菌(E +)和不带内生真菌(E-)的醉马草植株。挑选籽粒饱满、表面健康的醉马草种子于2013 年11 月播种于装有300 g混合培养基质(蛭石∶ 珍珠岩=3∶ 1)的聚乙烯花盆(口径15 cm,底径10 cm,深12 cm)中,在温室条件下[光周期12 h 光照,温度(20 ±1)℃,光照强度120 μmol·m-2·s-1]培养幼苗。
1.1.2 菌种 试验所用的菌种(麦角菌、德氏霉、燕麦镰孢、根腐离蠕孢、新月弯孢、半裸镰孢、腐皮镰孢、细交链孢)均由草地农业生态系统国家重点实验室草地保护所自多年生黑麦草、醉马草和草地早熟禾(Poa pratensis)等禾草分离获得并于(22 ±2)℃黑暗条件下在葡萄糖-琼脂-马铃薯(PDA)培养基上培养(生化培养箱LRH-250A,广东)。各菌种纯化后密闭保存在斜面试管培养基上,4 ℃低温保存。
1.2 方法
1.2.1 生物碱提取 分别将E +和E -醉马草风干,研磨后将粉样装袋备用。按照Zhang 等[19]的方法,继续醉马草生物碱的提取。分别取草粉样品6.25 g 放入两个1 000 mL 的三角瓶中,并加入125 mL 的75 ∶ 25 ∶ 2 的CHCl3(氯 仿)∶ MeOH(甲醇)∶ NH4OH(氨水)液体于三角瓶中,用锡箔纸包装并打开盖子在通风处放置12 ~15 h,待其挥发至无液体存在后再加入375 mL 的1∶ 2 的MeOH(甲醇)∶ CCl4(四 氯 化 碳)溶 液 和125 mL 0. 375 g·100 mL-1的酒石酸溶液,轻微震荡,待其完全溶解后,用锡箔纸对瓶子进行遮光处理静置25 h 左右,待溶液分层,用一次性注射器吸取水相部分液体放入棕色瓶子中,即得到醉马草生物碱提取液的原液,置于4 ℃冰箱中保存以备用。分别用C1、C2、C3代替原液的100%、50%及25%浓度。
1.2.2 醉马草内生真菌提取液原液浓度的测定
参考Zhang 等[18-19]的方法,称取50 mg 已经冷冻干燥的醉马草草粉,用Agilent 1100 series 高效液相色谱系统(Agilent,USA)进行检测。以ZORBAX-XDB C18 反相色谱柱(Agilent,USA),流动相流速1 mL· min-1,进样量20 μL,以VWD 紫外检测器(Agilent,USA)进行检测。流动相分别为:A,0.1 mol·L-1NH4OAc;B,乙腈∶ 0.1 mol·L-1NH4OAc =3∶1。按照95%A 液5 min、80%A 液20 min、50%A 液5 min、90%A 液10 min 流动相配比与时间,检测波长为312 nm。通过安捷伦色谱工作软件(ChemStation for LC Rev. A. 10.01,USA)检测进程并测定峰值面积,根据标样确定的相关方程(标样分别稀释至5、10、15 和20 mg·kg-1浓度,用外标法来建立标准方程)和样品稀释的倍数,计算两种生物碱的浓度。麦角新碱标样分离自内生真菌侵染的甘肃夏河醉马草(纯度为99.99%),麦角酰胺标样由新西兰AgResearch 公司Wade Mace 博士提供。
1.2.3 抑菌活性测定 将各供试菌种接种于PDA培养基上,恒温25 ℃培养7 d 后,用直径6 mm 打孔器把活化的菌种打成菌碟,分别接种到含有不同浓度醉马草提取液的培养基上,在(22 ±2)℃培养箱内培养,每个处理重复3 次。并以同样的真菌菌碟接种到不含有提取液PDA 培养基上作为对照,在相同条件下培养。
生长速率测定:从接种之日起,于3 d 后开始测量并记录结果,每隔3 d 测定一次,持续测定2 周。测量菌落直径时,用游标卡尺读数,采用十字交叉法读取数据。对真菌菌落生长的抑制作用采用生长速率测定法[27]。
菌落生长抑制率=(DCK-DT)/DCK×100%。式中,DCK为对照菌落直径,DT为处理菌落直径。
孢子萌发率测定:对真菌孢子的萌发抑制作用采用孢子萌发法[28],在无菌双凹载玻片凹面内,滴加1 mL 各极性段已经溶解好的活性成分,并滴加1 mL 植物病原真菌的孢子悬浮液将其混匀,孢子浓度以单个视野里面90 ~100 个为宜(10 ×40 倍镜),对照为未加活性成分的孢子悬浮液再加1 mL 无菌水,然后将其置于培养皿内(直径为11 cm)恒温25 ℃条件下保湿培养。每隔2 h 检测一次孢子萌发情况。取3 次重复的平均值,每个重复观测100 个孢子来检查孢子萌发情况。
孢子萌发抑制率=(SCK-ST)/SCK×100%。式中,SCK为对照菌落直径,ST为处理菌落直径。
1.3 统计分析
所有数据均用Microsoft Excel 录入,用Word 进行表 格 制 作。采 用SPSS 13. 0(Ver. 13. 0,SPSS Inc.,Chicago,IL,USA)统计分析软件分别对各浓度处理条件下8 种植物病原真菌菌落生长的指标(菌落直径和孢子萌发)进行单因素方差分析(ANOVA),选用Duncan 法进行多重比较,并就醉马草提取液中生物碱浓度与孢子萌发抑制率进行相关性分析。
2 结果与分析
2.1 E+和E-醉马草麦角类生物碱的含量
本研究所用E +醉马草提取液的生物碱浓度,原液中麦角酰胺含量为369.1 mg·kg-1,麦角新碱含量为26.2 mg·kg-1;原液稀释50%提取液中的麦角酰胺含量为189.2 mg·kg-1,麦角新碱含量为22.5 mg·kg-1;原液稀释25%提取液中的麦角酰胺含量为86.1 mg·kg-1,麦角新碱含量为7. 9 mg·kg-1。E-醉马草提取液中不含有这两种麦角类生物碱。
2.2 E+和E-醉马草提取液对8 种植物病原真菌菌落生长的影响
E+和E-醉马草草粉浸提液对8 种供试真菌菌落生长均表现出一定的抑制作用,E +的抑制率整体高于E -(表1)。其中,E +C1浓度对腐皮镰孢的抑制率最高,达到了63%,E +C3浓度对新月弯孢的抑制率最低,为10%。E -C1浓度对腐皮镰孢的抑制作用最高,为51%,E -C3浓度对新月弯孢的抑制率最低,仅有6%。
E+和E-醉马草草粉浸提液对供试真菌菌落生长的抑制率随着其浓度的减少呈逐渐下降的趋势,新月弯孢在E+C1~C3各浓度之间差异均显著(P <0.05);燕麦镰孢和半裸镰孢在E+C1和C3浓度之间差异显著。离孺孢在E-C3浓度下与C1、C2之间差异均显著;半裸镰孢和腐皮镰孢在E -C2和E-C3之间差异显著。
在E+C1浓度条件下,腐皮镰孢和麦角菌之间差异不显著(P >0.05),与其他各菌株之间差异均显著(P <0.05)。在E +C2浓度条件下,腐皮镰孢和麦角菌之间差异不显著,与其他各菌株之间差异均显著;半裸镰孢、新月弯孢、麦角菌、德氏霉和离孺孢之间差异显著。在E +C3浓度条件下,腐皮镰孢与其他各菌株之间差异均显著;细交链孢与燕麦镰孢和德氏霉之间无显著差异,与其他各菌株之间差异均显著。腐皮镰孢、麦角菌和新月弯孢在E-C1浓度条件下差异显著,且与其他各菌株之间差异均显著。腐皮镰孢、麦角菌、细交链孢和新月弯孢在E-C2浓度条件下差异显著,且与其他各菌株之间差异均显著。腐皮镰孢、麦角菌和燕麦镰孢在E -C3浓度条件无显著差异,但与其他各菌株之间差异均显著;细交链孢和离孺孢之间无显著差异,但与其他各菌株之间差异均显著。
2.3 E+和E-醉马草提取液对8 种植物病原真菌孢子萌发的影响
E +和E -醉马草草粉浸提液对8种供试真菌孢子萌发均表现出一定的抑制作用,E +的抑制率整体高于E -(表2)。其中,E +C1浓度对腐皮镰孢的抑制率最高,达到了57%,E +C3浓度对离孺孢的抑制率最低,为14%。E -C1浓度对腐皮镰孢的抑制作用最高,为46%,E -C3浓度对离孺孢的抑制率最低,仅有8%。
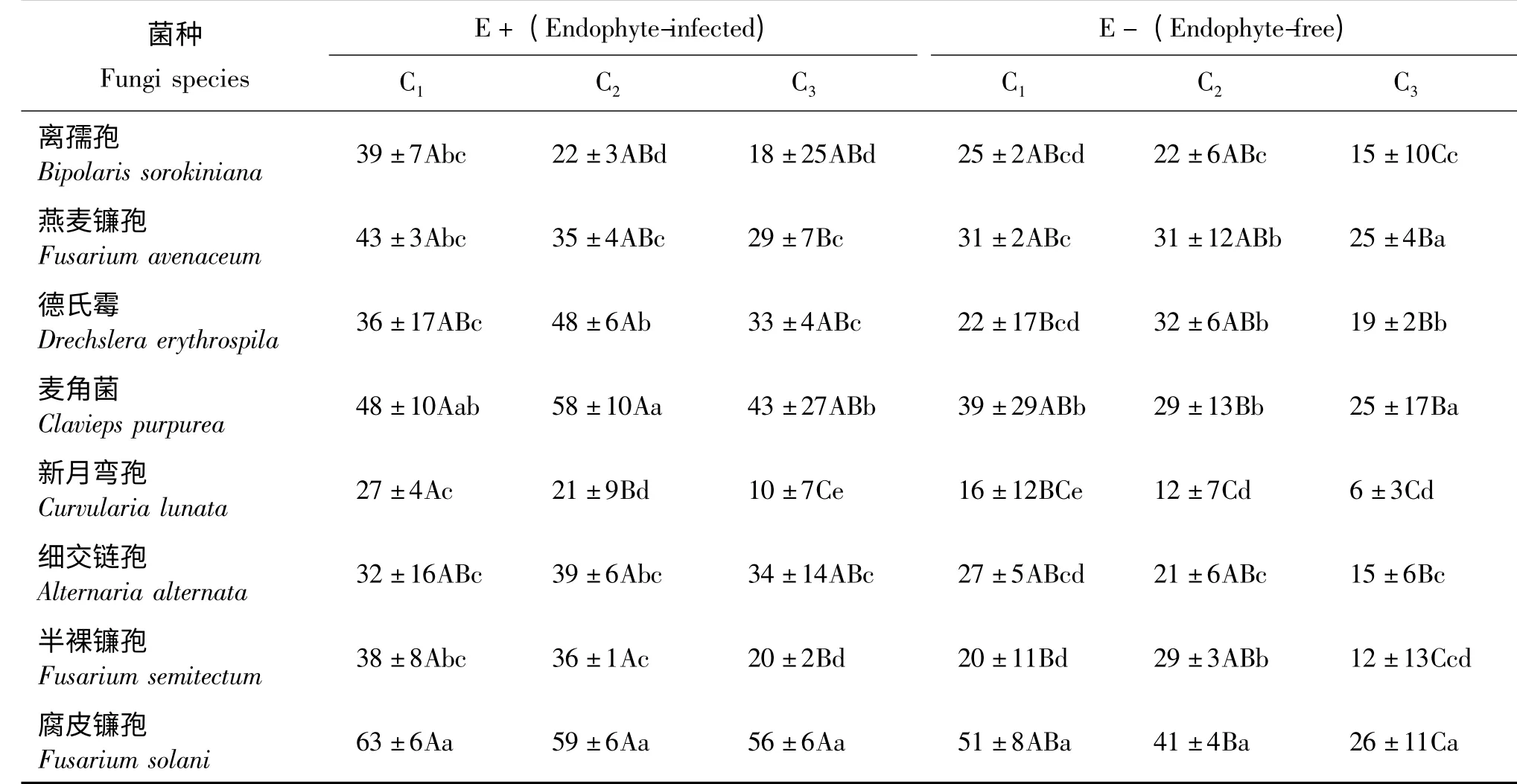
表1 醉马草内生真菌生物碱提取液对不同菌落大小的抑制率影响Table 1 Effects of ergot alkaloids extraction from E+ and E- Achnatherum inebrians on the mycelia growth of 8 grass pathogens %
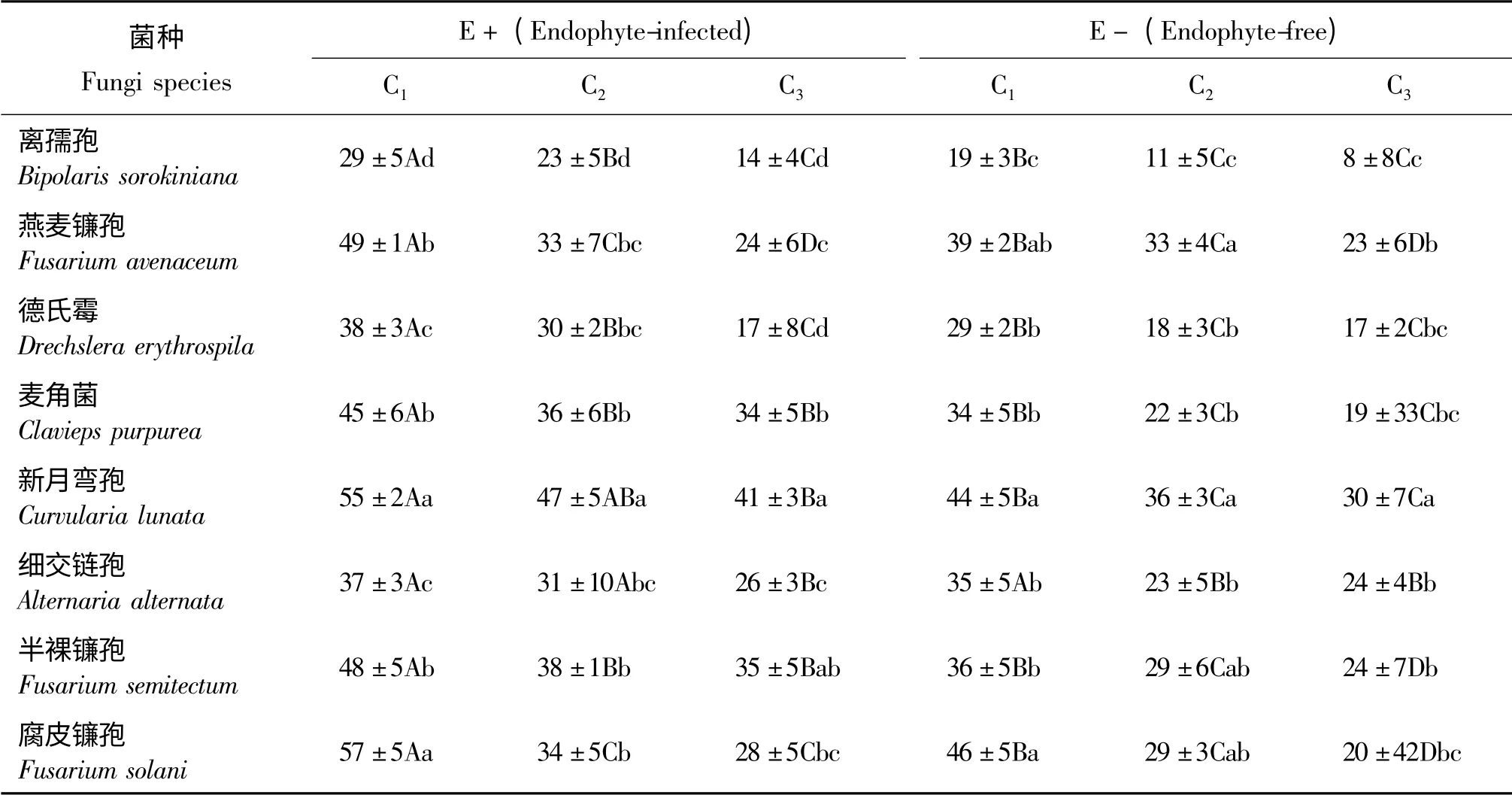
表2 醉马草内生真菌生物碱提取液对不同菌落孢子萌发的抑制率影响Table 2 Effects of ergot alkaloids extraction from E+ and E- Achnatherum inebrians on the spores germination of 8 grass pathogens %
E+和E ―醉马草草粉浸提液对供试真菌孢子萌发的抑制率随着其浓度的减少呈逐渐下降的趋势。离孺孢、燕麦镰孢和德氏霉在E+C1、C2、C3浓度下均差异显著(P <0.05);新月弯孢和细交链孢在E+C1和C3有显著差异;半裸镰孢和腐皮镰孢在E +C1浓度与C2和C3之间有显著差异。离孺孢、德氏霉和细交链孢在E―C1浓度与C2和C3之间有显著差异,但是在C2和C3之间无显著差异(P >0.05)。其他各菌株在E-C1~C3浓度之间均差异显著。
腐皮镰孢和新月弯孢在E +C1浓度条件下无显著差异(P >0.05),但与其他各菌株之间差异均显著(P <0.05);燕麦镰孢、麦角菌和半裸镰孢在E+C1浓度条件下无显著差异,但与其他各菌株之间差异均显著。新月弯孢、麦角菌和离孺孢在E +C2浓度条件下差异显著,且与除燕麦镰孢外的其他各菌株之间差异均显著。新月弯孢、麦角菌和燕麦镰孢在E+C3浓度条件下差异显著;离孺孢和德氏霉之间无显著差异,但与其他各菌株之间差异均显著。腐皮镰孢和新月弯孢在E -C1浓度条件下无显著差异,但与除燕麦镰孢外的其他各菌株之间差异均显著。燕麦镰孢和新月弯孢在E -C2浓度条件下之间无差异显著,但与离孺孢、麦角菌差异显著;离孺孢与其他各菌株之间差异均显著。新月弯孢在E-C3浓度条件下与其他各菌株之间差异均显著;燕麦镰孢与离孺孢、新月弯孢之间差异显著,与其他菌株间无显著差异。
2.4 生物碱浓度和植物病原真菌回归分析
E+醉马草生物碱提取液浓度与8 种植物病原真菌孢子萌发抑制率呈显著正相关关系(P <0.05)。就E+生物碱和植物病原真菌孢子萌发进行回归分析,得到E+醉马草提取液中生物碱浓度与8 种植物病原真菌孢子萌发抑制率的回归方程(表3)。
3 讨论与结论
本研究首次以带内生真菌(E +)和不带内生真菌(E-)的醉马草生物碱提取液为材料,研究其对8种常见的植物病原真菌(麦角菌、德氏霉、燕麦镰孢、根腐离蠕孢、新月弯孢、半裸镰孢、腐皮镰孢和细交链孢)的抑菌活性,结果表明,E +和E -醉马草提取液对上述8 种植物病原真菌的菌落生长和孢子萌发均具有显著的抑制作用,E +醉马草提取液中检测到了麦角类生物碱,且麦角碱与植物病原真菌的孢子萌发具有显著的相关性(P <0.05)。首次明确了内生真菌侵染醉马草增强了其草粉浸提液对病原菌菌落生长和孢子萌发的抑制作用。
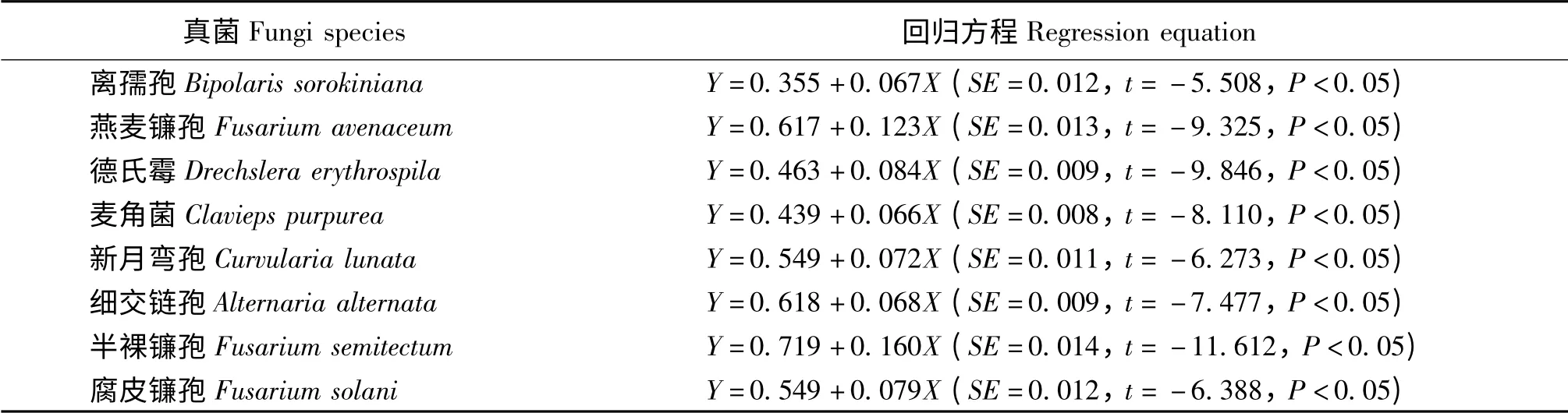
表3 醉马草生物碱提取液与病原真菌孢子萌发抑制率的回归分析Table 3 Regression equation of the concentractions of E+ alkaloids extraction and the spores germination of 8 grass pathogens
Li 等[16]的研究结果表明,N. gansuense 可以显著抑制细交链孢、根腐离蠕孢、新月弯孢和锐顶镰孢的菌落扩张。本研究结果表明,E+和E-醉马草粗提物对8 种真菌的菌落生长均具有显著的抑制作用,这与马敏芝和南志标[23]报道的黑麦草内生真菌可以抑制细交链孢、新月弯孢菌和燕麦镰刀菌等多种植物病原真菌的菌落生长,从而提高黑麦草离体叶片抗病性的结果相似;谢凤行和任安芝[29]在羽茅(A. sibiriu)和高羊茅内生真菌抗病性的研究中也发现,内生真菌能够抑制镰刀菌属(Fusarium spp.)、立枯丝核菌属(Rhizoctonia spp.)、弯孢霉属(Curvularia spp.)、枝孢霉属(Cladosporium spp.)和拟茎点霉属(Phomopsis spp.)等植物病原真菌的菌落生长,本研究结果与之相似。
Li 等[16]研究表明,E. gansuensis 可以显著抑制细交链孢、根腐离蠕孢、新月弯孢的孢子萌发;马敏芝和南志标[23]的研究也发现,黑麦草内生真菌可以显著抑制细交链孢、新月弯孢菌和燕麦镰刀菌等多种植物病原真菌的孢子萌发和芽管伸长。杨松等[25]的研究结果发现,内生真菌的侵染可增强醉马草、披碱草(Elymus dahuricus)和野大麦(Hordeum brevisubulatum)草粉浸提液对细交链孢、根腐离蠕孢、燕麦镰孢和绿色木霉(Trichoderma viride)4 种真菌孢子萌发的抑制作用。谢凤行和任安芝[29]的研究发现,分离自羽茅和高羊茅中的内生真菌经过液体培养后得到的发酵液亦可抑制病原真菌的孢子萌发;本研究结果也表明,E +和E -醉马草粗提物对8 种供试植物病原真菌的孢子萌发均具有显著的抑制作用,与上述研究结果相类似。
马敏芝和南志标[23]的研究发现,黑麦草内生真菌可以显著抑制细交链孢、新月弯孢和燕麦镰刀菌等多种植物病原真菌的芽管伸长,从而提高黑麦草活体植株的抗病性。Tian 等[24]的研究结果也表明,黑麦草内生真菌可以显著抑制根腐离蠕孢的孢子萌发和芽管伸长,从而提高黑麦草离体叶片的抗病性。杨松等[25]的研究结果也发现,内生真菌的侵染可以增加醉马草、披碱草和野大麦草粉提取液对包括细交链孢在内的4 种真菌芽管伸长的抑制作用。张兴旭[26]的研究也发现,E +醉马草提取液对6 种真菌的芽管伸长具有显著的抑制作用。
通过高效液相色谱(HPLC)检测发现,E +醉马草中含有大量的麦角类生物碱(麦角新碱和麦角酰胺)和其他化合物成分,而E-醉马草中未检测到这些生物碱,由此可以推断内生真菌产生的生物碱可能跟醉马草的抗病性有关。
[1] 南志标,李春杰.禾草-内生真菌共生体在草地农业系统中的作用[J].生态学报,2004,24(3):605-616.
[2] Kuldau G,Bacon C.Clavicipitaceous endophytes:Their ability to enhance resistance of grasses to multiple stresses[J].Biological Control,2008,46:57-71.
[3] Bacon C W,Richardson M D,White J F.Modification and uses of endophyte-enhanced turfrass:A role for molecular technology[J].Crop Science,1997,37(5):1415-1425.
[4] Malinowski D P,Belesky D P.Adaptation of endophyte-infected cool-season to environment stresses:Mechanisms of drought and mineral stress tolerance[J].Crop Science,2000,40(4):923-940.
[5] Malinowski D P,Brauer D K,Belesky D P.Neotyhodium coenophialum-endophyte effects root morphology of tall fescue grown under phosphorus deficiency[J].Journal of Agronamy and Crop Science,1999,183:53-60.
[6] Paterson J,Forcherio C,Larson B,Samford M,Kerley M.The effects of fescue toxicosis on beef cattle productivity[J].Jorunal of Animal Science,1995,73:889-898.
[7] Gallagher R T,Hawkes A D,Steyn P S,Vleggaar R.Tremorgenic neurotoxins from perennial ryegrass causing ryegrass staggers disorder of livestock:Structure and elucidation of Lolitrem B[J]. Journal of the Chemical Society,Chemical Communications,1984,9:614-616.
[8] 李春杰.醉马草-内生真菌共生体生物学与生态学特性的研究[D].兰州:兰州大学,2005.
[9] Li C J,Nan Z B,Gao J H,Tian P.Detection and distribution of Neotyphodium-Achnatherum inebrians association in China[A].Robert K,Charles R,Ryan L A. Proceedings of 5thInternational Neotyphodium/Grass Internation Symposium[C]. Aerkansas,USA,2004:210.
[10] 李飞.内生真菌对醉马草抗旱性影响的研究[D].兰州:兰州大学,2007.
[11] 缑小媛.内生真菌对醉马草耐盐性影响的研究[D].兰州:兰州大学,2007.
[12] 陈娜.内生真菌提高醉马草低温萌发能力的分子机制[D].兰州:兰州大学,2011.
[13] Zhang X X,Li C J,Nan Z B.Effects of cadmium stress on growth and anti-oxidative systems in Aehnatherum inebrians symbiotic with Neotyphodium gansuense[J].Journal of Hazardous Materials,2010,175:703-709.
[14] Zhang X X,Fan X M,Li C J,Nan Z B.Effects of cadmium stress on seed germination,seedling growth and antioxidative enzymes in Achnatherum inebrians plants infected with a Neotyphodium endophyte[J].Plant Growth Regulation,2010,60(2):91-97.
[15] Zhang X X,Li C J,Nan Z B,Matthew C.Neotyphodium endophyte increases Achnatherum inebrians (drunken horse grass)resistance to herbivores and seed predators[J].Weed Research,2012,52(1):70-78.
[16] Li C J,Gao J H,Nan Z B.Interactions of Neotyphodium gansuense,Achnatherum inebrians and plant-pathogenie fungi[J].Mycological Research,2007,111(10):1220-1227.
[17] Li C J,Nan Z B,Schardl C. Levels and temporal variation of ergot alkaloids in endophyte infected drunken horse grass,Achnatherum inebrians,in China[A].APS,CPS and MSA Joint Meeting Abstracts[C].Quebec City,Canada,2006:203-204.
[18] Zhang X X,Li C J,Nan Z B.Effects of salt and drought stress on alkaloid production in endophyte-infected drunken horse grass(Achnatherum inebrians)[J].Biochemical Systematics and Ecology,2011,39:471-476.
[19] Zhang X X,Li C J,Nan Z B.Effects of cutting frequency and height on alkaloid production in endophyte-infected drunken horse grass (Achnatherum inebrians)[J].Science China Life Sciences,2011,54(6):567-571.
[20] 李春杰,南志标,张昌吉,张崇岳,张燕慧.醉马草内生真菌对家兔的影响[J].中国农业科技导报,2009,11(2):90-96.
[21] 梁莹.醉马草内生真菌共生体对小尾寒羊的影响[D].兰州:兰州大学,2011.
[22] Hu C X,Li C J,Nan Z B.Analysis of ergot alkaloids within various individuals of Achnatherum inebrians infected with Neotyphodium gansuense[A].Nan Z B,Li C J.eds.Proceedings of the 8thInternational Symposium on Fungal Endophytes of Grasses[C].Lanzhou,China:Lanzhou University,2012:192-196.
[23] 马敏芝,南志标.黑麦草内生真菌对植物病原真菌生长的影响[J].草业科学,2011,28(6):962-968.
[24] Tian P,Nan Z B,Li C J,Spangenberg G.Effect of the endophyte Neotyphodium lolii on susceptibility and host physiological response of perennial ryegrass to fungal pathogens[J].European Journal of Plant Pathology,2008,122:593-602.
[25] 杨松,李春杰,黄玺,柴青,南志标.被内生真菌侵染的禾草提取液对真菌的抑制作用[J].菌物学报,2010,29(2):234-240.
[26] 张兴旭.醉马草-内生真菌共生体胁迫的响应及其次生代谢产物的活性研究[D].兰州:兰州大学,2012.
[27] 吴文君.植物化学保护实验技术导论[M].西安:陕西科技出版社,1998:1-333.
[28] 黄彰欣.植物化学保护实验指导[M].北京:中国农业出版社,1993:53-58.
[29] 谢风行,任安芝,王银华,林枫,高玉葆.内生真菌对草坪植物病原菌抑制作用的比较[J].生态学报,2008,28(8):3913-3920.
