血栓弹力图对PCI术后抗血小板治疗的监测效果观察
2015-04-01武文学闫明洲吉林省长春市双阳区医院吉林长春0600福建省仙游县医院福建仙游500吉林大学中日联谊医院心血管内科吉林长春00
武文学,杨 岚,闫明洲 (.吉林省长春市双阳区医院,吉林 长春 0600;.福建省仙游县医院,福建 仙游 500;.吉林大学中日联谊医院心血管内科,吉林 长春 00)
冠心病是心内科最常见的疾病之一,是冠状动脉由于各种原因管径变窄,血流量减少,导致对心肌的供血不足影响心肌功能,或发生器质性病变的疾病。有流行病学调查显示,近年来我国冠心病发病率正在逐年上升,且病死率也是不降反升,并且发病年龄呈年轻化趋势。随着影像学技术的发展,冠脉造影术(CAG)和经皮冠脉介入治疗(PCI)已经成为治疗冠心病的首选方法之一。Kashuk等人的研究结果表明,在PCI围术期对患者行抗血小板治疗,可以显著降低支架内血栓形成的概率[1]。但是,周薇在研究中发现,有些患者在行抗血小板治疗后,仍会发生缺血或形成血栓,并推测这可能是由于不同患者对抗血小板药物的反应不同所致[2]。截止2000年,世界范围内,已经有约50个国家将血栓弹力图作为在体外循环术中监测凝血的主要手段[3]。
1 资料与方法
1.1 一般临床资料:回顾性分析2013年10月~2014年9月期间,在吉林大学中日联谊医院心内科行PCI治疗,并于术后使用血栓弹力图进行抗血小板疗效监测的冠心病患者89例作为本次研究的实验对象。根据1979年国际心脏病学会(IAC)和世界卫生组织(WHO)制定的冠心病诊断标准,将89例患者分为急性心肌梗死组(AMI组)31例、不稳定型心绞痛组(UAP组)44例和稳定型心绞痛组(AP组)14例。本次研究纳入对象的性别、平均年龄、既往史(高血压、糖尿病、高脂血症、脑卒中及吸烟史等)均无显著差异。
1.2 主要仪器和试剂:①血栓弹力图分析仪(TEG 5000型广州市瑞桥贸易有限公司生产);②花生四烯酸(郑州诚旺化工产品责任有限公司生产);③二磷酸腺苷二钠(合肥博美生物科技有限责任公司生产);④血小板图试剂盒(北京中盛兴华贸易中心生产)。
1.3 实验方法
1.3.1 血栓弹力图测量方法:所有患者入院次日空腹抽取静脉血,检测血常规、血脂、血糖、肾功能、凝血常规。在行PCI术后72 h内,抽取静脉血5 ml置于枸橼酸管中作为标本。所有操作严格遵循血栓弹力图分析仪说明书。取1 ml血液与高岭土轻轻混匀,再将340μl经高岭土处理过的血液样本加入到事先预热完成的肝素酶杯中,用血栓弹力图分析仪化验已测量凝血酶诱导的血小板激活的全部凝块强度(MAthrombin)[4]。将肝素化血液(360μl)加入含10μl激活剂F的普通杯,产生纤维蛋白的交联凝块(MAfibrin)。将肝素化血液(360ul)加入含10μl激活剂F和10μl ADP的普通杯形成由血小板活化剂激活的全血交联凝块(MAADP),其中以后者为主。每个试剂杯都反复抽吸,使之混合。血栓弹力图结果以MAADP表示。
1.3.2 抗血小板药物反应能力测试方法:89例患者于收入院当日给予口服阿司匹林肠溶片和氯吡格雷。在行经皮冠状动脉介入治疗前,给予阿司匹林肠溶片和氯吡格雷各300 mg顿服,术后嘱患者每日口服阿司匹林肠溶片100 mg、氯吡格雷75 mg,并选择性服用钙离子拮抗剂(如硝苯地平、维拉帕米、地尔硫卓等)、血管紧张素转化酶抑制剂(如卡托普利、依那普利等)、β受体阻滞剂(如美托洛尔、比索洛尔、普萘洛尔等)、他汀类药物(洛伐他丁、辛伐他汀、普伐他汀等)和质子泵抑制剂(如奥美拉唑、泮托拉唑等)。术后24~72 h内空腹取肘正中静脉血5 ml,通过血栓弹力图检测血小板聚集抑制率(PAI),并规定氯吡格雷诱导血小板抑制率<30%并且阿司匹林诱导血小板抑制率<50%为抗血小板药物反应低下。
1.4 统计学方法:采用SPSS 16.0软件对所有实验所得数据进行处理,对计数资料用χ2检验,对计量资料用t检验,P<0.05有显著差异。
2 结果
2.1 AMI、UAP、AP三组患者凝血情况
2.1.1 AMI、UAP、AP三组患者一般资料比较:AMI、UAP、AP三组患者在性别比例、平均年龄、BMI指数、高血压、糖尿病、高脂血症、脑卒中以及饮酒史所占比例上不存在显著差异(P>0.05),而AMI组患者的吸烟人数所占比例显著高于UAP和AP组(P<0.05)。见表1。
表1 AMI、UAP、AP三组患者一般临床资料(±s)

表1 AMI、UAP、AP三组患者一般临床资料(±s)
注:与UAP和AP组相比,①P<0.05
项目 例数 性别(男/女)平均年龄(岁)BMI(kg/m2)既往史[例(%)]高血压 糖尿病 高脂血症 脑卒中 吸烟史饮酒史AMI组 31 18/13 51.9±5.0 24.2±3.1 19(61.29) 13(41.94) 8(25.81) 6(19.35) 25(80.65)① 12(38.71)UAP组 44 26/18 55.3±4.8 25.5±2.4 30(68.18) 19(43.18) 12(27.27) 10(22.73) 9(20.45) 15(34.09)AP组 14 9/5 52.7±8.1 23.9±1.8 9(64.29) 5(35.71) 5(35.71) 3(21.43) 7(50.00) 6(42.86)
2.1.2 AMI、UAP、AP三组各项化验指标比较:AMI组患者白细胞计数(WBC)、尿酸(UA)、心肌酶(CK)和心肌酶同工酶(CK-MB)浓度显著高于UAP组和AP组(P<0.05),UAP组患者的白细胞计数(WBC)、纤维蛋白原(Fgb)、心肌酶(CK)和心肌酶同工酶(CK-MB)浓度显著高于AP组(P<0.05)。其余各项指标组间差异无统计学意义(P>0.05)。见表2。
2.1.3 AMI、UAP、AP三组凝血常规指标比较:AMI组患者的部分凝血活酶时间(APTT)和国际标准化比值(INR)显著高于UAP组和AP组(P<0.05),AMI组和UAP组的纤维蛋白原(Fgb)、和D-D二聚体(D-D)浓度显著高于AP组(P<0.05),但AMI组和UAP组组间差异无统计学意义(P>0.05)。三组凝血酶原时间(PT)和血小板计数(PLT)组间差异无统计学意义(P>0.05)。见表3。
2.1.4 AMI、UAP、AP三组TEG参数指标比较:AMI组和UAP组的反应时间(R)和血凝块形成时间(K)时长显著低于AP组(P<0.05),而最大振幅(MA)和角度(Angle)显著高于AP组(P<0.05)。见表4。
2.1.5 AMI、UAP、AP三组高凝图形出现情况:AMI组共31例患者,其中有17例出现高凝图形,占54.84%;UAP组共44例患者,其中有14例出现高凝图形,占31.82%,AP组14例患者,无一出现高凝图形(0%),AMI、UAP、AP三组高凝图形出现比例组间存在显著差异(P<0.05),为AMI组>UAP组>AP组。
表2 AMI、UAP、AP三组各项化验指标比较(±s)

表2 AMI、UAP、AP三组各项化验指标比较(±s)
注:与UAP组比较,①P<0.05;与AP组比较,②P<0.05
项目 AMI组(n=31)UAP组(n=44)AP组(n=14)WBC(×109/L) 10.12±2.13①② 9.76±2.04②7.34±3.01 HGB(g/L) 138.49±16.88 141.82±13.72 136.92±15.64 PLT(×109/L) 206.72±43.81 213.93±31.84 199.77±53.16 Fgb(g/L) 4.22±0.91② 3.97±1.01② 3.06±0.63 Cr(μmol/L) 85.44±19.74 83.91±22.47 86.30±20.04 BUN(mmol/L) 5.17±1.49 5.02±1.37 5.09±1.08 UA(μmol/L) 366.74±66.20①②310.85±67.91 313.60±82.59 Glu(mmol/L) 6.14±2.49 5.87±1.68 6.06±1.93 TC(mmol/L) 4.83±0.84 4.99±0.93 5.01±1.02 TG(mmol/L) 1.71±0.85 1.75±0.94 1.74±1.00 LDL-c(mmol/L) 3.08±0.41 2.86±0.57 2.99±0.47 HDL-c(mmol/L) 1.09±0.22 1.13±0.14 1.08±0.18 CK(mmol/L) 886.79±172.46①337.14±76.44②38.29±11.63
表3 AMI、UAP、AP三组凝血常规指标比较(±s)

表3 AMI、UAP、AP三组凝血常规指标比较(±s)
注:与UAP组比较,①P<0.05;与AP组比较,②P<0.05
项目 AMI组(n=31)UAP组(n=44)AP组(n=14)PT(s)13.68±1.17 13.71±1.08 13.69±1.12 APTT(s) 25.76±2.34①②29.61±2.07② 34.83±2.11 INR 0.72±0.08①② 0.84±0.10② 0.95±0.07 Fgb(g/L) 4.22±0.91② 3.97±1.01② 3.06±0.63 D-D(mg/L) 0.31±0.05② 0.26±0.08② 0.09±0.02 PLT(×109/L)206.72±43.81 213.93±31.84 199.77±53.16
表4 AMI、UAP、AP三组TEG参数指标比较(±s)

表4 AMI、UAP、AP三组TEG参数指标比较(±s)
注:与AP组相比,①P<0.05
项目 AMI组(n=31) UAP组(n=44) AP组(n=14)R(min) 5.07±1.02① 5.14±1.13①6.19±1.30 K(min) 2.50±0.76① 2.56±0.83① 3.22±1.01 MA(mm) 67.91±12.71① 66.82±10.68① 55.49±11.76 Angle(o) 64.81±8.38① 65.09±6.07①54.83±4.99
2.1.6 AMI、UAP、AP三组病变范围情况:AMI组和AP组单支病变例数所占比例显著高于UAP组(P<0.05),AMI组和AP组组间不存在显著差异(P>0.05);UAP组双支病变所占比例显著高于AMI组和AP组(P<0.05),AMI组和AP组组间差异无统计学意义(P>0.05);而三组三支病变所占比例,组间差异无统计学意义(P>0.05)。AMI组存在冠脉完全闭塞所占比例显著高于另外两组(P<0.05)。见表5。

表5 AMI、UAP、AP三组病变范围情况[例(%)]
2.2 PCI术后血小板聚集抑制率情况分析
2.2.1 抗血小板药物反应情况:本次研究共纳入89例行PCI患者,术后结合血栓弹力图将其分为抗血小板药物反应低下组(A组)和抗血小板药物反应正常组(B组)两组,其中A组33例,对阿司匹林反应低下者5例(15.15%),对氯吡格雷反应低下者28例(84.85%)。A组患者糖尿病患者所占比例和吸烟史患者所占比例显著高于B组(P<0.05),其余资料差异无统计学意义(P>0.05)。两组患者一般临床资料见表6。
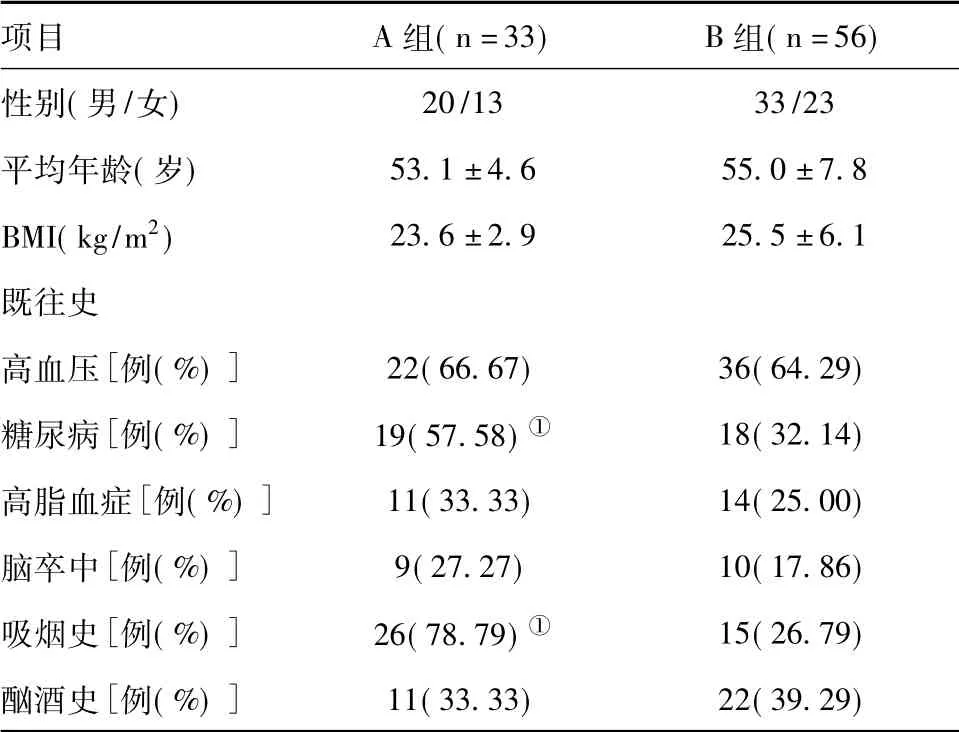
表6 A、B两组患者一般临床资料
2.2.2 两组患者合并用药情况:对于A组的糖尿病患者,给予西洛他唑片(100 mg/次,2次/d),两组患者在服用抗血小板药物同时合并服用其他药物的例数所占比例,两组间差异无统计学意义(P>0.05)。见表7。
2.2.3 两组患者治疗前凝血常规情况:A组和B组患者在治疗前,两组凝血常规各项指标均差异无统计学意义(P>0.05)。见表8。
2.2.4 两组患者治疗前血栓弹力图各项指标情况:两组患者治疗前血栓弹力图各项指标差异无统计学意义(P>0.05)。见表9。
2.2.5 两组患者治疗后化验指标和血小板聚集抑制率情况两组患者在行PCI治疗后各项化验指标均差异无统计学意义(P>0.05),A组患者的血小板抑制率(包括阿司匹林诱导和氯吡格雷诱导)显著低于B组(P<0.05)。见表10。

表7 两组患者合并用药情况[例(%)]

表8 两组患者治疗前凝血常规情况(x±s)
表9 两组患者治疗前血栓弹力图各项指标情况(±s)

表9 两组患者治疗前血栓弹力图各项指标情况(±s)
项目 A组(n=33) B组(n=56)R(min)5.33±1.62 5.36±1.57 K(min) 2.73±0.66 2.71±0.93 MA(min) 62.41±16.27 60.88±18.35 Angle(o)56.49±7.64 55.39±8.51
表10 两组患者治疗后化验指标和血小板聚集抑制率情况(±s)
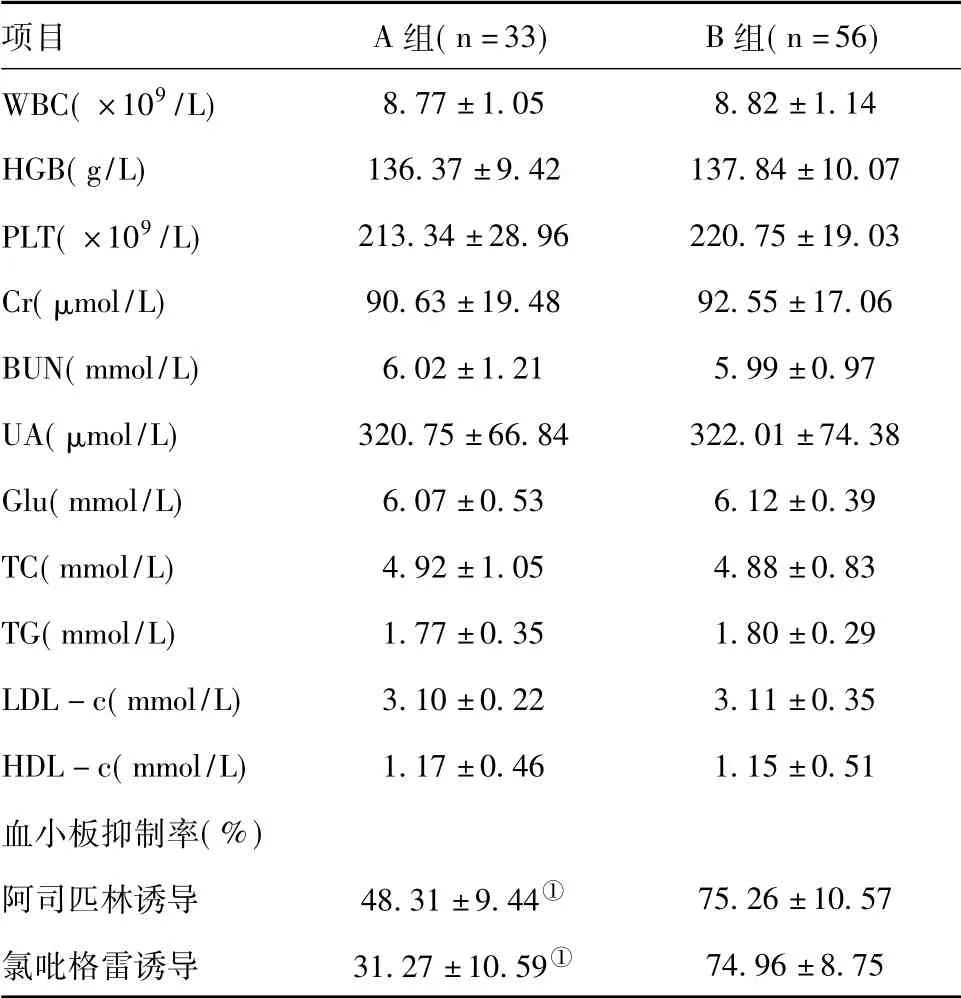
表10 两组患者治疗后化验指标和血小板聚集抑制率情况(±s)
注:与B组相比,①P<0.05
项目 A组(n=33) B组(n=56)WBC(×109/L)8.77±1.05 8.82±1.14 HGB(g/L) 136.37±9.42 137.84±10.07 PLT(×109/L) 213.34±28.96 220.75±19.03 Cr(μmol/L) 90.63±19.48 92.55±17.06 BUN(mmol/L) 6.02±1.21 5.99±0.97 UA(μmol/L) 320.75±66.84 322.01±74.38 Glu(mmol/L) 6.07±0.53 6.12±0.39 TC(mmol/L) 4.92±1.05 4.88±0.83 TG(mmol/L) 1.77±0.35 1.80±0.29 LDL-c(mmol/L) 3.10±0.22 3.11±0.35 HDL-c(mmol/L) 1.17±0.46 1.15±0.51血小板抑制率(%)阿司匹林诱导 48.31±9.44① 75.26±10.57氯吡格雷诱导 31.27±10.59①74.96±8.75
2.2.6 两组患者病变范围和术后发生缺血事件情况:两组患者的各项病变范围例数所占比例差异无统计学意义(P>0.05),A组患者PCI术后有5例发生心绞痛,B组有2例,A组患者PCI术后发生心绞痛人数所占比例显著高于B组,心肌梗死和脑卒中所占比例差异有统计学意义(P<0.05)。见表11。

表11 两组患者病变范围和术后发生缺血事件情况
2.2.7 患者对抗血小板药物反应低下的多因素分析:根据单因素卡方检验结果进行多因素Logistic回归分析,Y=抗血小板药物反应低下,X1=吸烟史(0=无吸烟史,1=有吸烟史),X2=糖尿病史(0=无糖尿病史,1=有糖尿病史),得到下列方程:logit(P)=17.422+14.583X1+23.721X2
各因素的OR 95%CI下限均大于1,提示糖尿病史和吸烟史可能是导致患者对抗血小板药物反应低下的独立危险因素。
3 讨论
3.1 不同冠心病血栓弹力图各项指标的意义:从此次研究的结果中可以看出,AMI组和UAP组的血栓弹力图中,其凝血反应时间(R值)和血凝块形成时间(K值)均显著高于AP组(P<0.05),而最大波幅(MA)和两条曲线夹角显著低于AP组(P<0.05)。此结果中各项指标的含义如下:
3.1.1 凝血反应时间(R值):在TEG中,当检测标本开始运作,直至第一块血凝块被检测到所需要的时间即为凝血反应时间(R值),其意义是该标本中纤维蛋白开始形成的时间[5]。R值反映了该标本中内源性凝血系统的状态,包括凝血因子和循环凝血抑制因子二者之间的动态平衡关系。当R值延长时,代表标本中存在抗凝剂以及凝血因子作用时间的相应延长,而R值缩短则代表标本处于高凝状态。结合此次研究的结果可得知,AMI和UAP患者,即急性冠脉综合征患者的血液均呈高凝状态。
3.1.2 血凝块形成时间(K值):当标本的血凝块形成被血栓弹力图分析仪检测到后,到该血凝块产生的振幅达到20 mm(即达到一定硬度)的时间,即为血凝块形成时间。K值反映了标本中纤维蛋白形成和交叉连接导致血栓形成获得固定的弹性黏度所需的时间。当K值变小时,代表该标本中纤维蛋白浓度较高,或血小板的功能较强,且以纤维蛋白浓度占主要作用[6]。在对标本中加入抗凝剂后,K值提高,说明急性冠脉综合征患者血液中纤维蛋白水平较高,凝血速度较快,而Fgb的检测结果也从侧面证实了这一观点。
3.1.3 最大波幅(MA):在血栓弹力图中,两条曲线之间最宽的距离,即为最大波幅。MA值反映了标本中纤维蛋白形成的血栓的绝对强度。也从侧面反映了标本中纤维蛋白和血小板的最大动力性质。其数值主要受标本中纤维蛋白和血小板的浓度及功能决定,与R值不同的是,MA主要以血小板的功能占主要作用。结合本次研究结果可以看出,AMI和UAP患者(即急性冠脉综合征患者)的MA值要显著大于AP患者,这说明ACS患者血小板的凝血功能更强[7]。
3.1.4 角度(Angle):血栓弹力图两条曲线形成分叉时,形成的角度即为Angle。Angle是从该标本从形成可检测到的血凝块开始,到两条曲线各切线两两间形成的最大夹角。其代表血凝块在形成的过程中的动力学变化过程与特性,其不仅可以反应血栓形成的速度,也可以反应该标本中纤维蛋白原的浓度和血小板的凝血功能。与K值类似,标本中纤维蛋白原的浓度对Angle的影响占主要地位[8]。结合此次研究结果可以看出,AMI组和UAP组两组患者的Angle显著较AP组患者大(P<0.05),这提示急性冠脉综合征患者血液中纤维蛋白水平较高,凝血速度较快。
3.2 不同冠心病部分凝血指标的意义:此次研究发现,AMI组和UAP组患者的纤维蛋白原(Fgb)和D-D二聚体(DD)浓度均显著高于AP组患者(P<0.05),而AMI组患者的部分凝血酶原时间(APTT)和国际标准化比值(INR)显著低于UAP组和AP组患者(P<0.05)。
3.2.1 纤维蛋白原(Fgb):在生理条件下,当血小板(PLT)活化后,纤维蛋白原(Fgb)随即与PLT表面的蛋白结合,与Fgb结合后的PLT会进一步的活化并且发生释放反应,从而导致大量血小板发生聚集,这也是血小板血栓形成的原因之一。邱丽君在研究中发现,Fgb可以对血管内皮细胞产生作用,导致其排列发生紊乱,通透性增强,继而刺激血管平滑肌和血管内膜厚度的增加,从而导致动脉粥样硬化的发生[9]。
3.2.2 D-D二聚体(D-D):交联纤维蛋白在纤溶酶的作用下,降解为D-D二聚体(D-D),当标本中D-D的含量升高时,提示该标本的纤溶活性(继发性)增强,且标本中凝血酶的水平升高,此时标本呈高凝状态,易形成血栓。Osthaus认为,D-D可以作为鉴别纤溶活性原发性或继发性增强的一项指标[10]。当标本中D-D水平升高后,血液流变学会发生相应的变化,具体表现为对血管的切应力的改变。而谢一唯等人发现,D-D水平升高还会使粥样斑块的稳定型下降,易发生破裂[11]。
从此次研究的结果中可以看出,AMI组和UAP组患者血浆中的Fgb和D-D水平显著高于AP组患者(P<0.05),这提示AMI和UAP患者的血液呈高凝状态,且易形成血栓,不仅如此,AMI和UAP患者还伴有继发性纤溶活性的增强。
3.2.3 部分凝血活酶时间(APTT):部分凝血活酶时间主要反映标本的内源性凝血途径的状态,临床上常作为检测肝素使用的监测指标,其降低具有临床意义,代表血液处于高凝状态。
3.2.4 国际标准化比值(INR):INR的反应标本外源性凝血途径最有效的指标之一,与凝血酶原时间(PT)相比,INR可以排除一些外界因素的干扰而更为准确,故已经最为近年来最为常用的检测抗凝剂使用的指标之一。当标本处于高凝状态时,或有血栓形成是,INR会相应降低。Zacharowski在研究中显示,INR可以作为评估严重心血管事件发生的一项重要指标[12]。
从此次研究的结果中可以看出,AMI组患者标本中APTT和INR值显著低于另外两组(P<0.05),这提示AMI患者血液较UAP和AP患者的血液具有更高的高凝状态,且更易形成血栓。
将本次研究的血栓弹力图结果和凝血常规各项指标结合来分析,提示急性冠脉综合征患者的凝血活性显著身高,且更容易形成冠脉血栓,这些结果也与ACS的发病机制一致。而随着冠心病病情的加重,这种高凝状态也随之升高,这也指导临床在处置ACS患者的过程中,应尽早实行抗栓治疗。
3.3 抗血小板在治疗冠心病中的意义
3.3.1 抗血小板药物反应低下:现今对于急性冠脉综合征的患者,其基本治疗方法仍是采取抗血小板治疗。对于拟行经皮冠状动脉介入治疗的患者,抗血小板治疗更是必不可少,且目前多采用阿司匹林和氯吡格雷双重抗血小板用药疗法。但是在临床应用过程中,发现有小部分患者在抗血小板治疗后,仍发生了缺血事件,甚至血栓的形成,临床上称之为抗血小板药物反应低下。此类患者又分为对阿司匹林和抵抗和对氯吡格雷抵抗两种。抗血小板药物抵抗,可以被看做是一种“治疗失败”,是指在使用了治疗剂量的阿司匹林或氯吡格雷后,患者仍发生了缺血时间或形成血栓。关于抗血小板药物抵抗,有学者认为,动脉血栓的形成原因除血小板因素外,还有许多其他的因素,故单独使用抗血小板药物而导致抗凝血失败是一种十分常见的现象。而新近研究结果表明,出现抗血小板药物抵抗是由于患者出现了“血小板反应变异”,随后,有大量的研究也证实在使用抗血小板药物时,存在个体差异。
3.3.2 血栓弹力图检测PCI术后血小板聚集抑制率:从此次研究的结果中可以看出,89例患者,在PCI术后,共有33例患者出现了抗血小板药物抵抗的情况,其中对阿司匹林反应低下者5例(15.15%),对氯吡格雷反应低下者28例(84.85%)。结果与张爱民的结果一致。该结果提示,对于氯吡格雷发生抵抗的概率要显著高于对阿司匹林发生抵抗的概率(P<0.05),而其具体机制仍有待探讨[13]。此次研究未发现有同时对阿司匹林和氯吡格雷两种抗血小板药物同时发生抵抗的患者,可能是因为此次研究的纳入样本较少。
综上所述,AMI和UAP患者,TEG显示血液高凝状态显著高于AP患者,并伴有继发性纤溶。血栓弹力图可作为冠心病(尤其AMI和UAP)指导抗凝治疗的指标和病情发展的监测指标。高水平的Fgb和患者对氯吡格雷反应低下可能会增加患者近期缺血事件发生概率,根据血栓弹力图检测血小板聚集抑制率可以有效地指导临床的降纤治疗,减少近期缺血事件的发生
[1] Kashuk JL,Moore EE,Le T,et al.Noncitrated whole blood is optimal for evaluation of postinjury coagulopathy with pointof-care rapid thrombelastography[J].Journal of Surgical Research,2009,156(1):133.
[2] 周 薇.血栓弹力图的临床应用及进展[J].肠外与肠内营养,2011,18(5):314.
[3] Mallet SV,Cox DJA.Thrombelastography[J].British Journal of Anaesthesia,1992,69(3):307.
[4] 汤晓静,郁胜强.血栓弹力图在评价肾病综合征患者高凝状态中的作用[J].中国全科医学,2011,14(17):1890.
[5] Osthaus WA,Witt L,Johanning K,et al.Equal effects of gelatin and hydroxyethyl starch(6%HES130/0.42)on modified thrombelastography in children[J].Acta Anaesthesiologica Scandinavica,2009,53(3):305.
[6] Atkinson HM,Mewhort Buist TA,Berry LR,et al.Anticoagulant mechanisms of covalent antithrombin-heparin investigated by thrombelastography.Comparison with unfractionated heparin and low-molecular-weight heparin[J].Thrombosis and Haemostasis:Journal of the International Society on Thrombosis and Haemostasis,2009,102(1):62.
[7] 程 磊,梁恩和,姚 鑫,等.血栓弹力图在颅脑损伤后弥散性血管内凝血诊治中的价值[J].中国神经精神疾病杂志,2012,38(9):513.
[8] Reikvam H,Steien E,Hauge B,et al.Thrombelastography[J].Transfusion and apheresis science:official journal of the World Apheresis Association:official journal of the European Society for Haemapheresis,2009,40(2):119.
[9] 邱丽君,顾 青,孟 俊,等.脑血管疾病血栓弹力图和纤维蛋白原相关性探讨[J].检验医学,2012,27(5):382.
[10] Osthaus WA,Boethig D,Johanning K,et al.Whole blood coagulation measured by modified thrombelastography(ROTEM)is impaired in infants with congenital heart diseases[J].Blood coagulation&fibrinolysis:an international journal in haemostasis and thrombosis,2008,19(3):220.
[11] 谢一唯,朱炳伟.急性脑梗死患者血栓弹力图与常规凝血试验相关性分析[J].检验医学,2012,27(2):88.
[12] Zacharowski K,Sucker C,Zacharowski P,et al.Thrombelastography for the monitoring of lipopolysaccharide induced activation of coagulation[J].Thrombosis and Haemostasis:Journal of the International Society on Thrombosis and Haemostasis,2006,95(3):557.
[13] 张爱民,张桂芬.血栓弹力图在妊娠合并血小板减少症的临床应用研究[J].医疗卫生装备,2014,35(12):70.
[14] Gibbs NM,Yim D,Weightman W,et al.The effect of excess protamine on thrombelastography in vitro[J].Anaesthesia and intensive care,2006,34(5):579.
[15] Spiel AO,Mayr FB,Firbas C,et al.Validation of rotation thrombelastography in a model of systemic activation of fibrinolysis and coagulation in humans[J].Journal of thrombosis and haemostasis:JTH,2006,4(2):411.
