RNA干扰沉默USP22基因对人鼻咽癌裸鼠移植瘤生长的影响
2015-04-01廖志伟庄雅靖余宏伟刘孟忠周同冲
廖志伟 庄雅靖 余宏伟 喻 芳 刘孟忠 周同冲
1.广州医科大学附属肿瘤医院放疗科,广东广州 510095;2.中山大学肿瘤防治中心放疗科,广东广州 510060
泛素特异性肽酶22(ubiquitin-specific processing peptidase 22, USP22)属于去泛素化酶蛋白酶超家族,具有去泛素化的作用。USP22 编码产物在人类各种正常组织中呈现低丰度表达,在许多恶性肿瘤细胞中呈高丰度表达[1]。由于其在实体瘤中的特异性分布,可以作为肿瘤治疗的新靶点。
RNA 干扰(RNA interference,RNAi)技术作为一种干预基因表达的实验工具已广泛用于抗肿瘤的研究。 慢病毒载体介导的基因表达或RNAi 作用持续且稳定,其作为新一代高效表达载体推进了肿瘤的基因治疗研究。 本研究将CNE-2 细胞, 转染对照质粒的CNE-2 稳定细胞株, 转染sh-USP22 质粒的CNE-2稳定细胞株,于动物背部行皮下注射,观察其对裸鼠移植瘤成瘤的影响, 旨在研究USP22 沉默后的体内抗肿瘤效应。
1 材料与方法
1.1 材料
细胞:正常CNE-2 细胞,购自中南大学湘雅中心实验室, 培养及保存在广州永诺生物科技有限公司。本实验室前期研究以pLL3.7 质粒为载体,USP22 shRNA 序列靶点引自本课题组前期实验靶序列[2-3],针对USP22 的编码序列设计的干扰序列如下:
sh-USP22 组:5'-AACTCACGGACAGTCTCAACAATTTCAAGAGAATTGTTGAGACTGTCCGTGTTTTTTC-3'; 3'-TTGAGTGCCTGTCAGAGTTGTTAAAGTTCTCTTAACAACTCTGACAGGCACAAAAAAGAGCT-5'。 阴性对照组:5'-AACTTTCTCCGAACGTGTCACGTTTCAAGAGAACGTGACACGTTCGGAGAATTTTTTC-3'; 3'-TTGAAAGAGGCTTGCACAGTGCAAAGTTCTCTTGCACTGTGCAAGCCTCTTAAAAAAGAGCT-5'。
正常CNE-2(阴性对照),CNE-2 空载体细胞(Scrambled),USP22 表达下调稳定细胞株(sh-USP22),3 种细胞用含10%胎牛血清(GIBCO)的RPMI 1640 培养液(GIBCO)培养于CO2体积分数为5%的37℃的培养箱中。
实验动物:6 周龄、雌性、SPF 级BALB/c 裸鼠9 只,购于中山大学实验动物中心。 动物合格证编号:No.44008500006768,饲养于中山大学实验动物中心。 在无特殊病原条件(SPF)下饲养,饲料及水均自由摄入且经过严格的灭菌处理。
1.2 裸鼠体内成瘤实验方法
取对数生长期细胞,消化后,PBS 重悬离心,去除血清,最后将细胞重悬于PBS 溶液中,调整密度为5×107个/mL。 100μL 细胞悬液,于动物右侧背部行皮下注射。
实验分组:阴性对照组,CNE-2 空载体细胞株组(Scrambled 组),USP22 表达下调稳定细胞株组 (sh-USP22 组),每组3 只裸鼠。从第2 周开始每周测量肿瘤体积变化,第8 周结束实验,断颈处死裸鼠,剥取肿瘤,称重,冻存备用。 根据公式V=1/2(a×b2)计算肿瘤体积(V 代表瘤体积,a 为长径,b 为短径)。
1.3 RT-PCR 检测USP22 mRNA 的水平
按照Trizol 试剂说明书(Invitrogen 公司)提取肿瘤组织的总RNA,采用Promega 公司的M-MLV 逆转录酶进行逆转录反应, 用RT-PCR Quick Master Mix(Toyobo 公司)进行PCR 反应。
以Primer 5.0 软件设计引物,委托英骏生物技术有限公司合成,引物序列如下:
USP22-F:5'-CCATTGATCTGATGTACGGAGG-3';USP22-R:5'-TCCTTGGCGATTATTTCCATGTC-3';GAPDH-F:5'-GAGTCAACGGATTTGGTCGT-3';GAPDH-R:5'-GACAAGCTTCCCGTTCTCAG-3'。
反应体积包括:正反引物各1 μL,cDNA 产物1 μL,Taq 混合物25 μL,去RNA 酶去离子水22 μL,震荡混匀后放入PCR 仪中,调整好反应程序。 执行扩增。一般: 在93℃预变性3~5 min, 进入循环扩增阶段:93℃40 s→58℃30 s→72℃60 s, 循环30~35 次,最后在72℃时保温7 min。 PCR 产物于4℃保存待电泳检测。 PCR 产物在质量分数为2%的琼脂凝胶中,80 V恒压电泳30 min,在凝胶图像成像系统观察结果。 记录结果并进行灰度分析。 选取GAPDH 做内参,采用灰度分析计算USP22 相对表达量。
1.4 免疫组化检测USP22 蛋白的表达
分离得到的肿瘤用甲醛固定、组织包埋、石蜡切片、经二甲苯脱蜡、梯度酒精水化、热抗原修复。 分别检测各组织切片中USP22 的表达,具体步骤按VECTASTAIN ABC Kit (Vector laboratories 公司)试剂盒的说明书进行。 一抗为1∶200 兔抗人USP22 抗体(ab71732,Abcam 公司), 二抗为羊抗兔IgG 抗体-HRP多聚体。上述各步骤间用PBS 缓冲液洗片3 次、DAB 显色、苏木精复染、光镜下观察结果。将细胞浆内棕黄色颗粒超过肿瘤细胞浆体积1/4 者计为阳性细胞,统计500 个细胞中的阳性细胞数,计算阳性细胞百分比。
2 结果
2.1 裸鼠皮下移植瘤的生长情况及生长曲线测定肿瘤的生长
通过测量肿瘤长短径计算肿瘤体积,绘制出3 组皮下瘤生长曲线。 肿瘤生长曲线显示,sh-USP22 组肿瘤体积明显小于阴性对照组和Scrambled 组, 随着接种时间的延长,差异越来越明显。 见表1。
表1 各组裸鼠肿瘤体积的变化(mm3,)
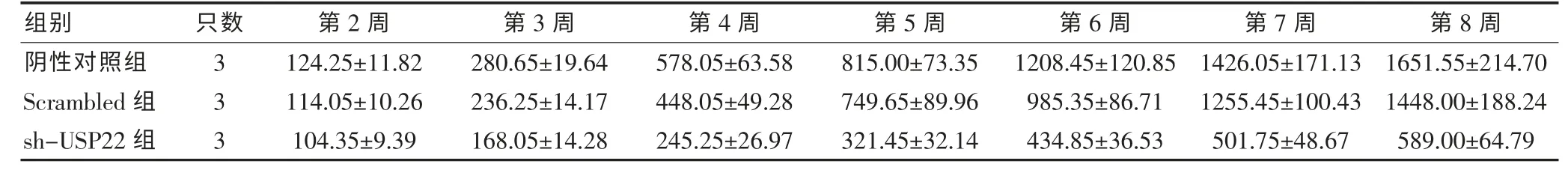
表1 各组裸鼠肿瘤体积的变化(mm3,)
组别 第3 周 第4 周 第5 周 第6 周 第7 周 第8 周第2 周只数阴性对照组Scrambled 组sh-USP22 组333 124.25±11.82 114.05±10.26 104.35±9.39 280.65±19.64 236.25±14.17 168.05±14.28 578.05±63.58 448.05±49.28 245.25±26.97 815.00±73.35 749.65±89.96 321.45±32.14 1208.45±120.85 985.35±86.71 434.85±36.53 1426.05±171.13 1255.45±100.43 501.75±48.67 1651.55±214.70 1448.00±188.24 589.00±64.79
终点时间第8 周断颈处死裸鼠后剥离瘤体,sh-USP22 组肿瘤重量(0.54±0.07)g 明显小于阴性对照组(1.58±0.24)g 和Scrambled 组(1.46±0.23)g,差异均有统计学意义(均P <0.05),见图1。
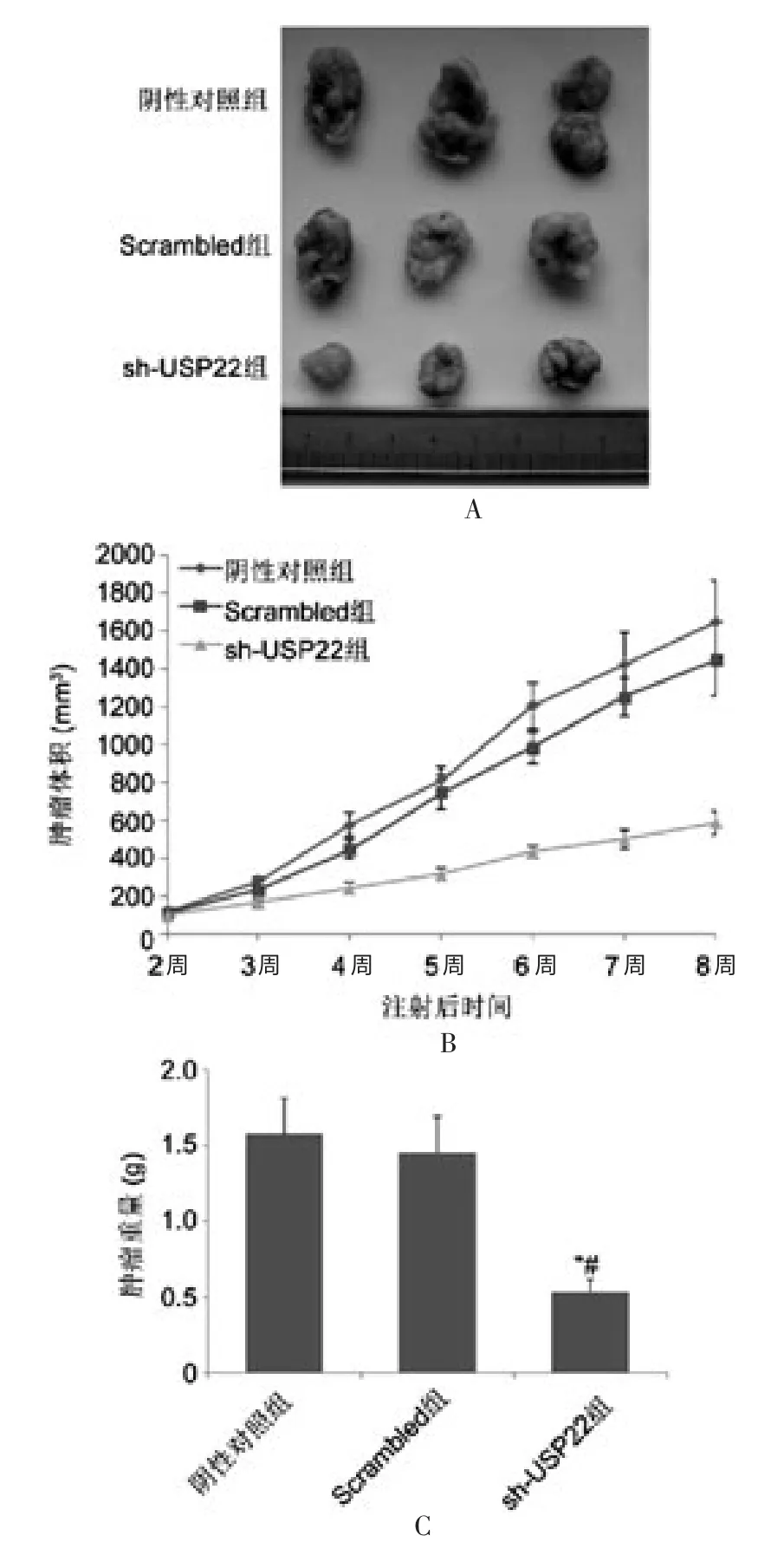
图1 鼻咽癌细胞株CNE-2 裸鼠移植瘤生长曲线和瘤体比较
2.2 半定量RT-PCR 检测USP22 mRNA 水平的变化
获取肿瘤后,进行半定量RT-PCR,以琼脂糖电泳条带的亮度来判断USP22 mRNA 水平高低。 sh-USP22 移植瘤组织出现很弱的特异性条带,而阴性对照组和Scrambled 组移植瘤组织条带明显较亮。 以GAPDH 为参照基因,分析凝胶成像图像的灰度值,将获得的目的基因灰度与参照基因灰度的比值作为表达量。 结果分析表明, 以阴性对照组表达量为参照(1),sh-USP22 组肿瘤组织中USP22 mRNA 相对表达量(0.14±0.09)低于阴性对照组和Scrambled 组(0.92±0.11),差异均有统计学意义(均P <0.05);而阴性对照组和Scrambled 组(0.92±0.11)比较,差异没有统计学意义(P >0.05)。
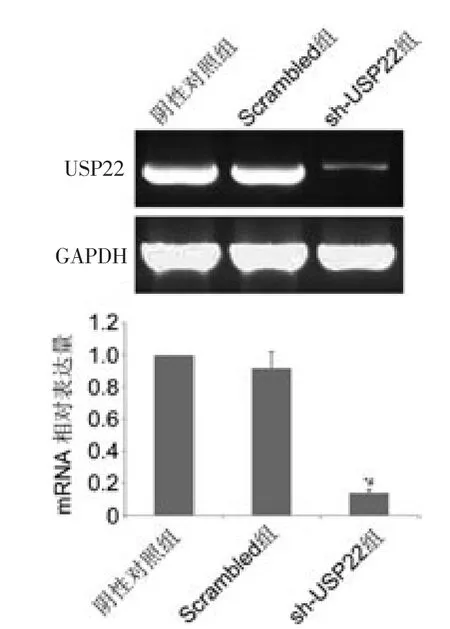
图2 半定量RT-PCR 检测3 组裸鼠移植瘤组织中USP22 mRNA 的表达
2.3 免疫组织化学法检测移植瘤内USP22 蛋白表达的变化
USP22 蛋白染色阳性为深黄色或棕黄色,主要位于细胞质内。 免疫组化染色后可见阴性对照组和Scrambled 组裸鼠皮下移植瘤组织中有较多棕黄色颗粒,细胞胞质中可见明显棕黄色染色。而sh-USP22 组裸鼠皮下移植瘤中,阳性染色细胞减少,细胞浆内着色颗粒明显少于阴性对照组和Scrambled 组, 包浆黄色明显减弱、变浅,表明注射pLL-shRNA 后人鼻咽癌裸鼠移植瘤中的USP22 蛋白表达下降。 见图3(封三)。
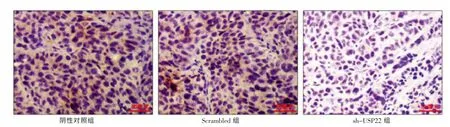
图3 免疫组织化学法检测移植瘤组织中USP22 的表达情况(200×)
将细胞浆内棕黄色颗粒超过肿瘤细胞浆体积的1/4 者计为阳性细胞,统计500 个细胞中的阳性细胞数,计算阳性细胞百分比。 sh-USP22 组(12.45±1.16)%肿瘤组织中USP22 阳性细胞所占比率明显低于阴性对照组(97.25±1.94)%和Scrambled 组(91.28±2.75)%,差异均有统计学意义(均P <0.05);阴性对照组(97.25±1.94)%和Scrambled 组 (91.28±2.75)%比较,差异没有统计学意义(P >0.05),表明USP22 表达明显降低,USP22 shRNA 抑制了USP22 的表达。见图4。
3 讨论
鼻咽癌是我国南方常见的恶性肿瘤,放射治疗是鼻咽癌最主要的治疗方法[4-5]。转移仍是鼻咽癌治疗失败的主要原因[6]。阐明鼻咽癌发生的分子机制,从而采取有效的干预措施控制转移一直是鼻咽癌研究的重点。 随着分子生物学技术的发展,从基因水平调控肿瘤的生长成为科学家们的重点研究方向。

图4 各组USP22 阳性细胞所占比率
Glinsky 等[7]通过mRNA 微集阵列技术在多种癌组织中研究证明了一组包含11 个基因的癌死亡标签,USP22 作为其中一员而引起高度关注。 人类USP22 基因定位于人17 号染色体上,由14 个外显子组成,其编码蛋白表达于细胞核,具有去泛素化的作用,可以使泛素从复合物中脱离。 USP22 通过去泛素化修饰达到调节细胞周期和促进肿瘤增殖的作用,其作为细胞信号网络中的枢纽分子很可能是多种细胞癌变、浸润的重要环节之一[8-11]。
文献发现USP22 在多数恶性肿瘤细胞中表达普遍升高,并且其表达水平与结直肠癌[12]、宫颈癌[13]、肺癌[14]、甲状腺癌[15]、脑胶质瘤[16]、乳腺癌[17]、食管癌[17]、胃癌[18]、卵巢癌[19]、胰腺癌[20]等恶性肿瘤的预后有密切的关系,USP22 表达增高者预后差。 USP22 可以通过上皮间质转化(EMT)促进肺癌增殖、侵袭[21]。 本实验前期研究发现,USP22 的mRNA 及蛋白水平在多个鼻咽癌细胞系(CNE-1,CNE-2)中均较正常鼻咽上皮细胞(NPEC)明显升高,为进一步肯定这一现象,本研究检测了正常鼻黏膜及鼻咽癌组织中USP22 水平,结果与细胞系一致,鼻咽癌组织USP22mRNA 及蛋白水平均上调。 更进一步的研究发现,抑制USP22 的表达使鼻咽癌细胞株生长增殖能力降低,USP22 通过使AKT/GSK-3/Cyclin 通路中的p-AKT、p-GSK-3β、cyclinD1 表达下调和GSK-3β、AKT 上调而调控细胞生长增殖周期[2]。 因此,研究者认为USP22 对鼻咽癌发生发展可能有重要影响, 下调USP22 基因水平能对肿瘤起治疗作用。
RNAi 作为一种简单有效的基因敲除方法, 能够高效、特异沉默目的基因,使突变基因稳定沉默而不影响正常基因的表达,已成为基因功能研究的有力工具。 慢病毒载体介导的RNAi 作用持续且稳定,能达到良好的基因治疗效果,具有广阔的应用前景。 既往研究已成功构建并鉴定USP22 sh-RNA 慢病毒载体,包装成适合感染目的细胞的慢病毒颗粒,为进一步研究USP22 基因在人鼻咽癌细胞中的作用机制打下坚实的基础[3]。
本研究选用BALB/c 裸鼠作为体内实验的动物模型,具有易成瘤、易饲养、相对稳定等优点。 通过观察并记录各组裸鼠种植瘤的生长情况, 研究者发现在USP22 基因表达沉默后,裸鼠成瘤时间晚,瘤体生长明显减缓。 提示沉默USP22 基因表达可使人鼻咽癌细胞株CNE-2 裸鼠移植瘤生长受到抑制。 RT-PCR和免疫组化的结果从mRNA 水平和蛋白水平显示pLL-shRNA-USP22 能明显抑制肿瘤组织中USP22的表达, 进一步说明USP22 在鼻咽癌的发展中可能起着重要的促进作用。
综上所述,本研究以pLL3.7 慢病毒质粒为载体,成功构建了重组表达质粒pLL-shRNA-USP22, 通过慢病毒介导的sh-RNA 沉默人鼻咽癌CNE-2 细胞中USP22 基因表达, 可以在裸鼠体内抑制肿瘤的生长。虽然对人体而言, 鼻咽癌瘤块内直接注射pLLshRNA-USP22 的方法并不可行, 但本研究为临床利用小RNA 干扰技术治疗鼻咽癌提供了新的治疗思路,USP22 基因有望成为鼻咽癌治疗的新靶点。
[1] Lee HJ,Kim MS,Shin JM,et al. The expression patterns of deubiquitinating enzymes,USP22 and Usp22 [J]. Gene Expr Patterns,2006,6(3):277-284.
[2] Zhuang Y,Liao Z,Yu H,et al. ShRNA-mediated silencing of the ubiquitin-specific protease 22 gene restrained cell progression and affected the Akt pathway in nasopharyngeal carcinoma[J].Cancer Biology&Therapy,2014,16(1):88-96.
[3] 余宏伟,廖志伟,庄雅靖,等.USP22 ShRNA 慢病毒载体的构建及鉴定[J].中国当代医药,2014,21(32):9-12,15.
[4] 廖志伟,周同冲,宋先璐,等.尼妥珠单抗联合顺铂同步放化疗治疗鼻咽癌的临床研究[J].中国医药导报,2013,10(10):71-73.
[5] 岳海振,贾飞,张健,等.鼻咽癌容积调强放射治疗剂量验证比较研究[J].北京生物医学工程,2013,32(4):375-379.
[6] 艾芬,陈阵.正电子计算机体层扫描与核磁共振成像诊断国人鼻咽癌转移的Meta 分析[J].中国医药导报,2014,11(2):81-84.
[7] Glinsky GV,Berezovska O,Glinskii AB. Microarray analysis identifies a death-from-cancer signature predicting therapy failure in patients with multiple types of cancer [J].J Clin Invest,2005,115(6):1503-1521.
[8] Liu YL,Jiang SX,Yang YM,et al. USP22 acts as an oncogene by the activation of BMI-1-mediated INK4a/ARF pathway and Akt pathway[J].Cell Biochem Biophys,2012,62(1):229-235.
[9] Liu Y,Yang Y,Xu H,et al. Implication of USP22 in the regulation of BMI-1, c-Myc, p16INK4a, p14ARF, and cyclin D2 expression in primary colorectal carcinomas [J].Diagn Mol Pathol,2010,19(4):194-200.
[10] Zhang XY,Varthi M,Sykes SM,et al. The putative cancer stem cell marker USP22 is a subunit of the human SAGA complex required for activated transcription and cell-cycle progression[J].Mol Cell,2008,29(1):102-111.
[11] Schrecengost RS,Dean JL,Goodwin JF,et al. USP22 regulates oncogenic signaling pathways to drive lethal cancer progression [J]. Cancer Res,2014,74(1):272-286.
[12] Liu YL,Yang YM, Xu H,et al. Aberrant expression of USP22 is associated with liver metastasis and poor prognosis of colorectal cancer[J].J Surg Oncol,2011,103(3):283-289.
[13] Yang M,Liu YD,Wang YY,et al. Ubiquitin-specific protease 22:a novel molecular biomarker in cervical cancer prognosis and therapeutics[J].Tumour Biol,2014,35(2):929-934.
[14] Ning J,Zhang J,Liu W,et al. Overexpression of ubiquitin-specific protease 22 predicts poor survival in patients with early-stage non-small cell lung cancer [J]. Eur J Histochem,2012,56(4):e46.
[15] Wang H,Li YP,Chen JH,et al. Prognostic significance of USP22 as an oncogene in papillary thyroid carcinoma[J].Tumour Biol,2013,34(3):1635-1639.
[16] Liang J,Zhang X,Xie S,et al. Ubiquitin-specific protease 22:a novel molecular biomarker in glioma prognosis and therapeutics [J]. Med Oncol,2014,31(4):899.
[17] Zhang Y,Yao L,Zhang X,et al. Elevated expression of USP22 in correlation with poor prognosis in patients with invasive breast cancer[J].J Cancer Res Clin Oncol,2011,137(8):1245-1253.
[18] 邓美洲,陶凯雄,王国斌,等.泛素特异性肽酶22 在胃癌中的表达及其临床意义[J].腹部外科,2011,24(5):302-303.
[19] Ji M,Shi H,Xie Y,et al. Ubiquitin specific protease 22 promotes cell proliferation and tumor growth of epithelial ovarian cancer through synergy with transforming growth factor beta1 [J]. Oncol Rep,2015,33(1):133-140.
[20] Ning Z,Wang A,Liang J,et al. USP22 promotes the G1/S phase transition by upregulating FoxM1 expression via beta-catenin nuclear localization and is associated with poor prognosis in stage Ⅱpancreatic ductal adenocarcinoma [J]. Int J Oncol,2014,45(4):1594-1608.
[21] Hu J,Yang D,Zhang H,et al. USP22 promotes tumor progression and induces epithelial-mesenchymal transition in lung adenocarcinoma [J]. Lung Cancer,2015,88(3):239-245.
