苯并[α]芘胁迫对三角褐指藻抗坏血酸-谷胱甘肽循环活动的影响❋
2015-03-31潘鲁青
牛 晓, 李 赟, 潘鲁青
(中国海洋大学海水养殖教育部重点实验室, 山东 青岛 266003)
苯并[α]芘胁迫对三角褐指藻抗坏血酸-谷胱甘肽循环活动的影响❋
牛 晓, 李 赟❋❋, 潘鲁青
(中国海洋大学海水养殖教育部重点实验室, 山东 青岛 266003)
以三角褐指藻 (Phaeodactylumtricornutum)为材料,在连续4d内,以100、400、700μg/L 3个剂量的苯并[α]芘(B[α]P)对三角褐指藻进行胁迫试验,分析苯并[α]芘对三角褐指藻的毒性效应,测定三角褐指藻的抗坏血酸-谷胱甘肽(AsA-GSH)循环非酶成分、含量及酶活性。研究表明:随着B[α]P浓度的提高和胁迫时间的延长,B[α]P对三角褐指藻的生长抑制作用逐渐增强;藻细胞内丙二醛(MDA)含量及总抗氧化能力(TAOC)显著升高,两者与胁迫强度的相关性系数分别为0.960和0.894;同时,AsA-GSH循环中的非酶成分抗坏血酸(AsA)、谷胱甘肽(GSH)含量增加,相关酶谷胱甘肽还原酶(GR)、抗坏血酸过氧化物酶(APX)、脱氢抗坏血酸还原酶(DHAR)和单氢抗坏血酸还原酶(MHAR)活性普遍增加,其中,GSH含量、GR、APX和DHAR活性与藻细胞内MDA含量相关性系数分别为0.744、0.852、0.652和0.600。结果表明:AsA-GSH循环是三角褐指藻细胞对抗苯并芘胁迫、猝灭活性氧、降低膜脂过氧化的重要方式;细胞内AsA含量、GR活性及APX活性对苯并芘胁迫响应迅速、变化显著,是潜在的生物指示物。
三角褐指藻; 苯并[α]芘胁迫; 抗坏血酸-谷胱甘肽循环组分
由于工业的发展及人类活动,多环芳烃类的有机污染物广泛分布在包括海洋在内的多种区域,这些污染物不仅对环境中的生物多样性造成直接威胁,它们还通过食物链富集并传递进而对人类的健康造成伤害。在这些受关注的PAHs污染物中苯并[α]芘(B[α]P)毒性最强,被国际癌症调查组织确定为一级致癌物[1-2],是环境监测的目标污染物之一。
有关B[α]P对海洋生物毒性的研究已涉及到鱼类[3]、虾蟹类[4]、贝类[5]及浮游生物[6]等,有关B[α]P胁迫生物生理生化方面的研究也已有不少报道,这些研究表明, B[α]P诱导的氧化损伤是导致毒性伤害的重要因素。
光合细胞内存在一套完整的抗氧化体系。光合细胞中产生的活性氧自由基(ROS)一般首先经超氧化物歧化酶(SOD)转化为H2O2,产生的H2O2再分别经过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)、芬顿反应(Fenton reaction)及AsA-GSH循环等几种方式清除。其中, AsA-GSH循环广泛分布于细胞质基质、线粒体、叶绿体和过氧化物酶体之中,由3个氧化还原对和4种酶组成,在猝灭H2O2方面具有极为关键的作用[7]。目前,已有研究分别在重金属胁迫的绿豆[8]和淡水藻类[9]、干旱的小麦[10]、渍水的康乃馨[11]和苹果[12]、紫外线照射的藻类[13]、盐度胁迫的小麦[14]和黄瓜[15]以及荧蒽暴露的浮萍[16]上进行了AsA-GSH循环相关组分的变化情况。上述研究表明,各类胁迫均可以造成细胞氧化损伤,从而显著诱导AsA-GSH循环活动增强。但在微藻上AsA-GSH循环的活动还未见报道,虽然B[α]P对海洋自养生物的毒性已有不少报道,但这些生物在B[α]P胁迫期间AsA-GSH相关成分的变化情况也仍属未知。
本实验以三角褐指藻(Phaeodactylumtricornutum)为材料,在比较苯并[α]芘对三角褐指藻生长、脂质过氧化及抗氧化水平影响的基础上,同时分析B[α]P胁迫下藻细胞内AsA-GSH循环非酶成分含量及相关酶活性的变化,以期了解三角褐指藻AsA-GSH循环在清除体内H2O2的可能作用,为探讨三角褐指藻对B[α]P等有机毒物的解毒机制提供依据。
1 材料与方法
1.1 藻种和培养条件
实验以中国海洋大学微藻种质库三角褐指藻为实验材料。三角褐指藻培养基为f/2培养基,250mL锥形瓶培养,培养基体积200mL,三角褐指藻起始细胞浓度5×105个/mL,培养温度为20℃,光照强度为冷荧光灯30μmol·m-2·s-1,光∶暗比为13∶11[17-18]。
1.2 实验梯度设置
实验所用B[α]P为Dr. Ehrenstorfer GmbH公司产品,纯度为99.6%。使用二甲基亚砜(DMSO)作为助溶剂,制成B[α]P储备液,储备液在海水中的最大溶解度为10mg/L。经预实验,0.01%的DMSO对三角褐指藻的生长没有显著抑制效应,实验中三角褐指藻培养液中DMSO浓度小于0.01%。
实验B[α]P浓度设置根据实验中三角褐指藻的IC50,并结合在另一种海洋硅藻假微型海链藻[19]上的研究,设置B[a]P的3个浓度梯度为100、400、700μg/L,每个浓度处理设置3个平行,连续处理96h。本实验以B[α]P浓度与处理时间的乘积作为B[α]P的胁迫强度。
1.3 藻密度变化及抑制率的测定
在暴露处理过程中,每24h取1mL培养液,在显微镜(Nikon HFXⅡ)下用血球计数板统计三角褐指藻细胞密度,基于细胞密度的变化,与对照组相比按如下公式计算百分抑制率(ASTM):
I=(C-X)/C×100%。
式中:I为百分抑制率;C为对照组藻细胞数目;X为处理组藻细胞数目。
1.4 主要生理生化指标的测定
1.4.1 脂质过氧化水平的测定 脂质过氧化水平以测定次级氧化产物MDA含量的方法来反映。MDA含量测定根据Wills[20]的方法稍加改进。单位为nmol·mg-1prot-1。
1.4.2 总抗氧化能力的测定 使用TAOC分析试剂盒(南京建成生物工程研究所,南京)测定总抗氧化能力,单位为U/mg prot。
1.4.3 抗坏血酸和还原型谷胱甘肽含量测定 抗坏血酸含量测定方法参照Kampfenkel等[21]的方法并稍作改进。AsA含量单位为mmol/g鲜重。GSH含量的测定参照Anderson[22]的方法。GSH含量单位为mmol/g鲜重。
1.4.4 抗坏血酸-谷胱甘肽循环酶活测定 参照Ma等[23]和Knorzer等[24]所描述的方法提取抗氧化酶液。随后分别测定相关酶活性。其中,抗坏血酸过氧化物酶(APX,EC1.11.1.11)活性根据Nakano和AsAda[25]所描述的方法测定。以μmolAsA ·min-1·mg-1prot-1表示APX活性。单脱氢抗坏血酸还原酶(MDAR,EC1.6.5.4)活性根据Miyake和AsAda[26]所述的方法进行测定。以μmolNADH·min-1·mg-1prot-1表示MDAR活性。脱氢抗坏血酸还原酶(DHAR,EC1.8.5.1)活性根据Dalton等[27]所述的方法进行测定。以nmolAsA·min-1·mg-1prot-1表示DHAR活性。谷胱甘肽还原酶(GR,EC1.6.4.2)活性根据Grace和Logan[28]所述的方法进行测定。以nmolNADPH·min-1·mg-1prot-1表示GR活性。总的可溶性蛋白浓度测定依据Bradford[29]的方法并稍作改进,使用牛血清蛋白作为标准蛋白,根据标准曲线求得蛋白含量。
1.5 数据统计分析
所有数据均以3个平行组数据的平均值±标准差(Mean±S.D.)表示, 采用SPSS 17.0 软件进行单因素方差分析(ANOVA)、Duncan 检验法及Pearson相关性分析,置信度0.05,差异显著用不同字母表示。
2 结果与分析
2.1 B[α]P对三角褐指藻生长的影响
基于B[α]P对三角褐指藻的毒性,本试验设置的B[α]P胁迫浓度均属于亚致死浓度。结果如图1所示,试验期间3个处理组微藻细胞密度均呈连续增加状态,但与对照相比,B[α]P处理仅24h,高浓度400和700μg/L组三角褐指藻生长较对照组受到明显抑制,48h后,低浓度100μg/L组三角褐指藻生长也受到明显抑制。胁迫至96h,3个处理组三角褐指藻生长均有所恢复,3个处理组96h抑制率从低浓度组到高浓度组依次为16.7%、41.4%和43.1%。

图1 三角褐指藻在不同浓度B[α]P 胁迫下的生长曲线Fig.1 Growth curves of Phaeodactylum tricornutum in different concentration of B[α]P
2.2 B[α]P对三角褐指藻脂质过氧化水平及抗氧化能力的影响
与各处理组微藻生长相对应,三角褐指藻体内的MDA含量随着处理浓度的增大及处理时间的延长而逐渐增高(见图2A),如B[α]P胁迫48h,100μg/L处理组微藻MDA含量一直未显著增高,400和700μg/L处理组藻细胞的MDA的含量均显著高于对照,700μg/L处理组MDA含量则显著高于400μg/L处理组。胁迫72h,3个处理组微藻MDA含量均显著高于对照,其中700μg/L处理组MDA 含量仍显著高于100μg/L和400μg/L处理组。胁迫延至96h,100μg/L组微藻MDA含量虽较72h有所降低,仍显著高于对照组水平,但显著低于400μg/L组和700μg/L组。结果表明,B[α]P处理与三角褐指藻细胞MDA含量存在明显的时间-剂量效应。相关分析表明,B[α]P胁迫强度与藻细胞体内MDA含量相关性系数为0.96,相关性显著(P<0.05),这说明B[α]P胁迫是藻细胞膜脂过氧化水平增加的直接原因。
3个处理组三角褐指藻TAOC的分析显示(见图2B),与藻细胞MDA含量的变化相似,胁迫48h内,随着处理时间的延长,400和700μg/L处理组微藻抗氧化能力逐渐增强。胁迫72h,100μg/L组微藻的抗氧化能力也显著高于对照,但低于400和700μg/L处理组。胁迫至96h,3个处理组微藻的TAOC均显著高于对照组,各处理组间的TAOC也随着B[α]P处理浓度的升高而呈显著增高,此时,700μg/L处理组微藻总抗氧化水平达最高水平,为对照组的167%。相关分析表明,三角褐指藻体内的总抗氧化能力与苯并芘胁迫强度及细胞内的MDA含量的相关性系数均为0.89,相关性显著(P<0.05)

图2 三个浓度苯B[α]P处理三角褐指藻MDA含量、TAOC水平变化
2.3 B[α]P暴露期间三角褐指藻抗坏血酸和谷胱甘肽含量的变化情况
作为微藻抗氧化能力的一部分,B[α]P处理过程中,三角褐指藻内AsA含量变化明显(见图3b),仅胁迫24h,400和700μg/L处理组AsA含量已分别是对照组水平的133%和154%,均显著高于对照。胁迫48h, 100μg/L组微藻AsA含量也达对照组的147%,而此时,700μg/L组抗坏血酸含量已达到峰值,为对照的179%,显著高于100和400μg/L处理组。胁迫至72h,400μg/L处理组被进一步诱导而显著高于其它处理组,而100μg/L组抗坏血酸含量已与对照组水平相当,700μg/L组三角褐指藻的抗坏血酸含量也有所降低,但仍高于对照组水平。结果显示,AsA含量对B[α]P胁迫相当敏感,但相关分析表明,AsA含量与胁迫强度、细胞内MDA含量和总抗氧化能力相关系数分别为0.325、0.200、0.233,均无显著的相关。
与AsA含量的变化不同,胁迫24h,3个处理组微藻的GSH含量与对照组均无显著变化(见图3a)。胁迫至48和72h,2个高浓度处理组微藻GSH含量均显著高于对照,100μg/L组仍与对照组无显著不同。胁迫延长至96h,100和700μg/L处理组微藻的GSH含量与72h时相应组的含量相似,400μg/L组GSH含量则被诱导而显著高于所有处理组,此时,该处理组微藻GSH含量为对照组的155%。相关分析表明,微藻体内的GSH含量与B[α]P胁迫强度、体内MDA含量和抗氧化能力的相关系数分别为0.68、0.74和0.70(P<0.05),均为显著相关。
2.4 B[α]P暴露对三角褐指藻抗坏血酸-谷胱甘肽循环相关酶活力的影响
2.4.1 APX活性变化 三角褐指藻APX活性对B[α]P处理相当敏感(见图4a),处理24h,3个处理组APX活性即被显著诱导,诱导效应与B[α]P浓度直接有关,400和700μg/L组的APX活性显著高于100μg/L处理组。处理72h,700μg/L组APX活性已比对照组升高了33%,各处理组间APX的活性随B[α]P处理浓度的升高而增高,并均达显著水平。进一步处理至96h,100μg/L组APX活性降低至对照组水平,700μg/L组APX活性也有所降低,与400μg/L组APX活性水平相似,仍均显著高于对照组。相关分析表明,微藻APX活性与B[α]P胁迫强度、MDA含量和总抗氧化能力相关性系数分别为0.70、0.65和0.54(P<0.05),达显著相关水平。
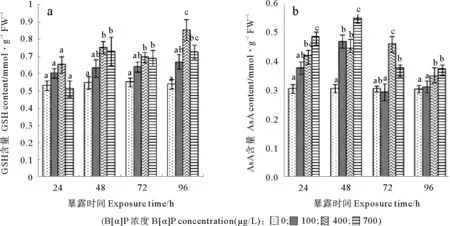
图3 三个浓度B[α]P处理三角褐指藻AsA含量、GSH含量变化

图4 三种浓度苯并[α]芘处理三角褐指藻APX、MDAR、DHAR及GR活性变化Fig.4 The effect of BaP in three content on APX,MDAR,DHAR,GR activity of Phaeodactylum tricornutum
2.4.2 MDAR活性变化 MDAR活性变化(见图4b),处理24h,虽然3个处理组MDAR活性均被诱导增高,但只有400μg/L组的MDAR活性与对照有显著差异。处理至48h,3个处理组MDAR活性均显著高于对照,此时,400和700μg/L组MDAR活性分别较对照组提高了44%和42%,显著高于100μg/L处理组。随后3个处理组的MDAR活性均呈现下降趋势,72h时400μg/L组的MDAR活性仍显著高于对照,至96h,3个处理组均与对照无显著差异。相关分析表明,MDAR活性与B[α]P胁迫强度、MDA含量和总抗氧化能力分别为0.099、0.015、0.104,均无显著相关。
2.4.3 DHAR活性的变化 如图4c所示,B[α]P处理24h,高浓度700μg/L处理组DHAR活性被诱导,其活性是对照组的142%,其余2个处理组DHAR活性虽有增高,但与对照均无显著差异。48h时,400μg/L组DHAR活力也迅速升高,达对照组的135%,700μg/L处理组DHAR活性有所下降,显著低于400μg/L组。处理72h后,100μg/L组DHAR活性也显著高于对照,但仍显著低于其它2个处理组。持续处理96h, 3个处理组DHAR活性均显著高于对照,处理组间DHAR活性随着B[α]P处理浓度的增高而显著升高。相关分析表明,DHAR活性与B[α]P胁迫强度、藻细胞MDA含量和总抗氧化能力相关性系数为0.68、0.60和0.63(P<0.05),达显著相关水平。
2.4.4 GR活性的变化 如图4d所示,处理24h,3个处理组的GR活性即显著高于对照,B[α]P处理浓度越高,微藻的GR活性被诱导得越高。随着处理时间延长,各处理组GR活性被进一步诱导,组间GR活性也随B[α]P处理浓度的升高而显著增高。至72h,400μg/L组的GR活性达峰值,而700μg/L组的GR活性仍继续升高至处理96h时达最高。相关分析表明,GR活性与B[α]P胁迫强度、细胞内MDA含量和总抗氧化能力的相关性系数为0.89、0.85和0.93(P<0.05),均具有极高的相关性。
3 讨论
AsA-GSH循环也称作Halliwell-AsAda循环,该循环的非酶成分为3个氧化还原对,即还原型和氧化型的抗坏血酸(AsA/DHA)、还原型和氧化型的谷胱甘肽(GSH / GSSG)以及还原型和氧化型的烟酰胺腺嘌呤二核苷酸磷酸(NADPH / NADP+),4种相关酶为,消耗AsA用以还原H2O2的抗坏血酸过氧化物酶(APX)、合成AsA的单脱氢抗坏血酸还原酶(MDAR)和脱氢抗坏血酸还原酶(DHAR)以及生成GSH的GR。从抗氧化的角度来看,APX是直接的效应酶,其它3个酶与形成AsA或GSH有关。AsA是许多酶促反应或氧化还原反应的电子提供者,能直接猝灭超氧负离子和羟基自由基,也能够再生α-生育酚来保护膜系统,降低膜脂过氧化的危害[30]。GSH存在于几乎所有的细胞原件,因为其参与AsA-GSH循环、维持巯基(-SH)稳定以及作为GSTs底物[31],被视为细胞内对ROS引起的氧化损伤具有防御功能的关键物质。
已有研究显示,随着细胞内氧化胁迫加剧,膜脂过氧化程度增高,与AsA-GSH循环相关的非酶成分含量及相关酶活性多被诱导增高,如Nath等用砷胁迫水稻,发现根组织H2O2、MDA、 AsA和GSH含量普遍升高[32]。Zezulka等发现荧蒽可导致浮萍MDA含量升高,与此同时,浮萍的抗氧化水平呈诱导升高状态,APX活性也受诱导而增强[16]。Anjum等发现Cd胁迫30d的绿豆内AsA-GSH循环的相关酶如GR、MDAR、DHAR活性均显著增高[8]。Saher等研究发现康乃馨内MDA和过氧化物水平明显增高时,APX、DHAR、MDAR、GR活性均被诱导增强[11]。另外在Cd胁迫的金鱼藻[9],H2O2预处理的栽培稻种子[33],以及盐度胁迫的鱼腥藻内[34]均发现这些胁迫导致APX活性增强,可对持续性的胁迫起到一定的拮抗作用。也有些研究发现,在发生细胞氧化胁迫时,AsA-GSH循环相关成分的变化有时候并不完全一致,如Chakrabarty等在苹果上的分析发现,氧化胁迫导致APX、MDAR和GR酶活性增强时,而DHAR活性并未出现诱导增强[12]。Abhay用铅胁迫Talinumtriangulare,结果发现其AsA和GSH含量较对照组明显降低[35]。Talaat发现高盐胁迫导致菜豆生长抑制,此时菜豆体内GSH和AsA含量以及抗氧化酶活性也均低于对照组[36]。Shu等研究发现,盐度胁迫导致黄瓜体内AsA及GSH含量降低,APX、DHAR和GR活性降低,而MDAR活性却升高了[15]。
作者曾同时比较了B[α]P对7种海洋微藻的毒性,结果显示三角褐指藻对B[α]P有相当高的耐受性[37]。本研究采用3个较低浓度的B[α]P处理三角褐指藻,旨在分析B[α]P导致三角褐指藻发生氧化性胁迫时,细胞内AsA-GSH循环相关成分的变化情况。结果显示,本研究设计的3个处理浓度比较合适,试验期间,各处理组随着处理浓度的升高及处理时间的延长,藻细胞生长随之表现不同程度的抑制,细胞内MDA含量及总抗氧化能力显著增加,二者与B[α]P胁迫强度的相关性系数分别为0.96和0.89,均呈高度相关关系。
在藻细胞膜脂过氧化水平增高及总抗氧化能力被诱导时,三角褐指藻细胞内AsA-GSH循环的非酶成分含量增加,相关酶活均被显著诱导,其中GR活性和GSH含量与体内MDA含量及总抗氧化能力、APX活性与体内MDA含量、DHAR活性与体内总抗氧化能力的相关性分别达到极显著相关水平,APX活性与体内总抗氧化能力及DHAR活性与体内MDA含量分别达到显著相关水平。虽然AsA含量及MDAR活性与膜脂过氧化程度及总抗氧化能力的相关性均未达显著水平,但AsA对B[α]P胁迫相当敏感,含量的变化幅度最大,MDAR活性也随着B[α]P胁迫强度的增大而呈现显著的涨落。结果说明,AsA-GSH循环是三角褐指藻抵抗B[α]P胁迫、降低膜脂过氧化程度的重要方式。
相关性分析还显示,三角褐指藻细胞AsA含量与MDAR活性的相关性最高,与DHAR活性及APX活性的相关性也达极显著水平。APX活性增高,说明AsA的消耗在增加。MDAR和DHAR均参与AsA的合成,这2种酶活性的增高,表明AsA形成能力增强。MDAR和DHAR活性与AsA含量的相关性存在一定差异,似乎说明B[α]P胁迫期间,三角褐指藻内MDAR形成AsA的作用有所上升。GSH含量只与循环内GR活性显著相关而非高度相关,似乎表明,尽管GR参与GSH的生成,但由于GSH在细胞内的功能比较丰富,其合成及消耗的方式也可能相当复杂,GSH含量并不只与GR活性有关。
进一步比较AsA-GSH循环各成分在B[α]P胁迫时的变化情况,结果显示,对B[α]P胁迫快速做出变化的组分有AsA含量、GR活性和APX活性,而GSH含量、DHAR活性及MDAR活性的变化则是在B[α]P胁迫强度进一步增高时才被诱导增强,如AsA含量,仅胁迫24h, 400和700μg/L处理组AsA含量已显著高于对照,胁迫48h, 100μg/L处理组AsA含量即达对照组的147%。而GSH含量,胁迫至48h,400和700μg/L处理组GSH含量才显著高于对照, 100μg/L处理组的GSH含量一直与对照无显著差异。这说明三角褐指藻AsA-GSH循环不同成分对B[α]P胁迫的反应存在明显不同。相对而言, AsA含量、GR活性及APX活性对B[α]P胁迫的反应更为快速,可作为生物指示物用于生态环境安全的评价。
[1] IARC. Monographs on the Evaluation of Carcinogenic Risk of Chemicals to Man: Polycyclic Aromatic Hydrocarbons [M]. Lyon: IARC, 1983: 211-224.
[2] Straif K, Baan R, Grosse Y, et al. Carcinogenicity of polycyclic aromatic hydrocarbons [J]. Lancet Oncol, 2005, 6(12): 931-932.
[3] Huang L X, Zuo Z H, Zhang Y Y, et al. Use of toxicogenomics to predict the potential toxic effect of Benzo(a)pyrene on zebrafish embryos: Ocular developmental toxicity [J]. Chemosphere, 2014, 108: 55-61.
[4] Ren X Y, Pan L Q, Wang L. Metabolic enzyme activities, metabolism-related genes expression and bioaccumulation in juvenile white shrimpLitopenaeusvannameiexposed to benzo[a]pyrene [J]. Ecotoxicology and Environmental Safety, 2014, 104: 79-86.
[5] 潘鲁青, 刘娜, 王静. 栉孔扇贝B[α]P胁迫下生物标志物筛选的研究 [J]. 水生生物学报, 2009, 36(2): 299-306.
[6] Carvalho R N, Burchardt A D, Sena F, et al. Gene biomarkers in diatomThalassiosirapseudonanaexposed to polycyclic aromatic hydrocarbons from contaminated marine surface sediments [J]. Aquatic Toxicology, 2011, 101(1): 244-253.
[7] Noctor G, Foyer, C H. Ascorbate and Glutathione: keeping active oxygen under control [J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1998, 49: 249-279.
[8] Anjum N A, Umar S, Iqbal M, et al. Cadmium causes oxidative stress in mung bean by affecting the antioxidant enzyme system and ascorbate-glutathione cycle metabolism [J]. Russian Journal of Plant Physiology, 2011, 58(1): 92-99.
[9] Arvind P, Prasad MNV. Zinc alleviates cadmium-induced oxidative stress in Ceratophyllum demersum L: a free-floating freshwater macrophyte [J]. Plant Physiology and Biochemistry, 2003, 41(4): 391-397.
[10] Kang G Z, Li G Z, Liu G Q, et al. Exogenous salicylic acid enhances wheat drought tolerance by influence on the expression of genes related to ascorbate-glutathione cycle [J]. Biologia Plantarum, 2013, 57(4): 718-724.
[11] Saher S, Piqueras A, Hellin E, et al. Hyperhydricity in micropropagated carnation shoots: the role of oxidative stress [J]. Physiologia Plantarum, 2004, 120(1): 152-161.
[12] Chakrabarty D, Park S Y, Ali M B, et al. Hyperhydricity in apple ultrastuctural and physiological aspects [J]. Tree Physiology, 2005, 26(3): 377-388.
[13] Singh V P, Srivastava P K, Prasad S M. Differential effect of UV-B radiation on growth, oxidative stress and ascorbate-glutathione cycle in two cyanobacteria under copper toxicity [J]. Plant Physiology and Biochemistry, 2012, 61: 61-70.
[14] Rehman R U, Zia M, Abbasi B H, et al. Ascorbic Acid and Salicylic Acid Mitigate NaCl Stress in Caralluma tuberculata Calli [J]. Applied Biochemis try and Biotechnology, 2014, 173(4): 968-979.
[15] Shu S, Yuan L Y, Guo S R, et al. Effects of exogenous spermine on chlorophyll fluorescence, antioxidant system and ultrastructure of chloroplasts inCucumissativusL. under salt stress [J]. Plant Physiology and Biochemistry, 2012, 63: 209-216.
[16] Zezulka S, Kummerova M, Petr Babula, et al. Lemna minor exposed to fluoranthene: Growth, biochemical,physiological and histochemical chan ges [J]. Aquatic Toxicology, 2013, 140: 37- 47.
[17] Huang A Y, He L W, Wang G C. Identification and characterization of microRNAs fromPhaeodactylumtricornutumby highthroughput sequencing and bioinformatics analysis [J]. BMC Genomics, 2011, 12: 337.
[18] Sapriel G, Quinet M, Heijde M, et al. Genome-Wide Transcriptome Analyses of Silicon Metabolism inPhaeodactylumtricornutumReveal the Multilevel Regulation of Silicic Acid Transporters [J]. Plos One, 2009, 4(10): e7458.
[19] Bopp S K, Lettieri T. Gene regulation in the marine diatomThalassiosirapseudonanaupon exposure to polycyclic aromatic hydrocarbons (PAHs) [J]. GENE, 2007, 396(2): 293-302.
[20] Wills E D, Snell K, Mullock B. Evaluation of iipid perocidation in lipids and biological membranes. biochemical toxicology: a practical approach [M]. Wa shington: IRL Press, 1987: 127-152.
[21] KamPfenkel K, VanMontagu M, Inze D, et al. Extraction and determination of ascorbate and dehydroascorbate from Plant Tissue [J]. Analytical Biochemistry, 1995, 225(1): 165-167.
[22] Anderson M E. Determination of glutathione and glutathione disulfide in biological samples [J]. Methods Enzymol, 1985, 113: 548-550.
[23] Ma F W, Cheng L L. Exposure of the shaded side of apple fruit to full sun leads to up-regulation of both the xanthophylls cycle and the ascorbate-glutathioneeycle [J]. HortScience, 2004, 39(4): 887-887.
[24] Knorzer O C, Burner J, Boger P. Alterations in the antioxidative system of suspension-cultured soybean cells(Glycinemax)induced by oxidative stress [J]. Physiol Planlarum, 1996, 97(2): 388-396.
[25] Nakano Y, AsAda K. Hydrogen peroxide is scavenged by ascorbate-specifie peroxidase in spinach chloroplasts [J]. Plant Cell Physiol, 1981, 22: 867-880.
[26] Miyake C, AsAda K. Thylakoid-bound ascorbate peroxidase in spinach chloroplasts and photoreduction of its primary oxidation product monodehydroascorbate radicals in thylakoids [J]. Planl Cell Physiol, 1992, 33(5): 541-553.
[27] Dalton D A, Russell S A, Hanus F J, et al. Enzymatie recetions of ascothate and glutathione that prevent peroxide damage in soybean root nodules [J]. Proc Natl Acad Sci USA, 1986, 83: 3811-3815.
[28] Grace S C, Logan B A. Acclimation of foliar antioxidant systems to growth irradiance in three broad-leaved evergreen species [J]. Plant Physiol, 1996, 112(4): 1631-1640.
[29] Bradford M M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein dye binding [J]. Biochem, 1976, 72: 248-254.
[30] Gill S S, Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants [J]. Plant Physiology and Biochemistry, 2010, 48(12): 909-930.
[31] Madhavarao K V, Raghavendra A S, Reddy K J. Photooxidative stress. in: Physiology and Molecular Biology of Stress Tolerance in Plants [M]. The Netherlands: Springer, 2006: 157-186.
[32] Nath S, Panda P, Mishra S, et al. Arsenic stress in rice: Redox consequences and regulation by iron [J]. Plant Physiology and Biochemistry, 2014, 80: 203-210.
[33] Hsu Y T, Kao C H. Heat shock-mediated H2O2accumulation and protection against Cd toxicity in rice seedlings [J]. Plant And Soil, 2007, 300(1): 137-147.
[34] Srivastava A K, Bhargava P, Rai L C. Salinity and copper-induced oxidative damage and changes in antioxidative defense system ofAnabaenadoliolum[J]. World Journal of Microbiology and Biotechnology, 2005, 21(6): 1291-1298.
[35] Kumar A, Majeti N V P. Proteomic responses to lead-induced oxidative stress inTalinumtriangulareJacq. (Willd. ) roots: identification of key biomarkers related to glutathione metabolisms [J]. Environmental Science and Pollution Research, 2014, 21(14): 8750-8764.
[36] Talaat N B. Effective microorganisms enhance the scavenging capacity of the ascorbate-glutathione cycle in common bean (PhaseolusvulgarisL. ) plants grown in salty soils [J]. Plant Physiology and Biochemistry, 2014, 80: 136-143.
[37] 沈忱, 李赟, 潘鲁青. 苯并[α]芘对海洋微藻生长及细胞特征的影响 [J]. 海洋环境科学, 2012, 31(4): 511-514.
责任编辑 朱宝象
Effect of Benzo [α] Pyrene on the Ascorbate-Glutathione Cycle ofPhaeodactylumtricornutum
NIU Xiao, LI Yun, PAN Lu-Qing
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
In order to investigate the toxic effect of benzo [α] pyrene (B[α]P) onPhaeodactylumtricornutumand understand the variation of the ascorbate-glutathione cycle of the microalgal cells during B[α]P stress, the culture ofP.tricornutumwas exposed to three doses of B[α]P for different times (24, 48, 72 and 96 h) with the level of total antioxidant capacity (TAOC) , the activity of associating enzymes and the content of including malondialdehyde (MDA), ascorbate (AsA) and glutathione (GSH) determined. The results showed that the growth ofP.tricornutumwas seriously inhibited by B[α]P, while the content of MDA and the level of total antioxidant capacity(TAOC) increased significantly. The correlation of content of MDA and the level of TAOC with stress strength of B[α]P was 0.960 and 0.894, respectively. The content of AsA and GSH increased, and the activity of enzymes including glutathione reductase (GR), ascorbate peroxidase (APX), dehydroascorbate reductase (DHAR) and monodehydroascorbate reductase (MDAR) was all induced significantly. The correlation of the content of MDA with the activity of GR, APX, DHAR and the content of GSH was 0.744, 0.852, 0.652 and 0.600, respectively, which indicated that the ascorbate-glutathione cycle inP.tricornutumhas important protection function by scavenging reactive oxygen species to reduce lipid peroxidation from B[α]P stress. The activity of GR, APX and the content of AsA could be considered as microalgal sensitive biological indicator for further study because of their quick and significantly response to B[α]P stress.
Phaeodactylumtricornutum; B[α]P stress; AsA-GSH cycle
国家海洋局海洋公益项目(201105013-3)资助
2014-10-08;
2015-01-15
牛 晓(1988-), 男, 硕士生。E-mail: yaorinumber1@126.com
❋❋通讯作者: E-mail: sxsdlwl@ouc.edu.cn
Q945.78
A
1672-5174(2015)12-030-08
10.16441/j.cnki.hdxb.20140315
