缺氮培养条件对胶球藻C-169油脂积累及其脂肪酸组成的影响❋
2015-03-31曹晓菲张晓舟张学成
徐 涤, 曹晓菲, 张晓舟, 张学成
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,海洋生命学院,山东 青岛 266003)
缺氮培养条件对胶球藻C-169油脂积累
及其脂肪酸组成的影响❋
徐 涤, 曹晓菲, 张晓舟, 张学成
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,海洋生命学院,山东 青岛 266003)
随着石油资源短缺的加剧,利用微藻生产生物柴油获得了全世界范围的关注,其中筛选高含油藻种是微藻能源产业的基本环节。本文研究了缺氮培养对胶球藻C-169在生长速率、油脂含量以及脂肪酸组成等方面的影响,结果显示,氮缺乏条件下,C-169从第3天开始生长速率明显低于正常培养组,10 d后细胞密度维持在大约1.6×107cells/mL,为初始细胞密度的约33倍。而根据尼罗红荧光显微观察其在培养的第12天油脂积累达到最高,此时总脂中脂肪酸的含量由开始的0.089ng/1 000cells增长到1.135ng/1 000 cells,而三酰甘油(TAG)占总脂比例达到的74.6%,其中以C16或C18饱和或单不饱和脂肪酸为主,其中油酸(18:1)的量占据了中性脂TAG的一半以上,符合生产高品质生物柴油的要求。关键词:胶球藻C-169;缺氮;油脂积累;脂肪酸组成
随着石化柴油资源短缺问题的日益加剧,能源问题已成为世界各国共同关注的焦点,开发可再生的和清洁的能源成为当今世界的研究热点[1-2]。生物柴油作为具有优良的环保性、润滑性、低温起动性及可再生性的清洁能源,因其优越的性能引起了世界范围内的高度关注[3-4]。
微藻种类繁多、分布广,可直接利用阳光、CO2及N、P 等简单营养物质快速生长并在胞内合成大量油脂 (主要是甘油三酯),并可用非农林业耕地和水源大规模培养,因而受到广泛重视[5-7]。很早研究者就发现微藻产生的油脂通过酯化反应后可转变为生物柴油,利用微藻产油在技术上可行,然而到目前为止高成本仍然是制约微藻能源产业发展的瓶颈[6,8-9],产业化开发缺乏坚实的理论基础和关键技术支撑[10],因此持续选育高油藻株,深入研究其油脂代谢途径及其调控等都是目前所亟需的。
胶球藻(Coccomyxasp.)C-169是一种非运动型的单细胞绿藻,属于绿藻门,共球藻纲(Trebouxiophyceae),与小球藻(Chlorella)亲缘关系接近。实际上C-169最初被划归于小球藻属,后来才确立为胶球藻。该藻于1959 年首次从南极的地衣中分离获得[11],是适应极端环境的一个代表物种[12-13],也是第一个完成基因组测序的极地真核藻种[14]。
微藻细胞在适宜的生长条件下其脂肪酸主要用于合成膜脂等结构脂类,而在环境胁迫下,尤其是营养盐的缺乏等则会导致其用于合成高能的储存物质,如三酰甘油(triacylglycerol, TAG)等[15-17]。许多研究表明,培养基中的氮浓度是影响微藻生化成分的最主要因素,因此缺氮培养经常用于诱导提高微藻的油脂含量[16,18-21]。研究还发现在光合自养时补充CO2可以显著提高C-169的生物量或者油脂积累,而且其细胞壁薄而易于酶解,这些特性使C-169的藻油易于提取[22]。
本文研究了进行光合自养的胶球藻C-169在缺氮条件下的生长和油脂积累情况,分析其油脂的脂肪酸组成和含量的变化,探讨C-169作为能源微藻藻种的可行性。
1 材料与方法
1.1 藻种及其培养
胶球藻Coccomyxasp. C-169由本实验室保存。培养基为Bold’s basal(BBM)培养基[23]。实验所采用的培养条件为光照振荡培养,培养温度为(23±1)℃,振荡速率为200 r/min,光照强度为180 μmol·m-2·s-1,光周期为12 L/12 D。
1.2 缺氮培养对C-169生长的影响
将Coccomyxasp. C-169预培养至对数生长中期后,离心收集藻细胞(3 500r/min,5min),分别以正常的BBM培养基(BBM+N)和氮源缺失的BBM培养基(BBM-N)重悬,使初始藻细胞密度都约为0.5×106cells/mL,同上培养条件下培养12d,每组设置3个平行样。每天取样以血球计数板进行计数,计算藻液浓度绘制生长曲线。
1.3 尼罗红染色显微观察缺氮培养对C-169油脂积累的影响
同上方法分别以BBM+N培养基和BBM-N培养基重悬处于对数生长中期的藻细胞,使其初始密度约为0.5×106cells/mL,培养12d,每组设置3个平行样。其中根据预实验结果,正常BBM培养基培养至第6天后也会有轻微的油滴积累,因此在第6天时将BBM+N组更新培养基。
每天定时取样进行尼罗红(Nile Red)染色观察[24-25]:每个样品的藻细胞数为(1~3)×106cells,离心收集后重悬在370μL BBM培养基中,加入125μL DMSO和1μL尼罗红储存液(1mg尼罗红粉末溶解于4mL DMSO中),37℃温浴15min后用荧光显微镜进行观察(Olympus,FV500),激发光波长443nm,油镜下利用560~590nm带通滤波进行尼罗红荧光的观察。整个过程要以铝箔包裹以避光。
1.4 藻细胞的油脂和脂肪酸分析
同上方法分别以BBM+N培养基和BBM-N培养基重悬处于对数生长中期的藻细胞,使其初始密度约为2×107cells/mL,培养12d,每组设置3个平行样,根据尼罗红染色对C-169油滴积累的观察结果,将油脂分析的取样时间定为第4、5、6、11和12天,培养基进行重悬时的藻细胞样品作为对照(第0天),整个实验重复2次。
使用螺口玻璃管(13×100mm)离心收集约~ 1.5×108个藻细胞,抽吸去除培养基后,加入 300μg的十七烷酸甘油三酯(C17∶0)(储存液为浓度10mg/mL的甲苯溶液)作为内标。
总脂的提取按照Bligh 和 Dyer[26]的方法:将3 mL含0.01%(w/v)二丁基羟基甲苯的甲醇∶氯仿(2∶1,v/v)加入到藻细胞后25 ℃温育30min,加入1mL氯仿和1.8mL水,剧烈震荡混匀,离心1000×g后弃去上层相,将含有油脂的下层有机相转移到新的玻璃管中。提取的油脂在氮气气流中干燥后重悬于0.5mL 氯仿∶甲醇(6∶1, v/v)中。该提取物的1/4将被用于总脂肪酸成分分析,其余用于TAG分析。
藻细胞总脂的脂肪酸含量和组分检测根据Cahoon 等[27]的方法,将脂肪酸转化为脂肪酸甲酯(FAMEs)后采用 GC-FID (气相色谱-氢火焰离子化检测法)进行定量分析,具体如下:取125μL上述提取物转移至新的螺口玻璃管中,氮气干燥后重悬于250μL甲苯和1 mL硫酸甲醇溶液(2.5%, v/v)中,通氮气条件下加盖,90℃加热30min;冷却过程中加入0.5 mL H2O和0.7mL庚烷,剧烈振荡后离心,上层相为庚烷层,含有FAMEs;使用配备Agilent INNOWax 层析柱 (内径0.25cm,长30cm)的Agilent 7890气相色谱仪进行分析,以氢气作为载气,程序升温(初始柱温185℃保持1min,以 7 ℃/min升高到 235℃保持 2.5min),脂肪酸甲酯的水平根据内标十七烷酸甲酯进行相对量化,脂肪酸甲酯种类的鉴定根据GC-MS气-质联用(Agilent 7890A气相色谱仪,Agilent 5975C质谱仪)中其与标准品的相对迁移速率进行计算,除了使用氦气作为载气外,其余色谱条件与上述相同。
剩余的总脂提取物进行TAG分析:在氮气中干燥后提取物重悬于100μL氯仿∶甲醇(6∶1, v/v)溶液,然后进行硅胶60薄层层析(Sigma-Aldrich公司),溶剂为庚烷∶乙醚∶醋酸(70∶30∶1, v/v/v);碘蒸汽轻微染色,根据与TAG标准品共迁移速率确定TAG条带;从层析板回收TAG组分,重溶于0.4mL甲苯和1.5mL硫酸甲醇溶液( 2.5%, v/v)中。TAG中FAMEs的色谱分析方法同上。
不饱和脂肪酸的双键位置由脂肪酸甲酯衍生物的GC-MS分析结果确定:多不饱和脂肪酸的双键位置由其吡咯烷衍生物进行分析[28],单不饱和脂肪酸的双键位置由其二甲基二硫醚衍生物进行分析[29]。所用GC-MS仪同上,层析柱为DB-1MS(Agilent,长30cm,内径0.25mm,膜厚度为0.25μm)。程序升温条件为:初始柱温185℃保持1min,以 10℃/min升高到 320℃保持 10min。
2 结果与讨论
2.1 缺氮培养对C-169生长的影响
图1为C-169分别在光合自养的正常培养和缺氮培养条件下的生长情况(接种密度为0.5×106cells/mL)。如图所示,C-169在正常培养条件下(BBM+N)前2天生长缓慢,第3天进入指数生长期,至第12天密度达到4.03×107cells/mL。根据预实验结果,C-169在此培养条件下第13天后生长速率下降,约18~19d后进入平台期,细胞密度可达约5.5×107cells/mL(结果未显示)。而在缺氮(BBM-N)培养基中,C-169前2天生长较快,甚至快于BBM+N组,这个结果与海洋栅藻中的类似[21],推测缺氮条件刺激其产生某种应激反应从而暂时加速了细胞分裂。从第3天开始BBM-N组的生长速率降低,至第10天起细胞密度维持在大约1.6×107cells/mL。
从结果可见,胶球藻C-169是生长速率较高的藻种,最终达到的细胞密度与小球藻相当,因此具有进行大规模培养的潜力。C-169在BBM+N培养基中最终细胞密度约为初始细胞密度的80倍,而在BBM-N培养基中也有约33倍,远高于如衣藻等绿藻[20],有可能C-169对氮源的需求较低,因此在缺氮培养下还可以相对维持更长时间的生长。

图1 C-169在正常和缺氮培养条件下的生长比较
2.2 尼罗红染色显微观察缺氮培养对C-169油脂积累的影响
尼罗红染色剂是一种亲脂性的恶嗪类荧光染料, 能进入细胞与胞内中性脂结合并发出荧光检测信号, 其强度与细胞的中性脂含量呈线性关系[30],因此可以利用尼罗红染色对微藻油脂的积累量进行即时的显微观察。
图2为尼罗红染色后在荧光显微镜下所显示出的藻细胞中油滴的大小及其荧光强度。从图中可以看出,培养初期对照组(BBM+N)和缺氮组(BBM-N)的C-169藻细胞中均没有油滴的形成;而随着培养时间的增加,对照组由于保持充足的氮源因此直到实验结束也未见油滴生成,而缺氮组从第4天开始细胞内明显开始发生变化,在细胞周边开始出现微小的荧光颗粒,到第5~6天已经非常明显是较小的油滴颗粒,之后细胞内油脂逐渐积累,油滴颗粒也逐渐融合变大,在第12天达到最大,此时荧光强度也最强。因此选取这3个时间点作为数据分析的重点:第0天为对照,第4~6天代表油滴的最初形成期,第11~12天代表油滴积累的最高值,后面油脂含量和脂肪酸组成的分析也同样是选取了这3个阶段进行。
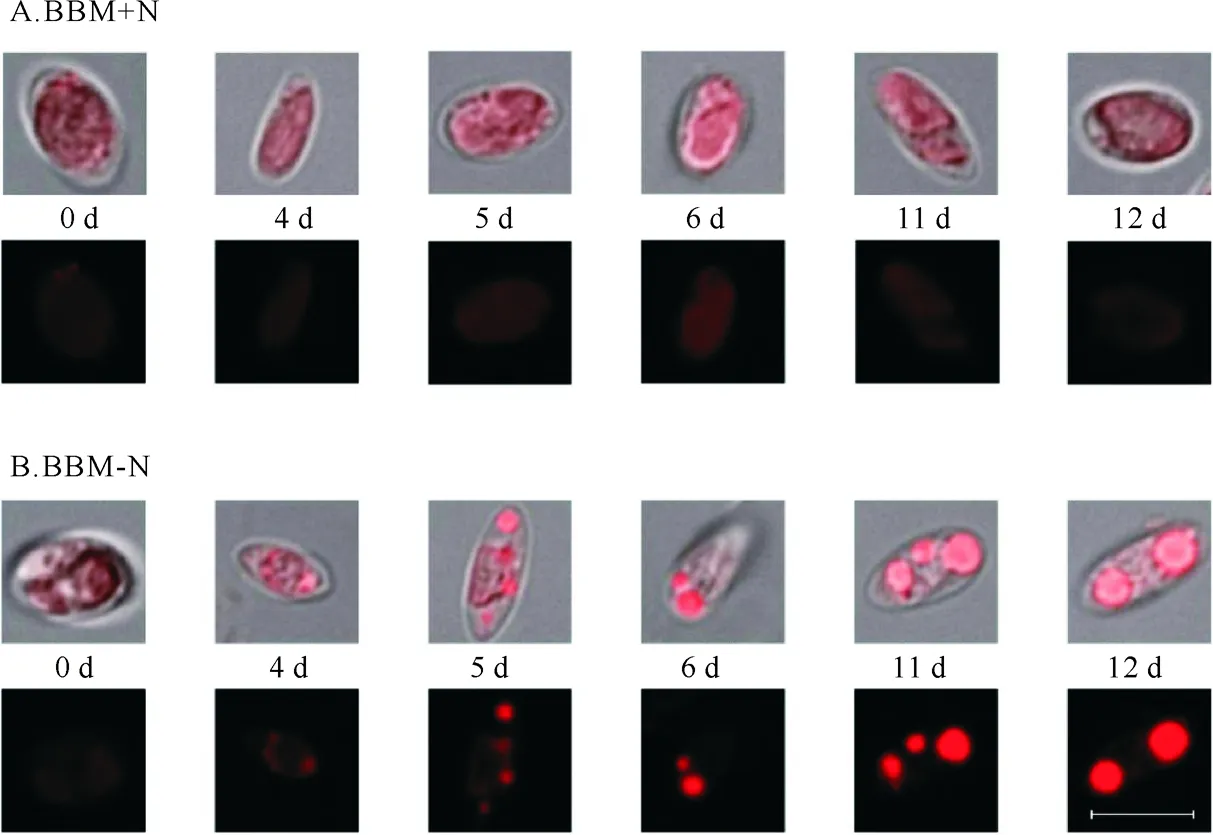
(第二行为荧光显微图像,在本实验条件下尼罗红染色的油滴发红色荧光;第一行为可见光和荧光叠加的影像,以显示细胞及其积累油滴的大小。Pictures on the second line is the fluorescent images and the red fluorescence was emitted by the lipid drops stained with Nile Red; Pictures on the first line is the overlapping images with visible and fluorescent lights to show the sizes of cell and lipid drops.)
图2 尼罗红荧光显微观察C-169细胞内油滴的积累
Fig.2 Nile Red fluorescent observation of lipid accumulation for C-169
2.3 缺氮培养对C-169积累油脂含量以及脂肪酸组成的影响
从尼罗红染色荧光显微观察可以看出,缺氮培养可以显著增加C-169油脂积累,但这些油脂的增加主要是极性脂还是TAG这类非极性脂还需要验证,因此分别分析了总脂以及经过TLC分离的TAG中的脂肪酸(FA)含量及组成。
图3是C-169在光合自养条件下的脂肪酸含量和成分分析。图3A根据C-169细胞总脂的FA含量作图,在BBM+N组中总FA的含量变化不显著(P=0.436>0.05),在BBM-N组中总FA的含量随培养时间逐渐增加,由第0天的0.792ng/1 000cells增长到第12天 1.521ng/1 000cells,有了较为显著的提高(P=0.047 <0.05)。图3B是根据C-169总脂中TAG成分的FA含量进行作图,与总脂中的FA含量一样,在BBM+N组中FA的含量变化一直不显著(P=0.137≥0.05),但在BBM-N组中FA的含量随培养时间逐渐增加,由开始的0.089ng/1 000cells增长到第12天 1.135ng/1 000cells(P=0.017<0.05)。图3C显示的是TAG中的FA占总脂FA的百分比,与上面的结果类似,在BBM+N组,这个比例差别不大(P=0.570>0.05),保持在10%左右;而在BBM-N组,该比例在第4天的数据中就已经明显升高,从开始的11.4%升高到42.9%,到第12天为74.6%,表明此时总脂中约3/4为TAG,在缺氮条件下TAG成为C-169细胞内油脂的主要成分(P=0.014<0.05)。
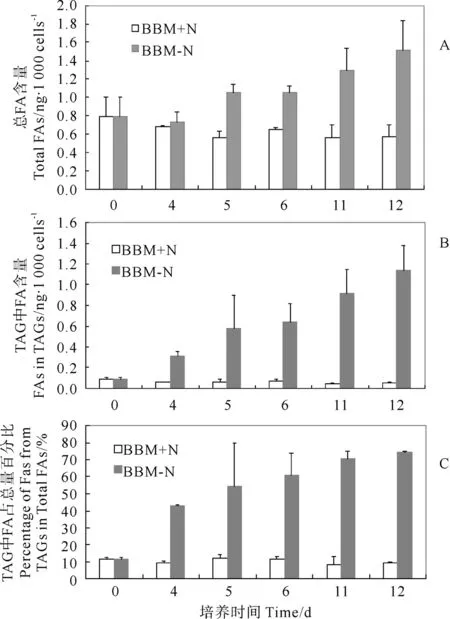
图3 光合自养条件下C-169细胞中总脂肪酸以及积累TAG的脂肪酸含量
在有充足氮、磷等元素的培养条件下,微藻细胞中淀粉、蛋白质等物质正常合成,脂肪酸主要用于合成极性脂如甘油为骨架的磷脂[31-32],而TAG作为碳源和能量的一种储存形式此时处于一个较低的水平,例如本实验中C-169在正常培养条件下TAG占总脂的比例一般仅有10%左右。而在缺氮培养条件下,叶绿素含量下降(藻细胞颜色由绿变黄),光合作用减弱,藻细胞的代谢平衡被打破,能量和营养物质不再向生长方向输送,生长和分裂停止,藻细胞还会逐渐将一些含氮较高的物质(例如不需要的蛋白质)分解掉,转而合成含氮量较低的储存物质,其中主要为TAG[20]。C-169同样遵循这样一个油脂积累的步骤,BBM-N组培养到第12天总脂比开始时增加了不到1倍,但其中TAG却达到了开始时的近7倍,因此在缺氮培养条件下所增加的油脂主要为非极性的TAG。

(以第0天样品为对照。The sample used for inoculating was treated as Control.)
图4 培养12 d后C-169细胞内总脂和TAG的脂肪酸组成分析
Fig.4 The fatty acid composition of total lipid and TAG of C-169 after 12 days cultivation
经GC-FID分析,C-169的脂肪酸主要由十六碳和十八碳脂肪酸组成,图4为实验结束时(培养了第12天)的总脂(A)和TAG(B)中脂肪酸组成的分析,其数值显示的是各种脂肪酸分别占据总脂和TAG中脂肪酸的百分比,而非绝对值。从图中可见,缺氮培养条件下变化最大的就是极大促进了油酸(18∶1)的生产,分别占总脂肪酸含量的48.17%和TAG脂肪酸的58.03%,比BBM+N组有极显著的提高(P<0.01),而且即使是BBM+N组的C-169在经过12d培养后其TAG脂肪酸中油酸的比例也有很大提高(P=0.002<0.01)。此外,BBM-N组中硬脂酸(18∶0)的比例也都比BBM+N组高,但对于TAG来说提高并不显著。棕榈油酸(16∶1)在TAG中只有在BBM-N组中积累,尽管仅占0.47%,但其在总脂肪酸中的比例在缺氮条件下反而下降了。除了上述3种FA之外,C-169中的主要FA,包括棕榈酸(16∶0)、十六碳二烯酸(16∶2)、亚油酸(18∶2)、γ-亚麻酸(GLA)(18∶3)、α-亚麻酸(18∶3)、亚麻油酸(SAT)(18∶4)等在缺氮条件下都有所下降,总的趋势是多不饱和脂肪酸含量降低而单不饱和脂肪酸和饱和脂肪酸的含量升高,棕榈酸(16∶0)、棕榈油酸(16∶1)以及硬脂酸(18∶0)和油酸(18∶1)的和分别占总脂肪酸含量的67.13%和TAG脂肪酸含量的71.54%,其中占绝对优势的是油酸(18∶1)。
按化学成分分析, 生物柴油燃料是一种高脂酸甲烷, 它是通过以不饱和油酸C18为主要成分的甘油脂分解而获得的[33],由于它与柴油分子中碳数相近,因而燃烧性能也与石化柴油类似,故成为有力的替代能源。而从生物柴油产品十六烷值、碘值、氧化安定性等燃料特性考虑,高品质生物柴油的原料中应该具有较高的单不饱和脂肪酸含量[34]。因此,适宜用作生物柴油的油脂脂肪酸组成以直链的C16或C18饱和或单不饱和脂肪酸为最佳[35]。胶球藻C-169在缺氮培养下其C16或C18饱和或单不饱和脂肪酸含量在总脂和TAG中都具有非常高的比例,尤其是油酸(18∶1)占绝对优势都符合高品质生物柴油对原料油特性的要求。
3 结语
本文分析了胶球藻C-169在缺氮条件下的生长速率和油脂含量,发现该单细胞绿藻具有较高的生长速率,即使在营养缺乏的情况下还保持了一定的生长,由于利用营养胁迫促进微藻积累油脂往往需面对藻细生长胞停滞,生物量不足的问题,这种生长速率上的优势具有一定的应用价值。其次,它在缺氮培养条件下所积累的油脂以C16或C18饱和或单不饱和脂肪酸为主,其中油酸的量占据了中性脂TAG的一半以上,符合生产高品质生物柴油的要求。总之胶球藻C-169是一种较为优良的能源微藻藻种,可进一步深入研究为生物能源的产业化服务。
致谢:感谢美国内布拉斯加大学林肯分校的Heriberto Cerutti教授对本研究的指导。
[1] Lotero E, Good W J, Bruce D A, et al. The catalysis of biodiesel synthesis [J]. J Catal, 2006, 19: 41-83.
[2] Karmakar A, Karmakar S, Mukherjee S. Properties of various plants and animals feedstocks for biodiesel production [J]. Bioresource Technol, 2010, 101(19): 7201-7210.
[3] Peerm S, Skyer T, Evan S, et al. Second generation biofuels: high-efficiency microalgae for biodiesel production [J]. Bioenergy Res, 2008(1): 20-43.
[4] 楼狄明, 沈航泉, 胡志远, 等. 基于不同原料生物柴油混合燃料的发动机性能研究 [J]. 内燃机工程, 2011, 32(1): 40-41.
[5] Miao X, Wu Q. Biodiesel production from heterotrophic microalgal oil [J]. Bioresource Technol, 2006, 97(6): 841- 846.
[6] Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances [J]. Plant J, 2008, 54: 621-639.
[7] 孔伟宝, 华绍峰, 宋昊, 等. 利用微藻生产生物柴油的研究进展 [J]. 中国油脂, 2010, 35(8): 51-56.
[8] Scott S A, Davey M P, Dennis J S, et al. Biodiesel from algae: challenges and prospects [J]. Curr Opin Biotechnol, 2010, 21: 277-286.
[9] Wijffels R H, Barbosa M J. An outlook on microalgal biofuels [J]. Science, 2010, 329: 796-799.
[10] 黄英明, 王伟良, 李元广, 等. 微藻能源技术开发和产业化的发展思路与策略[J]. 生物工程学报, 2010, 26(7): 907-913.
[11] Holm-Hasen O. Isolation and culture of terrestrial and fresh-water algae of Antarctica[J]. Phycologia, 1964, 4: 43-51.
[12] Zoller S, Lutzoni F. Slow algae, fast fungi: exceptionally high nucleotide substitution rate differences between lichenized fungiOmphalinaand their symbiotic green algaeCoccomyxa[J]. Mol Phylogenet Evol, 2003, 29: 629-640.
[13] Smith D R, Burki F, Yamada T, et al. The GC-rich mitochondrial and plastid genomes of the green algaCoccomyxagive insight into the evolution of organelle DNA nucleotide landscape [J]. Physiol Plant, 2011, 101: 67-76.
[14] Blanc G, Agarkova I, Grimwood J, et al. The genome of the polar eukaryotic microalgaCoccomyxasubellipsoideareveals traits of cold adaptation [J]. Genome Biol, 2012, 13(5): R39.
[15] Guschina I A, Harwood J L. Lipids and lipid metabolism in eukaryotic algae [J]. Prog Lipid Res, 2006, 45: 160-186.
[16] Dean A P, Sigee D C, Estrada B, et al. Using FTIR spectroscopy for rapid determination of lipid accumulation in response to nitrogen limitation in freshwater microalgae [J]. Bioresource Technol, 2010, 101: 4499-4507.
[17] Fan J, Andre C, Xu C. A chloroplast pathway for thedenovobiosynthesis of triacylglycerol inChlamydomonasreinhardtii[J]. FEBS Lett, 2011, 585: 1985-1991.
[18] Wang Z T, Ullrich N, Joo S, et al. Algal lipid bodies: stress induction, purification, and biochemical characterization in wildtype and starchlessChlamydomonasreinhardtii[J]. Eukaryot Cell, 2009, 8: 1856-1868.
[19] Li Y T, Han D X, Sommerfeld M, et al. Photosynthetic carbon partitioning and lipid production in the oleaginous microalgaPseudochlorococcumsp. (Chlorophyceae) under nitrogen-limited conditions [J]. Bioresource Technol, 2011, 102: 123-129.
[20] Msanne J, Xu D, Konda A R, et al. Metabolic and gene expression changes triggered by nitrogen deprivation in the photoautotrophically grown microalgaeChlamydomonasreinhardtiiandCoccomyxasp. C-169 [J]. Phytochemistry, 2012, 75: 50-59.
[21] 刘金丽, 王俊峰, 刘天中, 等. 缺氮条件对栅藻油脂积累与光合作用的影响[J]. 海洋科学, 2013, 37(7): 13-19.
[22] 魏东, 李露. 补充 CO2提高胶球藻 C-169 生物量和脂肪酸产率的研究[J]. 现代食品科技, 2014, 30(4): 34-39.
[23] Bold H C. The morphology ofChlamydomonaschlamydogama, sp. Nov [J]. Bulletin of the Torrey Botanical Club, 1949, 122: 101-108.
[24] Greenspan M, Mayer E P, Fowler S D. Nile red-a selective fluorescent stain for intracellular lipid droplets [J]. J Cell Biol, 1985, 100: 965-973.
[25] Chen W, Zhang C, Song L, et al. A high throughput Nile red method for quantitative measurement of neutral lipids in microalgae [J]. J Microbiol Methods, 2009, 77: 41-47.
[26] Bligh E G, Dyer W J. A rapid method of total lipid extraction and purification [J]. Can J Biochem Physiol, 1959, 37: 911-917.
[27] Cahoon E B, Dietrich C R, Meyer K, et al. Conjugated fatty acids accumulate to high levels in phospholipids of metabolically engineered soybean andArabidopsisseeds [J]. Phytochemistry, 2006, 67: 1166-1176.
[28] Andersson B A, Christie W W, Holman R T. Mass spectrometric determination of positions of double bonds in polyunsaturated fatty acid pyrrolidides [J]. Lipids, 1975, 10: 215-219.
[29] Cahoon E B, Cranmer A M, Shanklin J, et al. D6 Hexadecenoic acid is synthesized by the activity of a soluble D6 palmitoyl-acyl carrier protein desaturase inThunbergiaalataendosperm [J]. J Biol Chem, 1994, 269: 27519-27526.
[30] Liu Z Y, Wang G C, Zhou B C. Effect of iron on growth and lipid accumulation inChlorellavulgaris[J]. Bioresource Technol, 2008, 99(11): 4717-4722.
[31] 李昌珠, 李正茂. 植物脂肪酸的生物合成及其生理功能的研究进展 [J]. 湖南林业科技, 2009, 36(6): 45-49.
[32] 潘克厚, 韩吉昌, 朱葆华, 等. 基因工程在提高微藻生产生物柴油能力中的应用前景 [J]. 海洋湖沼通报, 2012(2): 33-43.
[33] 韩德奇, 袁旦, 王尽涛, 等. 生物柴油的现状与发展前景 [J]. 石油化工技术经济, 2002, 18(4): 34-37.
[34] 王利, 于海燕, 贺晓辉, 等. 生物柴油树种油脂脂肪酸组成对燃料特性的影响 [J]. 燃料化学学报, 2014, 40(4): 397-404.
[35] 何瑞, 徐宁, 段舜山. 九种海洋微藻总脂含量及脂肪酸组成分析 [J]. 生态科学, 2014, 33(1): 93-98.
责任编辑 高 蓓
Effects of Nitrogen Deprivation onCoccomyxasp. C-169 for Its Lipid Accumulation and Fatty Acid Composition
XU Di, CAO Xiao-Fei, ZHANG Xiao-Zhou, ZHANG Xue-Cheng
(The Key Laboratory of Marine Genetics and Breeding, Ministry of Education, College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China)
With the increasing problem of lacking of oil natural resources, a great intentions have been focused on the biodiesel production from microalgae all over the world. In order to realize this bio-energy industry, selecting the high oil content algal species or breedings is the key work. The effects of nitrogen deprivation on the growth, lipid content and fatty acids composition ofCoccomyxasp. C-169 were examined here. Under nitrogen starve, the growth speed of C-169 started to lag behind the control group from the 3rd day and the cell density maintained at about 1.6×107cell/ml after 10 days which was 33 times higher than the inoculating density. Furthermore, the Nile Red fluorescent microscopic observation showed that the lipid accumulation reached its highest level on day 12. At this point, the fatty acid content of total lipid was 1.135 ng/1 000 cells compared with 0.089 ng/1 000 cells of control and the portion of TAG in total lipid was 74.6%. The fatty acid composition of TAG was composed of C16 and C18 saturated or mono-unsaturated fatty acid mostly and the oleic acid (18∶1) was especially high which was occupying more than half. So it shows thatCoccomyxaC-169 may be a suitable candidate for the high quality biodiesel production.
Coccomyxasp. C-169; Nitrogen deprivation; lipid accumulation; fatty acid composition
感谢广西壮族自治区北海市科技项目(201203024)对本研究的支持。
2015-03-11;
2015-05-08
徐 涤(1972-),女,副教授。E-mail: dixa@ouc.edu.cn
S968.41
A
1672-5174(2015)12-051-06
10.16441/j.cnki.hdxb.20150060
