组蛋白去乙酰化酶抑制剂罗米地辛对小鼠T细胞表型及功能的影响
2015-03-30田孝军蒋继贫荆州市第二人民医院重症医学科湖北荆州44000华中科技大学同济医学院附属同济医院手术室器官移植研究所湖北武汉4000
田孝军,徐 晶,蒋继贫(荆州市第二人民医院重症医学科,湖北荆州44000;华中科技大学同济医学院附属同济医院手术室,器官移植研究所,湖北,武汉4000)
组蛋白去乙酰化酶抑制剂罗米地辛对小鼠T细胞表型及功能的影响
田孝军1,徐晶2,蒋继贫3△
(1荆州市第二人民医院重症医学科,湖北荆州434000;华中科技大学同济医学院附属同济医院2手术室,3器官移植研究所,湖北,武汉430030)
[摘要]目的:通过体外实验观察罗米地辛对效应T细胞和调节性T细胞的作用。方法:取CFSE标记的淋巴细胞、CD4+T细胞和CD8+T细胞作为反应细胞,实验组加入不同浓度梯度(1、3、5 μmol/L)的罗米地辛及CD3/CD28单抗进行淋巴细胞培养,以仅加入CD3/CD28单抗作为阳性对照组,另设空白对照组。培养72 h后检测各组细胞的增殖情况。以淋巴细胞作为反应细胞,实验组、阳性对照组及空白对照组设定同上,72 h后检测各组中CD4+Foxp3+T细胞与CD4+T细胞的比例变化。同时采用ELISA检测培养液中相关细胞因子,如TNF-α、IL-10 及TGF-β水平的变化。结果:罗米地辛剂量依赖性地抑制CD3/CD28单抗诱导的淋巴细胞、CD4+T细胞和CD8+T细胞的增殖(P<0.05)。在CD3/CD28单抗存在的条件下,1 μmol/L的罗米地辛不能诱导CD4+Foxp3+T细胞的比例上调(P>0.05)。但提高罗米地辛的浓度至3 μmol/L和5 μmol/L后,CD4+Foxp3+T细胞的比例显著提高(P<0.05)。随着罗米地辛浓度的增加,TNF-α和IL-10水平呈剂量依赖性降低,但各实验组明显高于空白对照组而低于阳性对照组(P<0.05)。TGF-β在阳性对照组虽稍有升高,但与空白对照组相比无显著差异(P>0.05)。而随着罗米地辛浓度的增加,TGF-β水平呈剂量依赖性升高,3实验组间及与空白对照组、阳性对照组间差异显著(P<0.05)。结论:体外实验研究显示罗米地辛不仅能够有效抑制效应性T细胞的增殖,而且一定浓度的罗米地辛可上调调节性T细胞的比例,这可能与TGF-β升高有关,而与IL-10变化无关。
[关键词]组蛋白去乙酰化酶;罗米地辛;调节性T细胞
Influence of histone deacetylase inhibitor romidepsin on phenotype and function of T lymphocytes in vitro
TIAN Xiao-jun1,XU Jing2,JIANG Ji-pin3
(1Intensive Care Unit,The Second Hospital of Jingzhou,Jingzhou 434000,China;2Operation Room,3Institute of Organ Transplantation,Tongji Hospital,Tongji Medical College,Huazhong University of Technology&Science,Wuhan 430030,China.E-mail: 30503249@ qq.com)
[ABSTRACT]AIM: To explore the effects of romidepsin (FK228),a novel histone deacetylase inhibitor,on the effector and regulatory T cells in vitro.METHODS: As the reactive cells,lymphocytes,CD4+T cells and CD8+T cells were labelled with CFSE,and stimulated with anti-CD3 and anti-CD28 mAbs in the presence and absence of different levels of romidepsin (experimental group and positive control group),or PBS (placebo group).After 72 h,the proliferation of the cells was detected in different groups.The lymphocytes were stimulated with anti-CD3 and anti-CD28 mAbs in the presence and absence of different levels of romidepsin (experimental group and positive control group),or PBS (placebo group).After 72 h,the percentage of CD4+Foxp3+T cells and the levels of related cytokines were detected in different groups.RESULTS: The proliferation of CFSE-labelled lymphocytes,CD4+T cells and CD8+T cells triggered by anti-CD3 and anti-CD28 mAbs all were inhibited when cultured with romidepsin at concentrations of 1 μmol/L,3 μmol/L and 5 μmol/L in a dose-dependent manner (P<0.05).Compared with placebo group,in the presence of anti-CD3 and anti-CD28 mAbs,1 μmol/L romidepsin did not increase the percentage of CD4+Foxp3+T cells (P>0.05).When cultured with romidepsin at concentrations of 3 μmol/L and 5 μmol/L,the percentage of CD4+Foxp3+T cells was enhanced markedly (P<0.05).The levels of IL-10 and TNF-α in the supernatant were markedly increased in positive control groupand 3 experimental groups (P<0.05),and the levels of cytokines in different experimental groups were gradually decreased with the elevation of FK228 concentration (P<0.05).The level of TGF-β was slightly increased in positive control group with no significant difference compared with placebo group (P>0.05).With the increase in the concentration of FK228 in different experimental groups,the TGF-β level was increased in a dose-dependent manner and there were significant differences in the 3 experimental groups.Meanwhile,significant differences existed between experimental groups and placebo group and between experimental groups and positive control group (P<0.05).CONCLUSION: Romidepsin inhibits the proliferation of CD4+and CD8+effector T cells and increases the percentage of CD4+Foxp3+regulatory T cells.It may be related to the increased level of TGF-β,but independent of IL-10.
[KEY WORDS]Histone deacetylase; Romidepsin; Regulatory T cells
组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor,HDACi)可逆转与肿瘤相关的表观遗传异常改变,已成为确切的肿瘤治疗手段之一[1-2]。近年来,随着对组蛋白去乙酰化酶研究的深入,进一步发现HDACi对于淋巴细胞还具有较强的免疫抑制作用,其作为潜在的治疗自身免疫性疾病和抗移植排斥药物的可能性逐渐受到重视[3]。已有文献证实作为HDACi的曲古抑菌素(trichostatin,TSA)和辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)等可影响淋巴细胞的增殖和凋亡等[4]。罗米地辛(romidepsin,FK228)作为新近研发的HDACi已获得美国FDA批准用于皮肤T-细胞淋巴瘤的治疗[5]。但对于其对正常淋巴细胞的影响仍缺乏相关研究。本研究拟在体外小鼠淋巴细胞培养体系中,对其作用加以探讨。
材料和方法
1实验动物
清洁级BALB/c小鼠,6~8周龄,体重约20 g,由华中科技大学同济医院器官移植研究所动物中心提供。
2主要试剂及仪器
FITC标记的抗CD4单抗以及APC标记的抗CD8单抗、抗CD3单抗和抗CD28单抗均购于Bio-Legend;罗米地辛购自Celgene;荧光染料CFSE购于Promega; CD4+CD25+Treg流式检测试剂盒购于eBioscience; CD4+、CD8+T细胞磁珠分离试剂盒购于MACS。流式细胞检测应用BD FACSCalibur流式细胞仪(BD)。纯化的单克隆IL-10抗体、TNF-α抗体、IL-10、TNF-α标准品和生物素标记的Ⅱ抗均购自Phar Mingen;亲和素标记的过氧化物酶购自Sigma。
3主要方法
3.1淋巴细胞悬液的制备无菌条件下切取BALB/c小鼠脾脏,超净工作台下置于盛有淋巴细胞分离液的培养皿中。以200目尼龙滤网包裹,无齿弯镊轻轻挤压至无红色脾组织块。收集滤液,加入不完全培养基。以800×g密度梯度离心30 min。收集单个核细胞层。再用不完全RPMI-1640培养液洗涤3次,并调整终浓度至实验所需(1×1011/L)。台盼兰染色判定细胞活力>95%。
3.2CD4+、CD8+T细胞的分离收集野生型BALB/c小鼠脾细胞悬液(约2×108个),严格按照小鼠CD4亚群、CD8亚群T细胞磁性分选说明书进行阴性分选,得到CD4+或CD8+T细胞。将分离出的细胞250×g离心5 min,弃上清,并重悬细胞,调整细胞浓度为1×1010/L。
3.3 CFSE标记将CFDA-SE原液(10 mmol/L)加PBS稀释制备成5 μmol/L工作液,37℃与实验用细胞(淋巴细胞、CD4+T细胞和CD8+T细胞)共孵育10 min。完全RPMI-1640终止,并洗涤细胞1次,经37℃预热的RPMI-1640重悬标记细胞,再孵育10 min。再次以37℃预热的RPMI-1640洗细胞1次。调整细胞的浓度为1×1010/L。
3.4罗米地辛对淋巴细胞毒性作用的检测取按照以上方法获得的淋巴细胞,每孔加入约106个细胞。罗米地辛溶于以4∶1混合的丙二醇和乙醇溶液中,初始浓度为5 g/L。再以DMSO稀释至100 mg/L,并于-20°C储存。根据实验所需,分别调整罗米地辛的培养体系终浓度为1 μmol/L、3 μmol/L和5 μmol/L。体系为2 mL。在37℃、5% CO2培养箱孵育72 h。72 h后,收集细胞使用AnnexinⅤ与PI双染,流式细胞仪检测,并分析结果。
3.5淋巴细胞增殖的检测取CFSE标记的淋巴细胞、CD4+T细胞或CD8+T细胞。将上述细胞加入72孔培养板中,每孔加5×105个细胞(200 μL)。加入浓度依次为1 μmol/L、3 μmol/L和5 μmol/L到罗米地辛。同时以加入1 mg/L的抗CD3/CD28单抗作为实验组;以仅加入抗CD3/CD28单抗刺激的作为阳性对照组;以PBS代替抗CD3/CD28单抗作为空白对照组。上述各组均培养72 h,每组均设3个复孔。流式细胞仪检测标记细胞CFSE荧光强度变化。ModFit LT软件拟合,得到增殖细胞各代的百分率,CellQuest软件分析增殖细胞比例。
3.6调节性T细胞(Treg)及细胞因子水平的检测
取未以CFSE标记的淋巴细胞,加入72孔培养板中,每孔5×105个细胞。分别以终浓度1 μmol/L、3 μmol/L和5 μmol/L的罗米地辛加入1 mg/L的抗CD3/CD28单抗作为实验组;以仅加入抗CD3/CD28单抗刺激的作为阳性对照组;以PBS代替抗CD3/CD28单抗作为空白对照组。上述各组均培养72 h,每组均设12个复孔,其中3个行Treg细胞检测,3个行IL-10检测,3个行TGF-β检测,3个行TNF-α检测。另外,(1)取上述每孔细胞,调整至100 μL体系并加入FITC-CD4单抗、APC-CD25单抗各0.5 μL,4℃避光孵育15 min,PBS清洗;加入Foxp3 Fix/Perm Buffer固定,室温避光反应30 min后,离心弃上清,PBS液洗1次。细胞再以Foxp3 Fix/Perm Buffer打孔后加入1 μL的PE-Foxp3单抗,室温避光反应30 min; PBS洗并重悬细胞,调整终体积至500 μL。流式细胞术检测各组细胞的Foxp3表达。(2)取上述每孔上清,采用双抗体夹心ABC-ELISA法分别检测IL-10、TGF-β及TNF-α水平。IL-10、TGF-β或TNF-α单抗包板、封闭、上样。结合生物素化抗体,亲和素(酶)与生物素结合,底物显色。Clinibio全自动酶标仪492 nm波长读各孔A值,获得标准曲线和样本浓度。
4统计学处理
用SPSS 21.0软件进行统计分析,采用方差分析检验各组间差异,组间比较采用SNK-q检验,以P<0.05为差异具有统计学意义。
结果
1罗米地辛对淋巴细胞毒性作用的检测
淋巴细胞在经过罗米地辛孵育72 h后,通过检测AnnexinⅤ与PI双阳性细胞比例,查看药物毒性。通过至少3次独立实验,经过统计学分析,各组之间坏死细胞比例差异无统计学意义(P>0.05),见图1。

Figure 1.The toxicity of FK228 on lymphocytes growth in vitro.Mean±SD.n=3.图1体外实验中罗米地辛对淋巴细胞的毒性
2淋巴细胞增殖的检测
细胞培养72 h后,空白对照组淋巴细胞未见CFSE增殖峰;而阳性对照组中标记细胞在抗CD3/CD28单抗作用下,出现多个CFSE增殖峰;在分别加入1 μmol/L、3 μmol/L和5 μmol/L罗米地辛后,细胞增殖代数均出现递减现象,其中以5 μmol/L罗米地辛组的抑制作用最为明显,未出现明显增殖峰;分别给予1 μmol/L、3 μmol/L和5 μmol/L的罗米地辛后,淋巴细胞增殖的抑制率分别为39.7%、79.2%和97.6%。同样,分别给予1 μmol/L、3 μmol/L和5 μmol/L的罗米地辛也能明显抑制实验组效应性CD4+、CD8+T细胞的增殖(P<0.05),见图2。
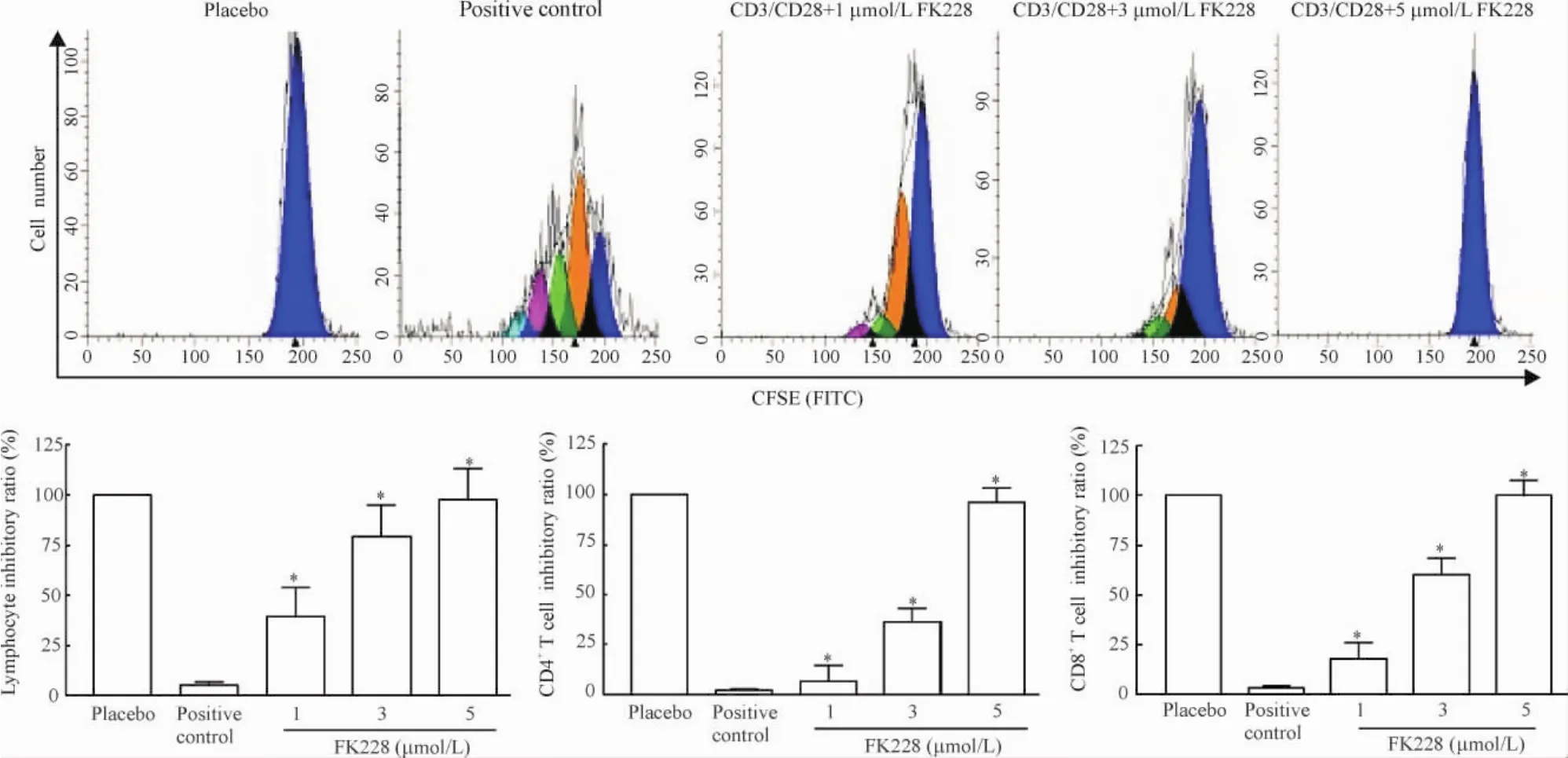
Figure 2.The effects of different concentrations of romidepsin (FK228) on the proliferation of lymphocytes.Mean±SD.n=3.*P<0.05 vs postive control.图2罗米地辛对淋巴细胞、CD4+T细胞和CD8+T细胞增殖的影响
3流式细胞仪检测Treg细胞
淋巴细胞仅受CD3/CD28刺激72 h后,阳性对照组中CD4+Foxp3+T细胞占淋巴细胞的比例与空白对照组相比并无明显差异;实验组中加入1 μmol/L罗米地辛后,CD4+Foxp3+T细胞的比例并未明显提高,与空白对照组和阳性对照组相比差异均无统计学意义;然而给予3 μmol/L和5 μmol/L罗米地辛作用后,CD4+Foxp3+T细胞占淋巴细胞的比例明显升高,分别达到2.93%和8.14%,与空白对照组、阳性对照组及1 μmol/L罗米地辛作用的实验组比较,差异显著(P<0.05) ;通过流式软件分析,我们发现Foxp3+T细胞主要位于CD4+CD25+T细胞亚群,占80%以上,见图3。
4细胞因子TNF-α、IL-10及TGF-β水平的检测
淋巴细胞受CD3/CD28刺激72 h后,细胞因子TNF-α和IL-10的水平变化阳性对照组较空白对照组均明显升高(P<0.05;而不同实验组中随着罗米地辛浓度的增加,TNF-α和IL-10水平呈剂量依赖性降低,但各实验组TNF-α和IL-10水平明显高于空白对照组而低于阳性对照,组间差异均有统计学意义(P<0.05)。而对于TGF-β检测显示,阳性对照组虽稍有升高,但与空白对照组相比差异不显著(P>0.05),而不同实验组中随着罗米地辛浓度的增加,TGF-β水平呈剂量依赖性升高(P<0.05),见图4。
讨论
HDACi是一类具有抗肿瘤活性的新型药物。自20世纪90年代以来,越来越多的HDACi被发现。根据分子结构不同,HDACi主要分为短链脂肪酸类(丁酸钠和丙戊酸)、有机氧肟酸类(TSA和SAHA)、苯甲酰胺类(CI-994和MS-27-275)、环状四肽类(trapoxin A )和双环肽类(罗米地辛和FR901228)[6]。罗米地辛最早由紫色素杆菌的肉汤培养基中分离得到,同其它HDACi一样,罗米地辛在成人恶性肿瘤中可诱导细胞周期阻滞、促进细胞分化和凋亡以及改变基因的表达,其已被FDA批准用于复发或难治的皮肤T细胞淋巴瘤(CTCLs)的治疗,患者的应答率达50%[7]。但其对正常免疫系统,尤其是淋巴细胞的作用仍知之甚少。
有文献报告曲古抑菌素A(trichostatin,TSA)通过腹腔给药方式作用于小鼠后,对CD4+T细胞亚群具有选择性抑制作用,并且能抑制混合淋巴细胞培养中T细胞的增殖和IL-2的表达[8]。尽管罗米地辛与TSA的作用途径相同,但其在抑制增殖的效应方面是后者的10倍[9]。在本实验中,我们以抗CD3单抗联合抗CD28单抗模拟同种异基因抗原刺激,在淋巴细胞培养体系中,可使后者发生明显增殖,表现为CFSE标记细胞出现多个子代分裂峰。而当在细胞培养体系中加入不同浓度的罗米地辛后,细胞的增殖受到不同程度抑制。1 μmol/L罗米地辛即表现出显著的淋巴细胞增殖抑制效应,抑制率为39.7%,细胞增殖各子代的百分率亦明显降低。而且,随着药物浓度的提高,抑制作用逐渐增强,细胞增殖代数递减,细胞增殖抑制率逐渐提高。同样地,罗米地辛可以剂量依赖性地抑制CD3/CD28诱导的效应性CD4+和CD8+T细胞的增殖,随着剂量的增加,增殖抑制逐步增强。上述结果表明,罗米地辛能够显著抑制效应T细胞的增殖,进而下调T细胞介导的细胞免疫应答。同时,我们对罗米地辛对淋巴细胞毒性的检测结果也表明,1 μmol/L、3 μmol/L和5 μmol/L罗米地辛均不会对淋巴细胞产生明显的毒性作用。
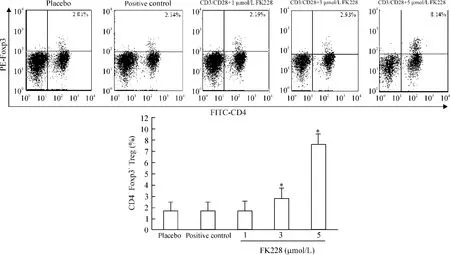
Figure 3.The changes of CD4+Foxp3+Treg proportion in the lymphocytes cultured in vitro detected by flow cytometry.Mean±SD.n=3,*P<0.05 vs positive control group.图3流式细胞仪检测体外淋巴细胞培养中CD4+Foxp3+Treg的比例
已有的资料已经显现HDACi对调节性T细胞的产生以及其发挥免疫抑制功能具有一定的作用[10]。在本研究中,我们将淋巴细胞进行体外诱导,观察罗米地辛对Treg细胞表达的影响。在抗CD3/CD28单抗存在的情况下,培养体系中加入1 μmol/L罗米地辛并不能诱导CD4+Foxp3+T细胞比例的升高。但是给予3 μmol/L和5 μmol/L罗米地辛后,CD4+Foxp3+T细胞的比例显著增高,且此种作用亦呈现剂量依赖性。此外,流式分析显示CD4+CD25+T细胞中Foxp3表达率在80%以上。此结果表明,一定浓度的罗米地辛能够诱导CD4+CD25+Foxp3+Treg亚群的扩增。
效应型T细胞与调节型T细胞的力量对比决定了同种异基因免疫应答的结局。罗米地辛在对T细胞亚群的作用方面即显示了双重性,其不仅能够抑制效应性T细胞的增殖,而且能够上调调节性T细胞的比例,从而改变效应性T细胞和与调节性T细胞间的平衡,促使免疫应答向着有利于耐受形成的方向发展。
为了探讨在罗米地辛抑制效应T细胞增殖及促进调节性T细胞分化过程中,细胞因子是否发挥了决定性作用,我们还进一步检测了相关细胞因子水平的变化。一般认为,TNF-α属于促炎细胞因子,在促进免疫应答过程中发挥主要作用;而IL-10和TGF-β属于抗炎细胞因子,在抑制免疫应答过程中发挥主要作用[11]。本研究结果表明,TNF-α在各组中的变化规律与效应T细胞活化增殖及受抑制的变化规律完全一致。同样,TGF-β在空白组与阳性对照组并无明显差异,而随着罗米地辛对效应T细胞抑制作用的加强,其水平也有显著升高,这与CD4+CD25+Foxp3+Treg比例变化的规律也一致。既往已证实TGF-β可以促进CD4+T细胞高表达Foxp3进而产生抑制性表型;同时CD4+CD25+Foxp3+Treg也可受TCR刺激,通过分泌TGF-β和IL-10而发挥免疫抑制作用。本研究的结果提示伴随着效应性T细胞的增殖,有一定水平的TGF-β升高。而这种TGF-β升高又可以随着罗米地辛对效应T细胞的抑制,而导致效应性T细胞高表达Foxp3,从而分化为CD4+CD25+Foxp3+Treg。同样,随着CD4+CD25+Foxp3+Treg比例的升高,又可以分泌更多的TGF-β,从而进一步增强了CD4+CD25+Foxp3+Treg的免疫抑制功能以及提高了比例。然而,对于IL-10检测的结果显示随着效应T细胞的增殖,其水平显著升高,而随着罗米地辛对效应T细胞抑制作用的加强,其水平并未升高。相反,却呈进行性下降。此结果表明,罗米地辛所诱导的CD4+CD25+Foxp3+Treg比例升高,是非IL-10依赖性的。
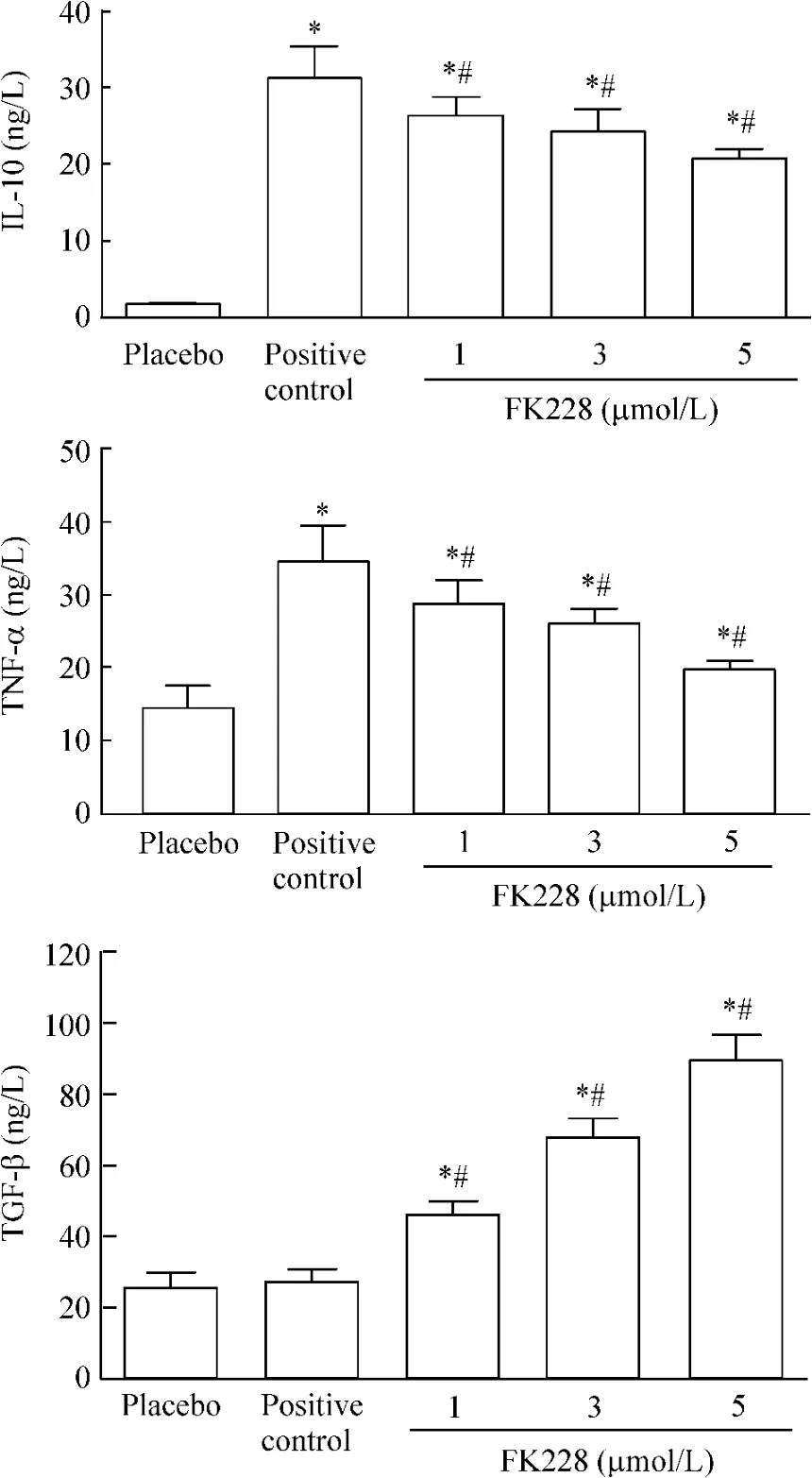
Figure 4.The changes of IL-10,TNF-α and TGF-β in different groups by ELISA.Mean±SD.n=3.*P<0.05 vs placebo group;#P<0.05 vs positive control group.图4 ELISA检测各组上清液中TNF-α、IL-10及TGF-β水平
目前对于HDACi在调节免疫系统方面的作用仍不够深入,下一步的研究将着重于探讨何种类型的HDACi对淋巴细胞的作用最佳,具体的作用方式如何?以及使用何种浓度HDACi可以在抑制效应性T细胞的增殖的同时,使体内调节性T细胞达到稳定、持续的表达。
[参考文献]
[1]West AC,Johnstone RW.New and emerging HDAC inhibitors for cancer treatment[J].J Clin Invest,2014,124(1) :30-39.
[2]邹琛,周俊,陆国平.组蛋白去乙酰化酶抑制剂与细胞周期和凋亡关系的研究进展[J].中国病理生理杂志,2007,23(12) :2487-2490.
[3]Tang J,Yan H,Zhuang S.Histone deacetylases as targets for treatment of multiple diseases[J].Clin Sci (Lond),2013,124(11) :651-662.
[4]Guo X,Jie Y,Ren D,et al.Histone deacetylase inhibitors promote mice corneal allograft survival through alteration of CD4+effector T cells and induction of Foxp3+regulatory T cells[J].Cell Immunol,2012,277(1-2) : 8-13.
[5]McGraw AL.Romidepsin for the treatment of T-cell lymphomas[J].Am J Health Syst Pharm,2013,70(13) : 1115-1122.
[6]Marks P,Rifkind RA,Richon VM,et al.Histone deacetylases and cancer: causes and therapies[J].Nat Rev Cancer,2001,1(3) :194-202.
[7]Kim M,Thompson LA,Wenger SD,et al.Romidepsin: a histone deacetylase inhibitor for refractory cutaneous T-cell lymphoma[J].Ann Pharmacother,2012,46(10) : 1340-1348.
[8]魏强,于立新,邓文锋,等.曲古抑菌素A对小鼠混合淋巴细胞培养中淋巴细胞增殖和IL-2表达的影响[J].南方医科大学学报,2008,28(3) : 467-469.
[9]Piekarz RL,Robey RW,Zhan Z,et al.T-cell lymphoma as a model for the use of histone deacetylase inhibitors in cancer therapy: impact of depsipeptide on molecular mar kers,therapeutic targets and mechanisms of resistance [J].Blood,2004,103(12) :4636-4643.
[10]Beier UH,Wang L,Hancock WW.Combination of isoform-selective histone/protein deacetylase inhibitors improves Foxp3+T-regulatory cell function[J].Cell Cycle,2012,11(18) :3351-3352.
[11]刘璠娜,董向楠,胡波,等.尿毒症患者外周Th17/Treg细胞变化与机体微炎症状态的关系[J].中国病理生理杂志,2012,28(6) :1057-1060.
·短篇论著·
通讯作者△Tel: 027-83665283; E-mail: 30503249@ qq.com
[收稿日期]2014-07-09[修回日期]2015-04-28
[文章编号]1000-4718(2015)06-1099-06
[中图分类号]R392.1
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.023
