聚合物/液晶细胞模型的构建及其表面弹性对大鼠骨髓干细胞黏附的影响*
2015-03-30郭燕珊郑力恒尚玉攀张嘉晴暨南大学医学院生物化学系附属第一医院广州华侨医院骨科理工学院生物材料系广东广州506澳门医学科技研究协会中国澳门999078
郭燕珊,吴 昊,郑力恒,尚玉攀,屠 美,张嘉晴△(暨南大学医学院生物化学系,附属第一医院广州华侨医院骨科,理工学院生物材料系,广东广州506;澳门医学科技研究协会,中国澳门999078)
聚合物/液晶细胞模型的构建及其表面弹性对大鼠骨髓干细胞黏附的影响*
郭燕珊1,吴昊2,郑力恒4,尚玉攀1,屠美3,张嘉晴1△
(暨南大学1医学院生物化学系,2附属第一医院广州华侨医院骨科,
3理工学院生物材料系,广东广州510632;4澳门医学科技研究协会,中国澳门999078)
[摘要]目的:构建聚合物/液晶细胞模型,探究其表面弹性对大鼠骨髓干细胞黏附情况的影响。方法:溶剂挥发致相分离方法构建聚合物/液晶细胞模型,通过偏光显微镜、扫描式电子显微镜及X射线衍射观察细胞模型的表面特征。全骨髓细胞贴壁培养法分离大鼠骨髓间充质干细胞(BMSCs),通过表面因子检测和诱导其成骨成脂分化进行鉴定。培养3代后分4组:纯PU空白对照组,10%膜组,30%膜组和50%膜组。接种细胞密度为5×107/L,待细胞贴壁24h后作细胞骨架染色处理,激光共聚焦显微镜观察细胞附着在材料上的情况并拍照。结果:溶剂挥发致相分离方法成功构建3种不同硬度的聚合物/液晶细胞模型;表面因子检测显示CD29、CD44、CD90呈阳性表达,而CD34和CD45呈阴性表达;经过茜素红S染色和油红O染色,成骨成脂分化形成的钙结节和脂滴都显而易见;细胞骨架染色拍摄结果显示,纯PU对照组、10%膜组和30%膜组上的细胞铺展面积较广,肌动蛋白微丝和细胞核清晰明显;而50%膜组的细胞铺展面积较小,细胞核虽较清晰,但是肌动蛋白微丝却模糊不清。结论:合适液晶含量的聚合物/液晶生物膜能支持大鼠骨髓干细胞的贴壁生长,而液晶含量过高则抑制细胞的贴壁生长。
[关键词]聚合物/液晶细胞模型;大鼠骨髓干细胞;细胞骨架染色
[修回日期]2015-03-04
Development of cell model of polymer/liquid crystal and effect of their elasticity on adhesion of rBM-MSCs
GUO Yan-shan1,WU Hao2,ZHENG Li-heng4,SHANG Yu-pan1,TU Mei3,ZHANG Jiaqing1
(1Department of Biochemistry,School of Medicine,2Department of Orthopedics,The First Affiliated Hospital,3Department of Biological Material,Jinan University,Guangzhou 510632,China;4Macau Medical Science&Technology Research Association,Macau 999078,China.E-mail: zhangjiaqing@ jnu.edu.cn)
[ABSTRACT]AIM: To develop the cell model of polymer/liquid crystal and to study the effect of their elasticity on the adhesion of rat bone marrow mesenchymal stem cells (rBM-MSCs).METHODS: Using the method of solvent evaporation induced phase separation,the cell model of polymer/liquid crystal was constructed.The surface morphology and phase separation structure were determined by polarized optical microscopy (POM),scanning electron microscopy (SEM) and small angle X-ray scattering (SAXS).rBM-MSCs were separated and expanded by adherent culture.The surface markers of rBM-MSCs were detected by flow cytometry.The cells were induced to osteogenic differentiation and adipogenic differentiation for 2 weeks.After 3 passages,the cells were divided into 4 groups,including total PU control group,10% membrane group,30% membrane group and 50% membrane group.The cells were then incubated with rhodamine phalloidin for cytoskeleton staining and were observed under the confocal laser scanning microscope after cultured for 24 h.RESULTS: The cell model of polymer/liquid crystal was constructed successfully using the method of solvent evaporation induced phase separation.Flow cytometry results showed that the rBM-MSCs positively expressed CD29,CD44 and CD90,and negatively expressed CD34 and CD45.After stained with alizarin red S and oil red O,the calcium nodule and lipid droplets in rBM-MSCs were observed obviously.The cytoskeleton staining result indicated that the area in total PU control group,10% membrane group and 30% membrane group were greater,and the actin microfilaments were also clearer thanthat in 50% membrane group.CONCLUSION: The cell model with suitable content of liquid crystal made a contribution to the rBM-MSCs’adhesion,but too much liquid crystal inhibits cell adhesion.
[KEY WORDS]Cell model of polymer/liquid crystal; Rat bone marrow mesenchymal stem cells; Cytoskeleton staining
细胞外基质为细胞的生长和代谢提供物理空间,为细胞的黏附提供力学支撑并传递化学、力学以及生物学信号,诱导细胞生长、调控细胞的表型,从而极大地影响再生组织的结构和功能[1]。研究表明用于组织工程的生物材料,种子细胞的增殖、分化等生物学行为都造成不同的影响,而生物材料的表面特性所占的地位尤为重要[2-5]。这就意味着,控制材料的表面特性可能引起细胞生物特性的改变[6-8]。
近年来,随着对干细胞性能了解的逐渐深入,其多能性分化潜能的可控性逐渐提高,干细胞已被更加广泛地用作组织工程中的种子细胞。大鼠骨髓间充质干细胞(rat bone marrow mesenchymal stem cells,rBM-MSCs)是分离自大鼠骨髓中的具有高度自我更新和多向分化潜能的成体干细胞,包括骨、软骨、筋腱、韧带、肌肉和脂肪等,且存在取材方便、体外培养技术成熟、具有自体移植潜能等优点,近年来已成为生命科学领域备受瞩目的种子细胞[9-12]。
干细胞对其细胞外基质的固有性质非常敏感,基质弹性诱导干细胞的分化已经成为一种新型的、敏感性非常高的细胞调节因素。本研究通过设计具有适宜弹性模量的聚合物/液晶细胞模型,研究基质表面弹性对rBM-MSCs黏附生长等细胞行为的影响,是组织工程用生物材料设计的一个新思路。
材料和方法
1材料和试剂
6~8周SD大鼠(南方医科大学动物中心) ;低糖DMEM(Gibco) ;特级胎牛血清(北京元亨圣马生物技术研究所) ;青、链霉素、L-谷氨酰胺(Sigma) ;细胞骨架染色材料均购自Cytoskeleton。
2方法
2.1聚合物/液晶生物膜制作羟丙基纤维素衍生物液晶(OPC)/聚氨酯(PU)复合膜由溶剂挥发致相分离方法制得,具体而言,一定量的羟丙基纤维素衍生物液晶充分溶解在一定体积的四氢呋喃(THF)中使液晶的质量体积分数为3%,形成均相溶液后,按不同比例加入干燥PU颗粒,磁力搅拌过夜使PU充分溶解。均相溶液在室温下浇注于Φ 60的玻璃培养皿中,盖上配套的培养皿,室温下放置于通风橱中至溶剂充分挥发。把复合膜转移到真空干燥箱中,在37℃、-1 MPa下减压干燥24 h使溶剂完全挥发,得到复合膜厚度约为200 μm。本实验中制备了不同比例的OPC/PU复合膜,其中OPC的质量分数分别为10%、30%和50%,分别记作10%膜、30%膜和50%膜。构建成功后,分别用偏光显微镜、扫描式电子显微镜及X射线衍射观察聚合物/液晶生物膜的表面特征。
2.2大鼠骨髓间充质干细胞分离与培养无菌条件下颈部脱臼法处死SD大鼠,75%乙醇浸泡5分钟。用手术剪剪开四肢皮肤取出股骨与胫骨,小心剔除肌肉与肌腱,接着用手术剪剪开骨的两端,用1 mL一次性注射器吸取无血清L-DMEM冲洗骨髓腔,至股骨、胫骨发白为止。收集冲洗液至15 mL离心管中,1 500 r/min离心5min,弃去上清液,加入12 mL含血清20%、青-链霉素1%、谷氨酰胺1%的LDMEM完全培养基吹打至单细胞悬液。接种在75T透气培养瓶内,置37℃、5% CO2、饱和湿度培养箱中培养。48 h后首次换液,待细胞融合至90%左右,以1∶2的比例进行传代培养。
2.3流式细胞术检测细胞表面因子流式细胞术检测rBM-MSCs的表面标志:取培养至第3代的rBM-MSCs,待细胞生长融合至80%时,0.25%的胰酶消化,获得单细胞悬液,并调整细胞密度为1×108/L;加入相应的表面标志物CD29、CD34、CD44、CD45和CD90的抗体,冰上避光孵育30 min。1 500 r/min,4℃离心5 min; PBS(含1 g/L BSA)洗涤细胞2次;加入300~400 μL PBS重悬细胞,过45 μm筛网后用流式细胞仪进行检测。
2.4 rBM-MSCs分化能力鉴定培养至第3代后的rBM-MSCs,经胰酶消化后以1×109/L的密度接种于6孔板中,用含10%胎牛血清的低糖DMEM培养液培养24 h后更换为分化诱导培养液。成骨诱导培养基为:含体积分数10%胎牛血清的低糖DMEM,0.52×10-7g/L地塞米松,0.89×10-2g/L抗坏血酸,3.06 g/L β-甘油磷酸钠;成脂诱导培养基为:含10%胎牛血清的低糖DMEM培养液,0.11×10-3g/L IBMX(3-异丁基-1-甲基黄嘌呤),0.52×10-6g/L地塞米松,0.58×10-2g/L胰岛素;对细胞进行成骨成脂分化诱导时每隔3 d更换1次诱导液,诱导2周后分别进行茜素红S染色和油红O染色。
2.5细胞骨架染色调整细胞密度为5×107/L,均匀种于不同的实验组上(纯PU对照组,10%膜组,30%膜组和50%膜组)。待细胞贴壁24 h后,去掉培养液,用多聚甲醛固定细胞10 min,固定完毕后用PBS轻轻清洗1遍;室温下加入通透性缓冲液处理5 min,再用PBS冲洗1遍;把所有样品移至潮湿暗房中进行rhodamine phalloidin染色30 min,染色完毕,接着用PBS冲洗3遍;再用DAPI进行复染DNA 5 min,PBS冲洗3遍;把膜移至载玻片上,注意正面朝上,往膜上滴加1滴抗淬灭剂,盖上盖玻片后,用透明指甲油进行封片;染色处理完毕之后黑暗保存于4℃中,待进行激光共聚焦显微镜观察拍照。
3统计学处理
用SPSS 13.0统计软件分析。数据用均数±标准差(mean±SD),采用Leven’s方差齐性检验与独立样本t检验。以P<0.05为差异有统计学意义。
结果
1聚合物/液晶细胞模型的构建
1.1偏光显微镜检测复合膜表面特征当液晶混合聚氨酯后,所有的PU/OPC复合膜上都出现分散良好的双折射现象,展现出液晶相形成的亮点。OPC域的大小和数量随着液晶结构域的增加而增加。OPC域的点状均匀地分布在PU/OPC复合膜上。上述结果表明当OPC结合到PU基底上后,复合膜上发生的相分离源于两者组分的不相容性。OPC的化学结构包含了循环碳和柔性侧链。OPC展现出的半刚性链结构是因为它较长的柔性侧链,同时,这些长的侧链可以与PU链的柔性部分相互缠绕,这促进了OPC域在复合膜上的均匀分布,见图1。

Figure 1.Surface morphology and phase separation structure investigated by polarized optical microscopy.图1偏光显微镜观察生物膜的表面特征

Figure 2.Surface morphology and phase separation structure investigated by scanning electron microscopy.图2扫描式电子显微镜观察生物膜的表面特征
1.2扫描式电子显微镜观察复合膜表面特征所有膜的表面形状是通过扫描电镜观察得到的。纯的PU基本没有任何结构,表面平整,而复合膜表面粗糙,且有一个两相形状。这相互交错的网状织构和胆甾型液晶的特征油状结构非常相像。从PU/OPC复合膜来看,当液晶含量比较低时,OPC域分散在膜上显示出良好的指纹结构,这代表着少含量的液晶排列成有序的相态。随着OPC含量的增加,指纹构型逐渐变大、变密,并相互连接在一块,见图2。 1.3 X射线衍射观察复合膜表面特征对于纯PU膜,由于软缎的排列,2θ在10°和20°的衍射峰是PU半结晶性的特征峰。纯OPC的衍射图谱上相近的位置也出现2个宽而平缓的衍射峰,这是由于高分子液晶分子排列的准长程序引起的。对于PU/OPC复合膜,相应的峰随着液晶含量的增加变得更加宽阔和扁平。这表明PU基底中引入的OPC可能会改变最初的结晶行为。有趣的是,当PU/OPC复合膜中的OPC含量增至50%的时候,2θ在20°处的结晶峰几乎消失。很有可能是在PU和OPC的复杂系统中,PU中硬段和软段以及硬段和硬段之间的氢键在引入液晶相后部分断裂,从而影响了PU的结晶度。PU的软段可能会通过它们较长的柔软的侧链缠绕在一起,这更加干扰了PU的结晶度。特别是当OPC含量接近50%的时候,在基底上发生了很大程度的自聚集和形成了连续的液晶相。这样,PU的结晶结构很大程度上被破坏,并在2θ为20°处的衍射峰就消失了,见图3。
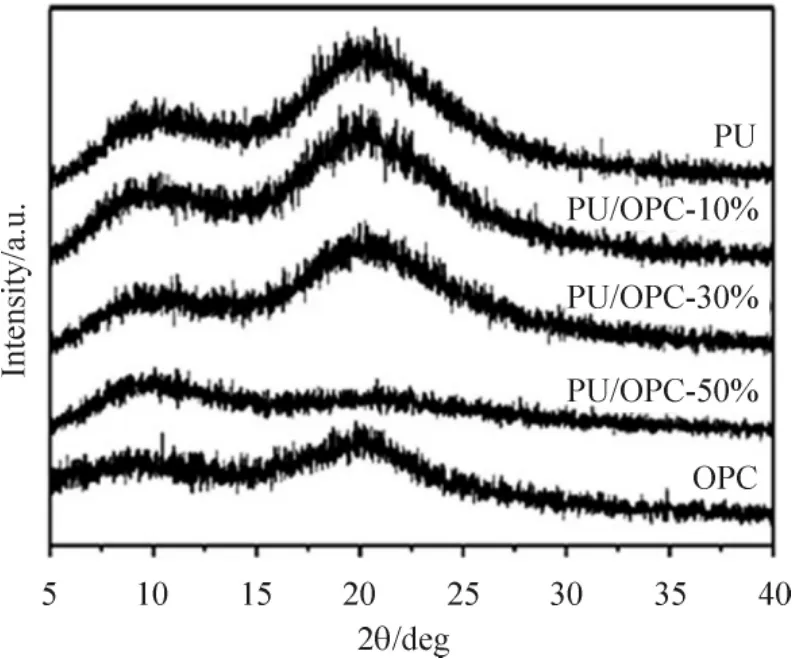
Figure 3.Surface morphology and phase separation structure investigated by small angle X-ray scattering.图3 X射线衍射观察生物膜的表面特征
2 rBM-MSCs的分离与鉴定
2.1 rBM-MSCs的传代、扩增与纯化全骨髓细胞贴壁培养法分离rBM-MSCs。将细胞悬液接种于75 cm2塑料培养瓶中,培养24 h后细胞开始贴壁,72 h后进行首次换液,此时可见梭形细胞贴壁生长。随着时间的增长,可见培养瓶内呈克隆样生长的细胞团越来越多。待细胞融合90%左右,约需14 d,经0.25%的胰酶消化后,将细胞吹打成单细胞悬液,以1∶2的比例进行传代。首次细胞融合所需时间较长,且早代的rBM-MSCs中存在较多的杂细胞;往后细胞融合相对较快,约每4~5 d进行1次传代。连续传代3~4次后,rBM-MSCs趋于纯化。此时细胞不但纯度较高,且增殖能力旺盛,故本实验均采用第3代BMSCs进行后续的实验处理,见图4。

Figure 4.Morphology of rat bone marrow mesenchymal stem cells (×100).图4不同代的大鼠骨髓间充质干细胞形态
2.2 rBM-MSCs表面标记物表达流式细胞仪检测结果显示,培养至第3代的rBM-MSCs表达CD29、CD44和CD90的阳性率分别为99.19%、95.59%和99.97%;而表达CD34和CD45的阳性率分别为1.26% 和0.65%,见图5。
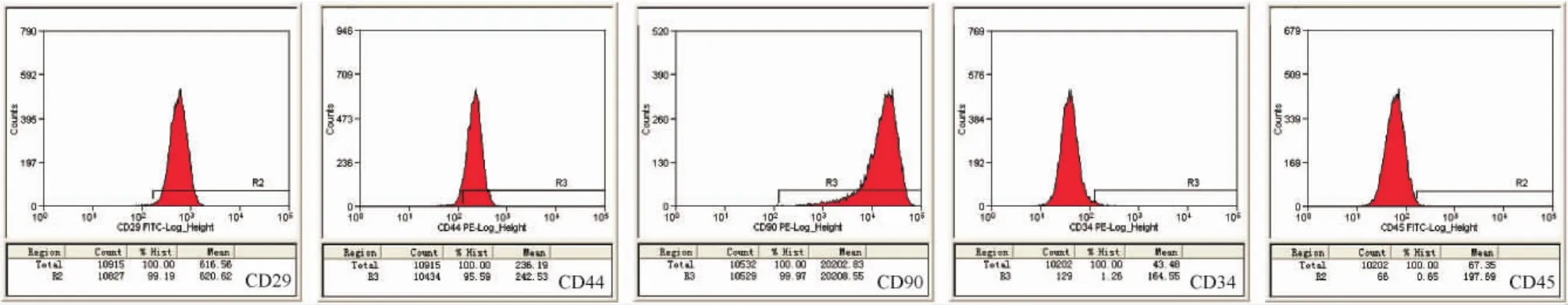
Figure 5.The flow cytometry results of cell surface markers on rBM-MSCs at passage 3.图5流式细胞仪检测rBM-MSCs表面因子表达
2.3 rBM-MSCs的分化能力鉴定第3代rBMMSCs经成骨诱导分化后,用茜素红S染色,可以看到大量红色钙化基质;同样第3代rBM-MSCs经成脂诱导分化后,用油红O染色,可见细胞内有明显的红色脂滴,表明本课题组所分离的细胞均具有向成骨和成脂分化的潜能,见图6。
3 rBM-MSCs在生物膜上的贴壁状况

Figure 6.Staining of osteogenic cells (alizarin red S staining,×100) and adipogenic cells (oil red O staining,×200).图6培养至第3代的rBM-MSCs成骨和成脂分化
不同的细胞外基质,影响着细胞的附着形态、延伸状况以及细胞贴壁密度等[13]。本实验为了检测不同OPC含量的聚合物/液晶生物膜对rBM-MSCs贴壁状况的影响,我们将rBM-MSCs培养至第3代时,使用0.25%的胰酶进行消化,将细胞吹打成单细胞悬液,并调整细胞密度为5×107/L,将细胞均匀种在含液晶10%、30%和50%的生物膜上,设纯PU组作为空白对照组。由于生物膜的不透性,所以待细胞贴壁24 h后,使用rhodamine phalloidin对细胞骨架进行染色,使用DAPI对细胞核进行复染。染色完毕,在激光共聚焦显微镜下对不同实验组进行观察并拍照,见图7。结果显示,纯PU对照组,10%膜组和30%膜组上的rBM-MSCs呈现出明显的应力纤维,细胞铺展面积较广,另外,细胞内肌动蛋白微丝细长连续,细胞核清晰可见;而50%膜组上的rBMMSCs则呈现出椭圆形状,且细胞铺展面积普遍较小,同时,rBM-MSCs的细胞核明显,但肌动蛋白微丝模糊不清。明显地,液晶含量适当的生物膜可以支持并促进rBM-MSCs的贴壁黏附和成活,而液晶含量过高则不利于细胞的附着生长。
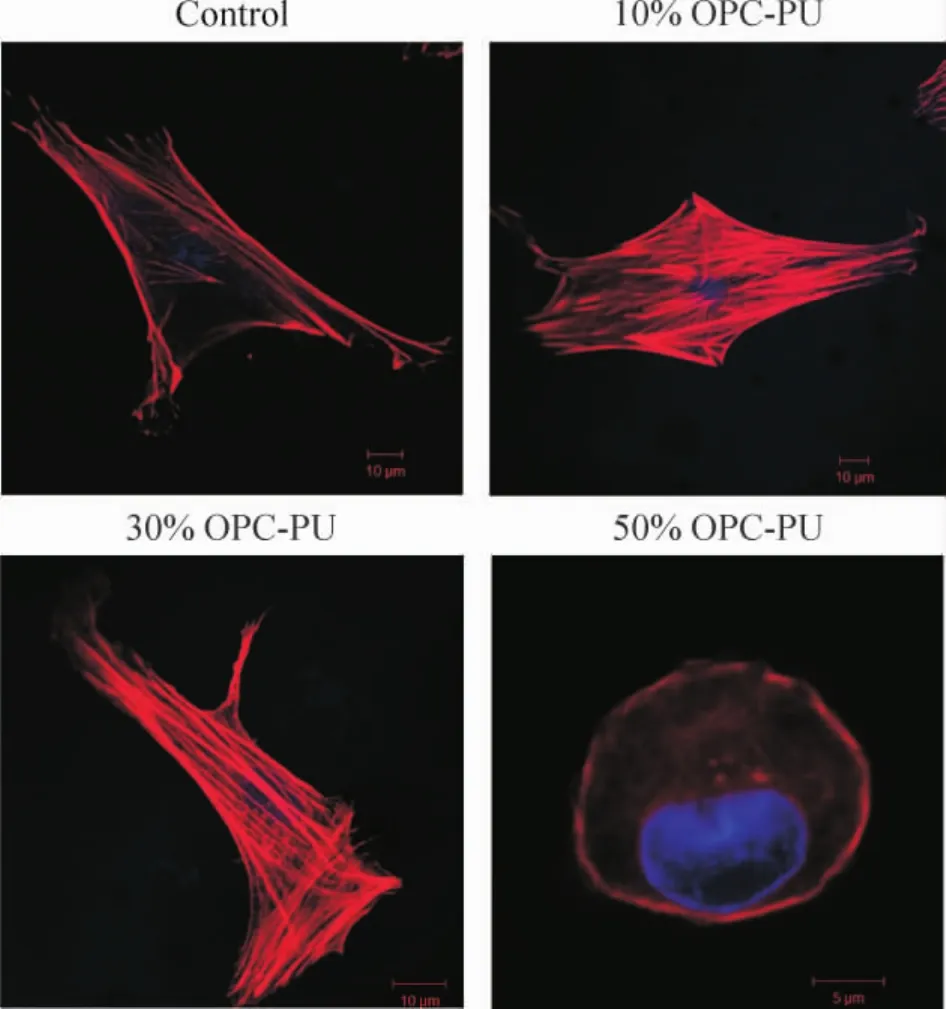
Figure 7.Morphology of rat bone marrow mesenchymal stem cells taken by confocal laser scanning microscopy.图7不同实验组的细胞骨架染色图
讨论
近年来,天然的和合成的基质已用于制作具有已知弹性模量(硬度)的细胞培养基质,目的是研究如何控制细胞行为,即细胞在材料表面的黏附、增殖和分化。而细胞和固体表面的相互作用通过控制表面化学、拓扑形貌特征、基质材料的弹性和顺从性及这些参数的整合已被工程化。因此,设计一种可展示柔软性和坚韧性的基质材料作为软物质细胞模型,研究探索基质弹性对细胞行为的影响对于组织工程用生物材料的发展具有重要的科学意义。已有报道显示调控生物材料适宜的表面特性,具有维持细胞正常表型和功能,并且可以促进细胞贴壁,活化,生长,分化以及影响其分泌功能[14-17]。本实验运用溶剂挥发致相分离方法成功构建聚合物/液晶生物膜,偏光显微镜检测复合膜表面的结果表明当OPC结合到PU基底上后,复合膜上发生的相分离源于两者组分的不相容性。扫描式电子显微镜观测复合膜表面结果显示,随着OPC含量的增加,指纹构型逐渐变大和变密,并相互连接在一块。X射线衍射观察复合膜表面的结果显示,对于PU/OPC复合膜,相应的峰随着液晶含量的增加变得更加宽阔和扁平,表明PU基底中引入的OPC可能会改变最初的结晶行为。
目前很多研究已表明,大鼠骨髓间充质干细胞具备提取方便,易于纯化,扩增能力强以及容易诱导向成骨方向分化等优点[9-12]。在我们的实验中,模仿已报道文献中的分离方法,使用全骨髓细胞贴壁培养法从大鼠股骨骨髓腔中分离rBM-MSCs,通过传代培养纯化细胞,获得具有明显梭状形态的rBMMSCs,流式细胞仪检测细胞的表面因子结果显示CD29、CD34、CD44、CD45和CD90的阳性表达率均符合rBM-MSCs的特点;除此之外,从诱导分化的结果看出所分离的细胞都具有向成骨成脂分化的潜能。因此,种种鉴定结果充分说明了我们所分离的细胞就是rBM-MSCs。
最近的研究表明,不同硬度的细胞外基质与机体内肌动蛋白的收缩性有密切关系[18-19]。细胞附着在生物材料上,会随着附着表面的物理和化学性质的不同而存在着很大的差异性。如附着材料的分子特性、硬度等都会对细胞贴壁的形态、密度、迁移特性以及基因表达等都会造成不同的影响[20-22]。本实验中同一时点的细胞骨架染色结果显示,纯PU对照组、10%膜组和30%膜组上的细胞呈现出铺展面积较广,肌动蛋白微丝和细胞核清晰明显;而50%膜组的细胞铺展面积较小,细胞核虽较清晰,但是肌动蛋白微丝却模糊不清。液晶含量不同意味着膜表面弹性不同,说明只有合适的表面弹性才能有助于BMSCs的贴壁黏附和成活,表面弹性过高则不利于rBM-MSCs的附着生长。
运用溶剂挥发致相分离方法可成功构建聚合物/液晶生物膜。适当含量的聚合物/液晶生物膜能支持大鼠骨髓干细胞的贴壁生长、呈现原有的长梭状细胞形态;但液晶含量过高则不利于细胞的附着生长。
[参考文献]
[1]Hollister SJ.Porous scaffold design for tissue engineering [J].Nat Mater,2005,4(7) : 518-524.
[2]Nagahama K,Ueda Y,Ouchi T,et al.Exhibition of soft and tenacious characteristics based on liquid crystal forma-tion by introduction of cholesterol groups on biodegradable lactide copolymer[J].Biomacromolecules,2007,8 (12) :3938-3943.
[3]Gould P.Liquid crystals track stem cells: biomaterials [J].Mater Today,2006,9(5) :19.
[4]Basova T,Paul S,Paul D,et al.Liquid crystalline phthalocyanine thin films as nanoscale substrates for protein adsorption[J].J Bionanosci,2008,2(2) : 114-118.
[5]Rey AD.Mechanics of soft-solid-liquid-crystal interfaces [J].Phys Rev E Stat Nonlin Soft Matter Phys,2005,72 (1 Pt 1) :011706.
[6]Shin H.Fabrication methods of an engineered microenvironment for analysis of cell-biomaterial interactions[J].Biomaterials,2007,28(2) :126-133.
[7]Sands RW,Mooney DJ.Polymers to direct cell fate by controlling the microenvironment[J].Curr Opin Biotechnol,2007,18 (5) :448-453.
[8]Wong JY,Leach JB,Brown XQ.Balance of chemistry,topography,and mechanics at the cell-biomaterial interface: issues and challenges for assessing the role of substrate mechanics of cell response[J].Surface Sci,2004,570(1-2) :119-133.
[9]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cell[J].Science,1999,284(5411) :143-147.
[10]Ohgushi H,Dohi Y,Katuda T,et al.In vitro bone formation by rat marrow cell culture[J].J Biomed Mater Res,1996,32(3) :333-340.
[11]Kadiyala S,Young RG,Thieda MA,et al.Culture expanded canine mesenchymal stem cells possess osteochondrogenic potential in vivo and in vitro[J].Cell Transplant,1997,6(2) :125-134.
[12]Johnstone B,Hering TM,Caplan AL,et al.In vitro chondrogenesis of bone marrow-derived mesenchymal progenitor cells[J].Exp Cell Res,1998,238(1) :265-272.
[13]Prager-Khoutorsky M,Lichtenstein A,Krishnan R,et al.Fibroblast polarization is a matrix-rigidity-dependent process controlled by focal adhesion mechanosensing[J].Nat Cell Biol,2011,13(12) :1457-1478.
[14]Guo JB,Sun J,Cao H,et al.Synthesis and characterization of functionalized triblock polymer: the prepared polymer is cholesteryl terminated and chain-extended PCL [J].J Appl Polym Sci,2007,105(6) :3505-3512.
[15]Lockwood NA,Mohr JC,Ji L,et al.Thermotropic liquid crystals as substrates for imaging the reorganization of matrigel by human embryonic stem cells[J].Adv Funct Mater,2006,16(5) :618-624.
[16]Shih MF,Shau MD,Chang MY,et al.Platelet adsorption and hemolytic properties of liquid crystal/composite polymers[J].Int J Pharmaceut,2006,327 (1-2) :117-125.
[17]Xu JP,Ji J,Wang XL,et al.The effect of formation of the liquid crystalline phase on the blood compatibility of a cholesterol modified silicone[J].J Mater Sci Mater Med,2005,16 (3) :277-282.
[18]Fouchard J,Mitrossilis D,Asnacios A,et al.Acto-myosin based response to stiffness and rigidity sensing[J].Cell Adh Migr,2011,5(1) :16-19.
[19]Walcott S,Sun SX.A mechanical model of actin stress fiber formation and substrate elasticity sensing in adherent cells[J].Proc Natl Acad Sci U S A,2010,107(17) : 7757-7762.
[20]Hoffman BD,Grashoff C,Schwartz MA.Dynamic molecular processes mediate cellular mechanotransduction[J].Nature,2011,475(7356) : 316-323.
[21]Goffin JM,Pittet P,Csucs G,et al.Focal adhesion size controls tension-dependent recruitment of alpha-smooth muscle actin to stress bers[J].J Cell Biol,2006,172 (2) : 259-268.
[22]Stricker J,Aratyn-Schaus Y,Oakes PW,et al.Spatiotemporal constraints on the force-dependent growth of focal adhesions[J].Biophys J,2011,100(12) :2883-2893.
通讯作者△Tel: 020-85220256; E-mail: zhangjiaqing@ jnu.edu.cn
*[基金项目]国家自然科学基金资助项目(No.31170911) ;澳门科学技术发展基金(No.064/2013/A2)
[收稿日期]2014-12-12
[文章编号]1000-4718(2015)06-1064-06
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.017
