聚乙烯亚胺-蛋白纳米复合体转染蛋白进入骨髓间充质干细胞的应用研究*
2015-03-30吴岳恒李晓红杨翔宇余细勇南方医科大学广东广州5055广东省人民医院广东省医学科学院广东省心血管病研究所广东省人民医院风湿免疫科广东广州50080
姜 霖,吴岳恒,李晓红,潘 宇,肖 静,杨翔宇,冯 媛,余细勇△(南方医科大学,广东广州5055;广东省人民医院/广东省医学科学院,广东省心血管病研究所,广东省人民医院风湿免疫科,广东广州50080)
聚乙烯亚胺-蛋白纳米复合体转染蛋白进入骨髓间充质干细胞的应用研究*
姜霖1,2,吴岳恒2,李晓红2,潘宇2,肖静2,杨翔宇2,冯媛3,余细勇2△
(1南方医科大学,广东广州510515;2广东省人民医院/广东省医学科学院,广东省心血管病研究所,3广东省人民医院风湿免疫科,广东广州510080)
[摘要]目的:探索纳米材料聚乙烯亚胺(PEI)携载不同分子量的蛋白质转染进人骨髓间充质干细胞(hBMSCs)的作用及优化其最佳配比条件。方法:利用物理化学作用构建6组PEI-DNase I(DNA酶I)复合体,运用激光散射技术初步摸索其最佳摩尔比,用透射电镜直观复原纳米-蛋白复合体外貌;同时,原代分离培养健康人的骨髓间充质干细胞并进行体外扩增,通过构建成功的4组PEI-GFP(绿色荧光蛋白)纳米蛋白复合体对hBMSCs进行转染,共聚焦荧光显微镜下观察荧光表达情况,再通过MTT法检测该复合体对细胞增殖的毒性影响,并用β-半乳糖苷酶实验验证其转入蛋白的活性表现。结果:当PEI与蛋白质的摩尔比为4∶1时,形成的复合体转染效率最高,β-半乳糖苷酶实验细胞染色变蓝。结论: PEI能与蛋白质形成纳米复合体,并能转染多种蛋白质进入人骨髓间充质干细胞,所转染的蛋白质分子仍具有活性,为细胞重编程技术提供了新途径。
[关键词]聚乙烯亚胺;骨髓间充质干细胞;蛋白质转染
[修回日期]2015-04-23
Proteins are transfected into bone marrow mesenchymal stem cells by polyethyleneimine-protein nano-complexes
JIANG Lin1,2,WU Yue-heng2,LI Xiao-hong2,PAN Yu2,XIAO Jing2,YANG Xiang-yu2,FENG Yuan3,YU Xi-yong2
(1Southern Medical University,Guangzhou 510515,China;2Guangdong Cardiovascular Institute,Guangdong General Hospital/Guangdong Academy of Medical Sciences,3Department of Rheumatology,Guangdong General Hospital,Guangzhou 510080,China.E-mail: yuxycn@ aliyun.com)
[ABSTRACT]AIM: To investigate the role of encapsulated protein transfected into human bone marrow mesenchymal stem cells (hBMSCs) by polyethyleneimine (PEI),and to optimize the best mole ratio of PEI-proteins.METHODS: 6 groups of DNase I-PEI complexes were constructed and the best mole ratio was explored by laser scattering analysis.The appearance of complexes was presented under transmission electron microscope.Meanwhile,4 groups of constructed GFP-PEI complexes were utilized to transfect into the hBMSCs,which were isolated and expand in vitro.The fluorescence intensity of transfected cells was observed under confocal microscope.In addition,the cytotoxicity of the complexes on the cell proliferation was detected by MTT assay.The activity of the intracellular proteins was testified by a β-galactosidase staining experiment.RESULTS: When the mole ratio of PEI and protein was adjusted to 4∶1,the complex transfection efficiency was the best,and β-galactosidase color test turned blue.CONCLUSION: PEI has the character of encapsulating various proteins to nano-complexes.The proteins transfected into bone marrow mesenchymal stem cells are confirmed to have functional activity.As a protein carrier,PEI is of high efficiency and low toxicity,thus providing a new way for stem cell reprogramming.
[KEY WORDS]Polyethyleneimine; Bone marrow mesenchymal stem cells; Protein transfection
蛋白质转染技术是一门新兴的转染技术,是直接把蛋白质转入活细胞的过程。目标蛋白质一般要在载体的帮助下,与载体形成复合体而被转染进入细胞内。蛋白质转染进入细胞有非常重要的科研价值和应用前景,主要研究有: (1)蛋白质-蛋白质相互作用; (2)细胞内信号传导、细胞周期调控、细胞凋亡、肿瘤发生和转录调节; (3)未知蛋白质的功能; (4)干细胞重编程等转化医学领域; (5)功能性转录因子的递送和癌症治疗[1-4]。蛋白质转染技术的提出,不仅在方法学上促进了该领域及相关领域的发展,并且拓展了人们对外源性蛋白质分子在哺乳动物细胞中表达与调控的应用。
目前有关蛋白质载体进入细胞研究的报道较少,主要原因之一是基因转染的普及和成熟,因为将基因转染进细胞后会翻译成蛋白质,且已有大量性能稳定的基因转染载体,如病毒、脂质体、纳米载体如聚乙烯亚胺(polyethyleneimine,PEI)等。其中病毒效率最高,但有不可控风险,脂质体一般认为对细胞毒性较大,而纳米载体因为尺寸效应和非病毒性,一般认为比较有潜力成为更安全可靠的基因载体,所以本领域的研究通常集中在对纳米载体改性,如在不增加载体细胞毒性的前提下,提高基因转染的效率[5]。
那么就蛋白质转染而言,科学家们曾尝试使用阳离子脂质体、穿膜肽(cell-penetrating peptide,CPP)、多聚赖氨酸(poly-L-lysine,PLL)[6-7]等物质来运载蛋白质进入细胞,但受其转染效率及细胞毒性的影响,大大限制了它们的应用,而且主要应用的细胞种类较少,基本没有应用于干细胞领域。目前,基于阳离子的纳米载体PEI被认为是最有前途的蛋白载体工具之一,其转染效率高,分子量易于控制,安全性较佳,结构灵活,易于引入特异性靶向基团对复合体进行修饰从而改善性能。本研究通过构建聚乙烯亚胺-蛋白纳米复合体(PEI-protein nano-complexes),观察PEI能否转染不同分子量的蛋白质进入人骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hBMSCs),并考察转染的蛋白质是否具有活性。
材料和方法
1材料
1.1骨髓来源取自广东省人民医院风湿科20~40岁受试者髂前上棘,术前受试者签署知情同意书。
1.2试剂与仪器人骨髓间充质培养基购自广州赛业生物科技有限公司; PEI和β-半乳糖苷酶购自Sigma; DNA上样缓冲液和DNA marker购自TaKa-Ra; DNase I购自北京康为世纪生物科技有限公司;绿色荧光蛋白(green fluorescent protein,GFP)购自义翘神州生物技术有限公司; Hoechst 33342、PBS购自Life Technologies;β-半乳糖苷酶染色试剂盒套装购自碧云天生物技术有限公司; MTT细胞增殖检测试剂盒购自南京凯基生物科技有限公司;精密电子天平购自SHIMADZU;激光共聚焦显微镜购自Leica;流式细胞仪购自Beckman。
2方法
2.1 hBMSCs的分离、培养及体外扩增采用全骨髓贴壁法,取20~40岁健康人髂前上棘内骨髓3 mL(涂片有骨髓小粒为佳),混匀后直接加入5 mL复温后的人骨髓间充质培养基中(10% FBS),于5% CO2、37℃培养。72 h后,换PBS溶液清洗3次,常规培养。约7~10 d后,原代细胞贴壁充分,生长融合接近90%后,用0.02% EDTA+ 0.25%胰酶消化成单细胞悬液,1∶3进行传代。
2.2 hBMSCs的表型鉴定取第3代的hBMSCs消化形成单细胞悬液,用PBS溶液清洗1次,1 200 r/min离心3 min后再用PBS重悬细胞,调整浓度为1×109/L。接着,在收获的干细胞悬液中分别加入荧光素标记的抗体: FITC-anti human CD45、CD90和CD44; PE-anti human CD29、CD33、CD34、CD105和CD117。混匀后,除CD117于4℃冰箱中孵育30 min,其余皆在室温下孵育30 min,后1 200 r/min离心3 min,弃去上清,用PBS清洗1次,直接上FACSCalibur流式细胞仪检测。
2.3 PEI-DNase I复合体和PEI-GFP复合体的构建
PEI-DNase I复合体设为4个处理组,分别加入200 μL 100 mg/L的DNase I溶液,每组再依次加入3.4 μL、1.7 μL、0.9 μL和0.5 μL的PEI溶液的原溶液(8 g/L),即各组纳米粒子与蛋白质的摩尔比依次为16∶1、8∶1、4∶1和2∶1,最后用PBS定容至400 μL,4℃过夜搅拌。
PEI-GFP复合体同样设为4个处理组,分别加入200 μL 100 mg/L的GFP蛋白溶液和200μL的PBS溶液,接着每组依次加1.6 μL、0.8 μL、0.4 μL和0.2 μL的PEI溶液的原溶液(8 g/L),即各组纳米粒子与蛋白质的摩尔比值依次为16∶1、8∶1、4∶1和2∶1,4℃过夜搅拌。
2.4 PEI-DNase I复合体的激光散射粒径测试和透射电镜观察在激光散射粒径测试中,单独PEI对照组为1 g/L的PEI溶液,单独DNase I对照组为50 mg/L的DNase I溶液,其余4个处理组分别为上述构建的PEI-DNase I复合体(其摩尔比为2∶1、4∶1、8∶1和16∶1)溶液。经过50 Hz水浴超声20 s后,各取400 μL加入预先润洗过的激光散射比色皿中,盖上两侧盖子,进行测试。
可选择上述构建的纳米-蛋白质复合体中摩尔数比值为4∶1组,滴加超声后的复合体液体50 μL于铜网上,干燥后在透射电镜下观察复合体形态。
2.5 PEI-GFP复合体转染hBMSCs的荧光效果图及细胞增殖毒性的检测如上述,构建而成的4组PEI-GFP复合体溶液蛋白原始浓度为50 mg/L,在3 cm confocal小皿中接种第3代的hBMSCs,待细胞长满至70%左右,则可用含有PEI-GFP复合体(蛋白终浓度为5 mg/L)的培养基进行转染,即450 μL培养基中分别添加4组50 μL 50 mg/L的PEI-GFP复合体溶液,5% CO2、37℃培养24 h后,弃去培养基,用PBS溶液清洗3次,每次5 min,接着复染Hoechst 33342 5 min,再用PBS溶液清洗3次,每次5 min,可将活细胞放至激光共聚焦显微镜下观察转入GFP的荧光表达强弱。
在96孔板里接种hBMSCs 100 μL(约1×104),置于5% CO2、37℃细胞培养箱中培养24 h;设为7个浓度组:每孔分别加入终浓度为64、32、16、8、4、2 和1 mg/L的PEI-GFP复合体(直接用培养基稀释,浓度按蛋白浓度计,PEI-GFP摩尔比为4∶1),继续放置于5% CO2、37℃及100%湿度的培养箱中孵育,于第3天时收板,吸弃培养基,每孔加入50 μL 1× MTT溶液,在37℃孵育4 h,使MTT还原为甲臜;后吸出上清液,每孔加入150 μL DMSO使甲臜溶解,用平板摇床摇匀;酶标仪550 nm波长处检测每孔的吸光度。
2.6 β-半乳糖苷酶实验检测PEI复合的蛋白质转入细胞后的表达活性称取1 mg的β-半乳糖苷酶粉末,用1 mL PBS溶解,配置成1 g/L的酶溶液,加入5.2 μL的PEI原溶液(8 g/L),混匀后4℃搅拌30 h,构建PEI-β-半乳糖苷酶复合体。在12孔板中接种第3代的hBMSCs,待细胞长满至70%左右,用含有PEI-β-半乳糖苷酶复合体(蛋白浓度为50 mg/L)的培养基进行转染,即1 mL培养基中添加50 μL 1 g/L的PEI-GFP复合体溶液,5% CO2、37℃培养48 h(前6 h不加血清处理,后加10%血清),后吸除细胞培养基,加入500 μL试剂盒内的细胞固定液,室温固定10 min,吸去固定液,PBS清洗3次,每次3 min,每孔加入1 mL染色液,37℃孵育过夜,在普通光学显微镜下观察细胞染色情况。
3统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(one-way ANOVA),多重比较采用LSD-t检验,以P<0.05为差异有统计学意义。
结果
1不同配比下构建的PEI-DNase I复合体的粒径检测结果
激光散射粒径检测结果显示,当PEI与DNase I的摩尔比为1∶2和1∶16时,几乎不能形成复合体的结构;而当PEI与DNase I的摩尔比在1∶4和1∶8时,激光散射强度结果很明显地显示溶液相里形成了众多几百纳米的复合体物质;相较1∶8的配比条件,复合体在1∶4配比下的粒径更加小(<500 nm),且分布更加均匀,见图1。
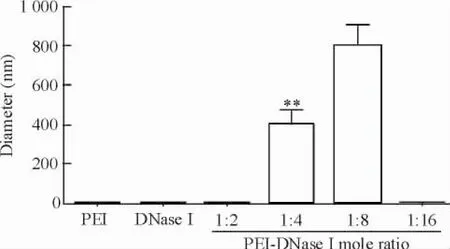
Figure 1.The laser scattering diameter test of different mole ratios of PEI-DNase I complexes.Mean±SD.n=3.**P<0.01 vs other guoups.图1不同摩尔比下PEI-DNase I复合体的激光散射粒径检测
2合适摩尔比下PEI-DNase I复合体的透射电镜结果
由激光散射粒径检测可知PEI与DNase I较佳的摩尔配比条件,因此,我们选择了配比为4∶1时构建的PEI-DNase I复合体做透射电镜观察,从大体观,合成的复合体粒子均匀散布,大部分呈致密的球状体,而从局部观,粒子大小较为一致,其直径大约在200~500 nm,而对照组PEI纳米粒子在电镜下则较难成像,理论上其粒径大约在0.5~10 nm左右,见图2。
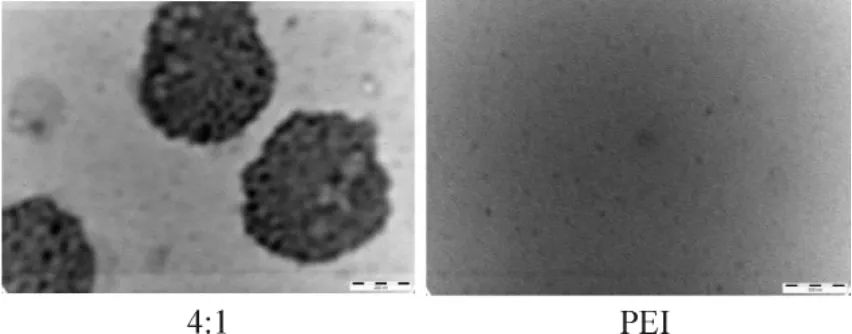
Figure 2.The appearance of PEI-DNase I complexes in best mole ratio (4∶1) under TEM (×93 000).图2 PEI与DNase I的摩尔比为4∶1时构建的PEI-DNase I复合体透射电镜图
3人骨髓间充质干细胞的表型鉴定
hBMSCs表达CD29、CD33、CD34、CD44、CD45、 CD90、CD105和CD117的百分率分别为(99.11± 0.60) %、(98.70±0.90 ) %、(0.32±0.20 ) %、(97.87±1.40) %、(0.22±0.20) %、(56.20± 11.20) %、(97.32±1.60) %和(0.27±0.10) %。其中,CD29、CD33、CD44和CD105为阳性表达,而CD34、CD45和CD117基本为阴性表达,CD90的表达不稳定,浮动较大。CD29和CD44都是骨髓间充质干细胞的公认的标志,CD34则为造血干细胞的主要标志之一,CD45为白细胞的标志物,CD117近来多用于心脏干细胞的表型认证。因此,根据流式细胞检测得到的结果,可以得出原代分离出的hBMSCs性质较为均一,具有骨髓间充质干细胞的表型特征,见图3。
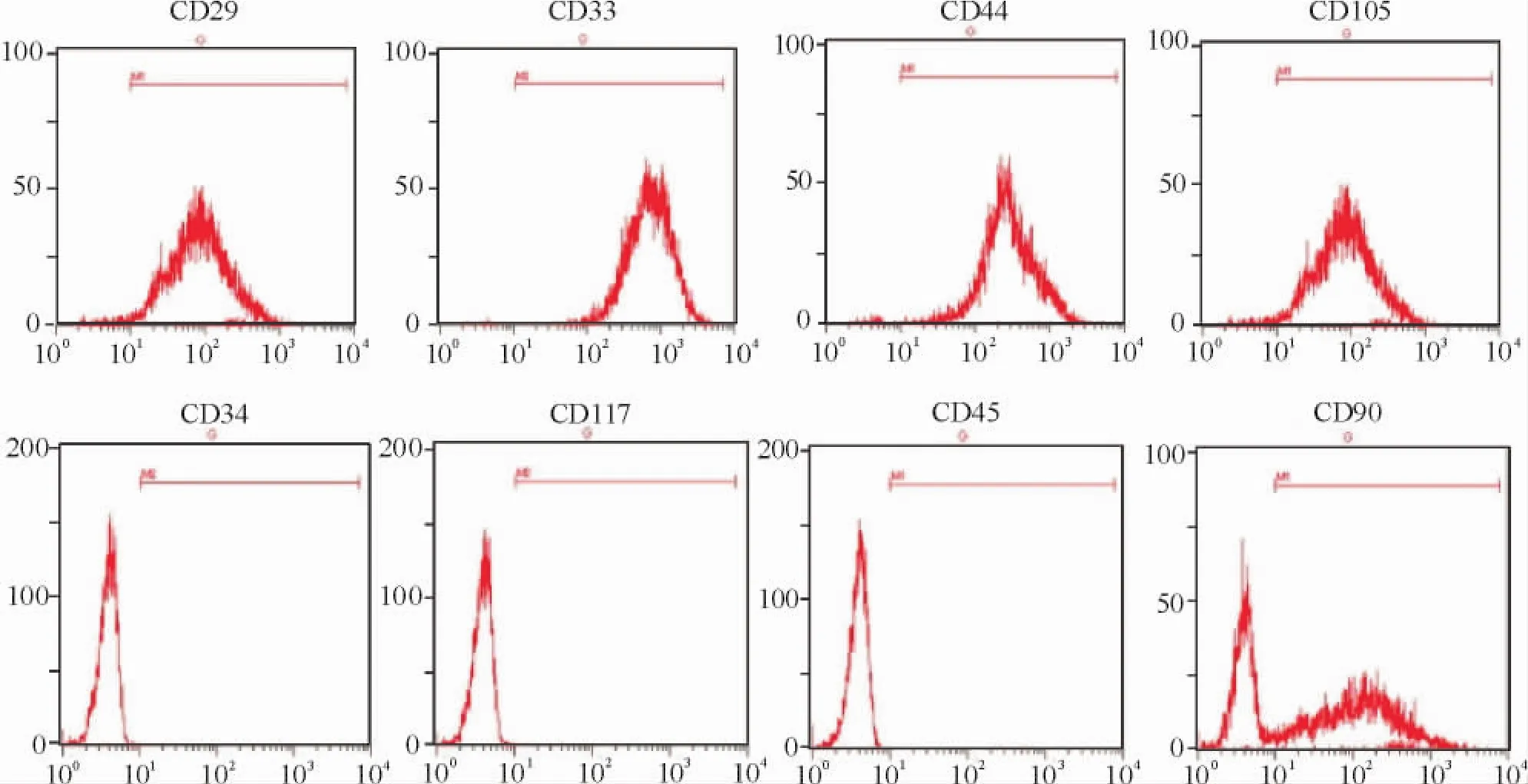
Figure 3.Phenotype of hBMSCs detected by flow cytometer.图3流式细胞术检测hBMSCs的表面标志
4构建的PEI-GFP蛋白复合体粒子转染骨髓间充质干细胞
当PEI与GFP配比合适时,PEI能够以复合体的形式高效携载GFP蛋白穿膜并在胞内释放并表达GFP,从而显示出绿色荧光。当PEI与GFP蛋白的摩尔比为2∶1时,PEI就不足以携载GFP蛋白而不能形成完整的复合体,因此荧光表达明显偏低;而PEI与GFP蛋白配比相对较高时,多余的PEI可能会影响二者的自组装过程,并且PEI表面大量的正电荷可能会影响细胞引起细胞的聚集效应,综合这些因素,当PEI与GFP蛋白粒子的摩尔比为4∶1时,进入细胞的GFP荧光表达量较多,且通过荧光表达可见PEI-GFP复合体对hBMSCs的转染效率几乎为100%,见图4。
5 MTT法检测hBMSCs经PEI-GFP复合体转染后的细胞增殖能力
分别将7组不同浓度的PEI-GFP复合体转染hBMSCs,3天后利用MTT法对处理的细胞进行增殖毒性的检测。复合体的转染对细胞的存活率存在一定的影响,当1 mg/L的复合体转染hBMSCs时,其存活率大约下降20%,若以此为对照,当转染的复合体浓度高于4 mg/L时,复合体对细胞的毒性作用就有明显的统计学意义,随着复合体转染浓度的提高,其对hBMSCs增殖的影响也就越来越大,也就意味着毒性作用增大,当高于32 mg/L时,被处理的细胞基本没有了增殖活性,见图5。
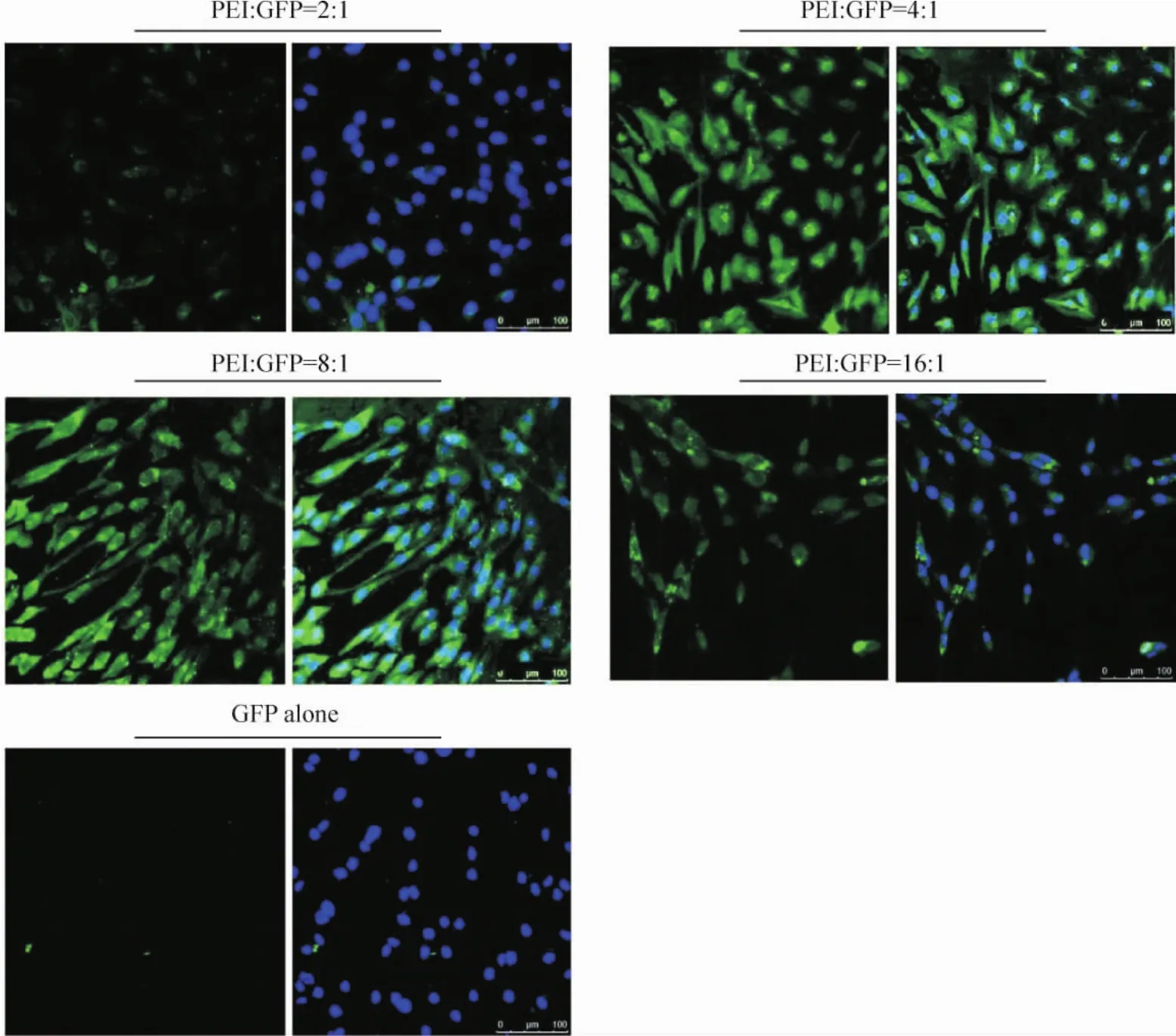
Figure 4.The fluorescence expression of PEI-GFP complexes constructed by 4 mole ratios after transfected into hBMSCs.图4 4种摩尔比的PEI-GFP复合体转染hBMSCs后的荧光表达情况
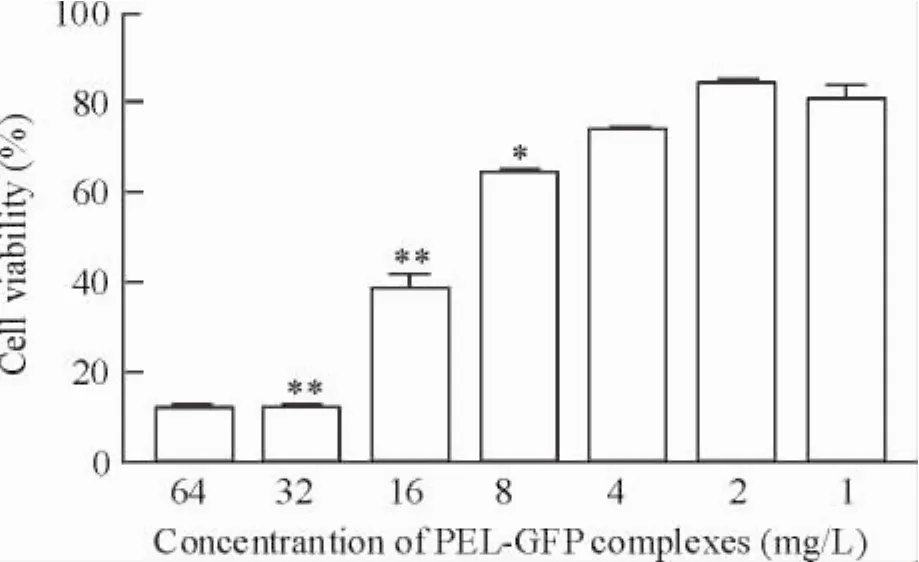
Figure 5.Detection of cytotoxicity by MTT method on the 3th day.Mean±SD.n=3.*P<0.05,**P<0.01 vs 1 mg/L.图5 MTT法检测不同浓度的PEI-GFP复合体转染hBMSCs后的细胞增殖毒性
6显色实验验证转入hBMSCs的β-半乳糖苷酶活性
理论上,β-半乳糖苷酶能够作用于底物X-Gal从而显蓝色,当PEI-β-半乳糖苷酶复合体转入hBMSCs后,加入X-Gal以及染色剂孵育,在光镜下可见细胞内呈现蓝色,那么则验证了被PEI携载的β-半乳糖苷酶被转入细胞后能够正常表达并依然具有活性,见图6。
讨论
随着纳米技术的发展,科研者们不断制造出各种具有特殊性能的纳米粒载体并用于基因和蛋白质的转移,包括PLL、PEI、树枝状聚合物(dendrimers)、多聚β-氨基酯(PbAE)、脱乙酰壳多糖(chitosan)及明胶等一系列穿膜载体。这类带正电荷的纳米粒子可以通过氢键作用、静电作用、疏水作用甚至范德华力等物理化学作用,很容易地与带负电荷的基因和蛋白质载体接触并结合,进而对其展开折叠压缩等自组装修饰[8]。早在2005年[9]就有了PEI能对蛋白质进行运输转染的报道,逐渐修饰形成致密均匀的纳米球状复合体的研究,而这些复合体在表面效应和体积效应的作用下,会逐渐趋于稳定。同时,这也大大开启了PEI的蛋白转染之路,目前,已有学者运用硫酸盐接枝PEI,再通过氧化聚合反应生成的聚合电解质RPC-bPEI来携载像BSA、溶解酵素等细胞质蛋白,从电解质还原角度来实现蛋白质的传递[10]。
众所周知,蛋白质是主导发挥生物学作用的终端物质,其复杂而稳定的四级结构及其活性基团构象都对细胞、组织乃至生物体的调控产生巨大影响。Bao等[11]使用他们构建的chitosan-PEI-坎替沙坦(CPC)复合体联合基因治疗来对抗恶性血管肿瘤,这种CPC复合体拥有靶向运送药物蛋白的功能,CPC和WT-p53基因的联合运输模式更为肿瘤治疗提供了一种非常有效的手段,而当PEI与吡啶硫脲发生自组装后,会更加有利于运输具有功能活性的小分子抗体以及抗体抑制剂[12]。鉴于不容小觑的蛋白功能,本实验室则从蛋白质转染着手,发现了只需单纯的PEI(1 200 kD)分子,就能够高效装载外源性的蛋白质分子通过质膜甚至核膜屏障,并能克服宿主细胞内溶酶体、蛋白酶等对外源蛋白质分子的降解,使其在细胞内发挥它的活性功能,这无疑开辟了一条基础过度临床应用的新道路。
另外,应用于骨髓间充质干细胞的直接转染一直是科研领域颇为薄弱和单一的技术,hMSCs是具有自我更新和复制能力,并具有多向分化潜能的细胞,其“干性”的维持和细胞本身的特性是转染技术中亟待克服的两大硬伤。而目前,hMSCs的转染实际应用最多的仍旧是病毒型载体,它所转染的DNA、siRNA、shRNA、microRNA等基因片段过表达或低表达已经广泛应用于科研领域,但是,却难以摆脱免疫排斥反应以及病毒介导的随机整合等潜在危害[13],Moradian等[14]也曾试过用PEI联合碳纳米管来转染eGFP进入MSCs,其最高转染效率也只达82%,而本实验PEI转染GFP蛋白的效率几乎达到100%。本研究中我们分别构建了PEI-DNase I、PEI-GFP和 PEI-β-半乳糖苷酶3种纳米蛋白复合体,发现无论是低分子量还是高分子量的蛋白质,当PEI和蛋白质微粒的摩尔比是4∶1~8∶1时,构建的复合体对hMSCs的转染效率最佳。目前,利用纳米载体转染蛋白质分子的研究仍在开发和探索的过程中,若亚细胞定位的特异性进一步提高后[15],纳米-蛋白转染技术将具有无可比拟的应用价值和功能优势,临床应用前景广阔。
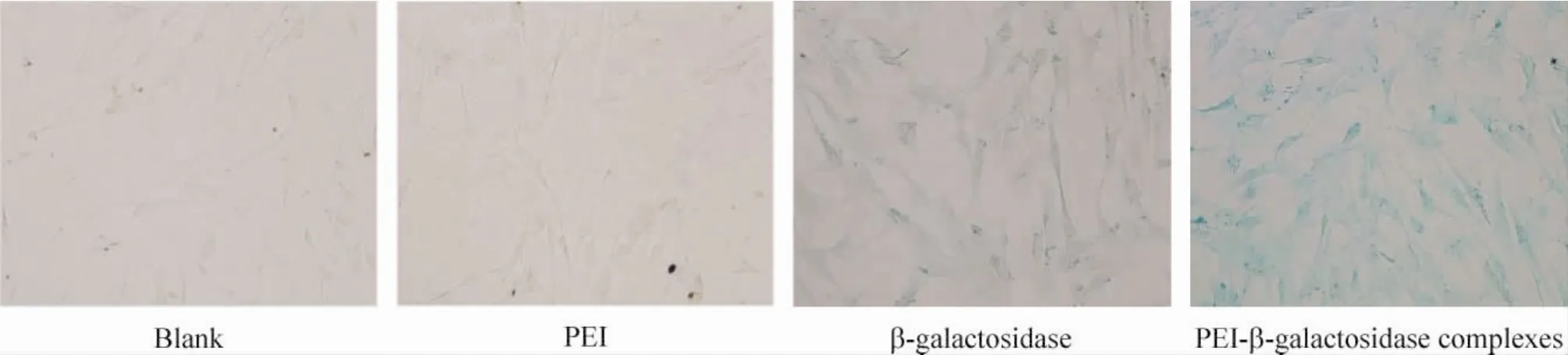
Figure 6.The expression activity of transfected β-galactosidase tested by color reaction experiment.hBMSCs were inoculated in 12 wells with 70% density,transfected by PEI-β-galactosidase complexes(protein concentration is 50 mg/L),and incubated in 5% CO2at 37℃for 48 h.图6 β-半乳糖苷酶显色实验验证转入hBMSCs的β-半乳糖苷酶的表达活性
[参考文献]
[1]Kostiainen MA,Hiekkataipale P,Laiho A,et al.Electrostatic assembly of binary nanoparticle superlattices using protein cages[J].Nat Nanotechnol,2013,8(1) :52-56.
[2]卢雪梅,黄演婷,汪洁,等.新型融合多肽HTPPMDC体外抑制HBV复制活性及亚细胞定位[J].中国病理生理杂志,2013,29(7) :1283-1287.
[3]Cho SJ,Choi HW,Cho J,et al.Activation of pluripotency genes by a nanotube-mediated protein delivery system [J].Mol Reprod Dev,2013,80(12) :1000-1008.
[4]Nagel D,Behrendt JM,Chimonides GF,et al.Polymeric microspheres as protein transduction reagents[J].Mol Cell Proteomics,2014,13(6) :1543-1551.
[5]Jin L,Zeng X,Liu M,et al.Current progress in gene delivery technology based on chemical methods and nano-carriers[J].Theranostics,2014,4(3) :240-255.
[6]Kato T,Tanaka M,Oba M.Protein transfection study using multicellular tumor spheroids of human hepatoma Huh-7 cells[J].PLoS One,2013,8(12) : e82876.
[7]刘莲,余榕捷,戴云,等.重组蛋白PTD-HSP27的制备及其穿细胞膜和角膜组织的功能研究[J].中国病理生理杂志,2015,31(1) :135-140.
[8]Vasquez D,Milusheva R,Baumann P,et al.The amine content of PEGylated chitosan Bombyx mori nanoparticles acts as a trigger for protein delivery[J].Langmuir,2014,30(4) :965-975.
[9]Didenko VV,Ngo H,Baskin DS.Polyethyleneimine as a transmembrane carrier of fluorescently labeled proteins and antibodies[J].Anal Biochem,2005,344(2) :168-173.
[10]Tian L,Kang HC,Bae YH.Endosomolytic reducible polymeric electrolytes for cytosolic protein delivery[J].Biomacromolecules,2013,14(8) :2570-2581.
[11]Bao X,Wang W,Wang C,et al.A chitosan-graft-PEI-candesartan conjugate for targeted co-delivery of drug and gene in anti-angiogenesis cancer therapy[J].Biomaterials,2014,35(29) :8450-8466.
[12]Postupalenko V,Sibler AP,Desplancq D,et al.Intracellular delivery of functionally active proteins using self-assembling pyridylthiourea-polyethylenimine[J].J Control Release,2014,178:86-94.
[13]Klein PM,Wagner E.Bioreducible polycations as shuttles for therapeutic nucleic acid and protein transfection[J].Antioxid Redox Signal,2014,21(5) :804-817.
[14]Moradian H,Fasehee H,Keshvari H,et al.Poly(ethyleneimine) functionalized carbon nanotubes as efficient nano-vector for transfecting mesenchymal stem cells[J].Colloids Surf B Biointerfaces,2014,122:115-125.
[15]Lohcharoenkal W,Wang L,Chen YC,et al.Protein nanoparticles as drug delivery carriers for cancer therapy[J].Biomed Res Int,2014,2014:180549.
通讯作者△Tel: 020-83827812; E-mail: yuxycn@ aliyun.com
*[基金项目]国家自然科学基金重点资助项目(No.81120108003; No.81330007)
[收稿日期]2015-02-26
[文章编号]1000-4718(2015)06-1057-07
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.016
