有氧运动抑制心梗后心力衰竭大鼠左室重塑及交感神经重塑*
2015-03-30李晓霞
甄 洁,李晓霞
(1郑州大学体育系,河南郑州450001;2山东体育学院,山东济南250102)
有氧运动抑制心梗后心力衰竭大鼠左室重塑及交感神经重塑*
甄洁1,李晓霞2△
(1郑州大学体育系,河南郑州450001;2山东体育学院,山东济南250102)
[摘要]目的:探讨长期有氧运动对心梗后心力衰竭(心衰)大鼠模型左心室及交感神经重塑(结构重塑与功能重塑)的影响,为心衰的机制研究及康复治疗提供科学依据和有效方法。方法:健康雄性Wistar大鼠通过结扎冠状动脉前降支建立心梗后心衰模型,术后4周随机分为假手术安静组(S组)、心衰安静组(H组)和心衰运动组(HE组)。HE组进行10周跑台训练,S组和H组保持安静状态。超声心动术检测心脏结构与功能,即左室舒张期内径(LVIDd)、左室收缩期内径(LVIDs)、左室舒张期前壁厚度(LVAWDd)、左室收缩期前壁厚度(LVAWDs)、左室舒张期后壁厚度(LVPWDd)、左室收缩期后壁厚度(LVPWDs)、缩短分数(FS)和左室射血分数(LVEF) ; Masson染色进行心脏组织病理学观察并获得心肌胶原容积分数(CVF) ;高压液相色谱法检测心肌和血浆去甲肾上腺素(NE)水平;经皮下引导电极连续采集心电信号,对自主神经功能参数——心率变异性(HRV)进行频域分析,包括总功率谱(TP)、归一化低频功率谱(LFn)、归一化高频功率谱(HFn)和LF/HF比值;实时荧光定量PCR检测心肌I型胶原(Col-I)、III型胶原(Col-III)、心房钠尿因子(ANF)、α-肌球蛋白重链(α-MHC)、β-肌球蛋白重链(β-MHC)和肌质网Ca(2+)-ATP酶(SERCA2a) mRNA表达,Western blotting法检测心肌神经生长因子(NGF)及其受体(TrkA)和酪氨酸羟化酶(TH)蛋白表达。结果: (1)与S组比较,H组体重(BW)、LVIDd、FS、LVEF、TP、HFn、α-MHC和SERCA2a的mRNA,NGF、TrkA和TH的蛋白表达降低(P<0.05) ;左室重量(LVW)、左室质量指数(LVMI)、LVAWDd、LVAWDs、LVPWDd、LVPWDs、CVF、血浆和心肌NE含量、LFn、LF/HF、ANF、β-MHC、Col-I和Col-III的mRNA表达升高(P<0.05)。(2)与H组比较,HE组LVW、LVMI、LVIDd、FS、LVEF、TP、HFn、α-MHC和SERCA2a的mRNA,NGF、TrkA和TH的蛋白表达升高(P<0.05) ; CVF、血浆和心肌NE含量、LFn、LF/HF、ANF、β-MHC、Col-I和Col-III 的mRNA表达降低(P<0.05)。结论:长期有氧运动可抑制心梗后心衰大鼠左室重塑与交感神经重塑,心功能和自主调节改善。
[关键词]有氧运动;心力衰竭;交感神经;自主神经功能
[修回日期]2015-01-04
Inhibitory effect of aerobic exercise on left ventricular remodeling and sympathetic neural remodeling in rats with heart failure after myocardial infarction
ZHEN Jie1,LI Xiao-xia2
(1Physical Education Department,Zhengzhou University,Zhengzhou 450001,China;2Shandong Sport University,Jinan 250102,China.E-mail: lixiaoxia1963@126.com)
[ABSTRACT]AIM: To investigate the effects of long-term aerobic exercise on the heart and sympathetic neural remodeling (structure and function remodeling) in heart failure rats induced by myocardial infarction.METHODS: Heart failure model after myocardial infarction was performed by ligating anterior descending coronary artery in the Wistar rats.Four weeks after operation,the rats were randomly divided into sham operation sedentary (S) group,heart failure sedentary (H) group and heart failure exercise (HE) group.The animals in HE group underwent 10-week treadmill running,while those in S group and H group were sustained in a resting state.The cardiac structure and function including left ventricular internal diameter at diastole (LVIDd),left ventricular internal diameter at systole (LVIDs),left ventricular anteri-or wall diameter at diastole (LVAWDd),left ventricular anterior wall diameter at systole (LVAWDs),left ventricular posterior wall diameter at diastole (LVPWDd) and left ventricular posterior wall diameter at systole (LVPWDs),and cardiac function parameters including fractional shortening (FS) and left ventricular ejection fraction (LVEF) were measured by echocardiography.The myocardium was collected for histopathological observation with Masson staining,and the collagen volume fraction (CVF) was determined.The concentrations of norepinephrine (NE) in the myocardium and plasma were measured by high-pressure liquid chromatography.The frequency domain analysis was applied for determining the heart rate variability (HRV) via subcutaneous recording electrode involving total power (TP),normalized low power (LFn),normalized high power (HFn) and LF/HF ratio.The mRNA expression of collagen type I (Col-I),collagen type III (Col-III),atrial natriuretic factor (ANF),α-myosin heavy chain (α-MHC),β-myosin heavy chain (β-MHC),sarcoplasmic endoplasmic reticulum Ca2+-ATPase (SERCA2a) was detected by real-time PCR.The protein levels of nerve growth factor (NGF) and its receptor (TrkA),and tyrosine hydroxylase (TH) were measured by Western blotting.RESULTS: (1) Compared with S group,body weight (BW),LVIDd,FS,LVEF,TP,HFn,the mRNA expression of α-MHC and SERCA2a,and the protein levels of NGF,TrkA and TH decreased (P<0.05).Left ventricular weight (LVW),left ventricular mass index (LVMI),LVAWDd,LVAWDs,LVPWDd,LVPWDs,CVF,plasma and myocardial NE content,LFn,LF/HF,and the mRNA expression of ANF,β-MHC,Col-I and Col-III increased (P<0.05) in H group.(2) Compared with H group,LVW,LVMI,LVIDd,FS,LVEF,TP,HFn,the mRNA expression of α-MHC and SERCA2a,and the protein levels of NGF,TrkA and TH were raised (P<0.05),while CVF,plasma and myocardial NE content,LFn,LF/HF,and the mRNA expression of ANF,β-MHC,Col-I and Col-III decreased (P<0.05) in HE group.CONCLUSION: Long-term aerobic exercise training leads to inhibition of heart and sympathetic neural remodeling and improvement of cardiac function and autonomic modulation in the rats after myocardial infarction.
[KEY WORDS]Aerobic exercise; Heart failure; Sympathetic nerve; Autonomic nervous function
心力衰竭(简称心衰)是各种心血管疾病发展的终末阶段,发病率、致残率以及病死率均较高,严重影响患者的生活质量和生命安全。对其发病机制进行深入研究并采取有效康复治疗手段将有助于改善患者的生活质量[1]。心肌梗死(myocardial infarction,MI)后心室重塑是慢性心衰发生发展的病理生理学基础,一直是心脏病学与康复医学研究的热点[2]。MI后除心脏(主要是左室)重塑以外还发生了交感神经重塑。近年来发现交感神经重塑是MI后自主神经调制紊乱并引发致命性心律失常及心源性猝死的重要原因[3]。临床实践证实,规律体力活动可改善心衰患者生活质量、降低死亡率与住院率[4],但运动良性效应的具体机制尚不清楚,运动是否通过抑制心室重塑和交感神经重塑进而改善心功能不得而知。本研究以Wistar大鼠为实验对象,通过结扎冠状动脉前降支建立MI后心衰模型,观察10周有氧训练对左室重塑及心脏交感神经重塑的影响,以期为心衰的机制研究与康复治疗提供科学依据和有效方法。
材料和方法
1实验动物、心衰造模与动物分组
8周龄健康雄性Wistar大鼠38只(250~280 g),由山东鲁抗医药股份有限公司提供,实验动物许可证号为SCXK[鲁]2008-0003。随机选取28只大鼠进行心梗后心衰模型制备,方法如下:动物麻醉后仰卧固定,气管插管,于胸骨左侧3~4肋间开胸暴露心脏,用0号丝线结扎左冠状动脉前降支。结扎后肉眼可见结扎区域变白、收缩力降低,心电记录仪见Ⅰ、Ⅱ导联ST段明显抬高,证明结扎术成功。然后迅速放回心脏缝合胸壁。另外10只大鼠进行假手术,即开胸后只栓线不结扎。术后4周行心脏超声检查,以左室射血分数(left ventricular ejection fraction,LVEF)≤45%作为心衰造模成功的标志。
实验中,2只动物造模失败,1只死亡。将心衰造模成功的大鼠(n=25)随机分为心衰安静组(H组,n=12)和心衰运动组(HE组,n=13),行假手术的动物作为假手术安静组(S组,n=10)。
2运动处方
首先参照本课题组已建立的递增负荷实验测定HE组大鼠的最大跑速[5],以确定运动处方中的运动强度,方法为: 15 min热身(速度5 m/min,坡度0°)后休息5 min进行递增负荷实验,起始负荷为7 m/min,每3 min递增5 m/min(坡度0°),直至力竭(力竭标准:动物不能坚持本级负荷跑速,先后滞于跑道后1/3处达6次以上,声光电刺激驱赶无效),记录最大跑速。于最大跑速测定后第2天开始,HE组大鼠进行10周跑台运动训练,前2周为最大跑速的50%,后8周为最大跑速的60%;时间为第1天30 min,以后每天递增10 min,直至60 min/d。频率为5 d/周。S组和H组则保持安静状态。
3实验方法
3.1心脏超声检测心功能用小动物超声图成像系统(Visualsonics Vevo770)检测心脏结构与功能。1%戊巴比妥钠30 mg/kg腹腔麻醉后仰卧固定,取胸骨旁左室短轴切面进行测量,检测参数包括左室舒张期内径(left ventricular internal diameter at diastole,LVIDd)、左室收缩期内径(left ventricular internal diameter at systole,LVIDs)、左室舒张期前壁厚度(left ventricularanteriorwall diameterat diastole,LVAWDd)、左室收缩期前壁厚度(left ventricular anterior wall diameter at systole,LVAWDs)、左室舒张期后壁厚度(left ventricular posterior wall diameter at diastole,LVPWDd)、左室收缩期后壁厚度(left ventricular posterior wall diameter at systole,LVPWDs)、缩短分数(fractional shortening,FS)和左室射血分数(left ventricular ejection fraction,LVEF)。
3.2心率变异性检测大鼠麻醉状态下仰卧固定在实验台上,心电传感器记录标准肢体II导联心电信号,使用AD Instrument PowerLab System持续采样10 min进行短时心率变异性(heart rate variability,HRV)频域分析。参数包括总功率谱(total power,TP)、低频功率谱(low power,LF)、高频功率谱(high power,HF)、LF/HF比值、归一化LF(normalized LF,LFn)=(LF/TP)×100、归一化HF(normalized HF,HFn)=(LF/TP)×100。
3.3动物取材大鼠HRV测定结束后称量体重(body weight,BW),尾静脉取血200 μL离心取血浆测定血浆去甲肾上腺素(norepinephrine,NE)。随后断头处死并取心脏,分离左右心室,分别称量左室重量(left ventricular weight,LVW)、右室重量(right ventricular weight,RVW)并计算左室质量指数(left ventricular mass index,LVMI),公式为LVMI=LVW/BW。称重后将左心室分成两部分,一部分进行心脏组织病理学观察,另一部分迅速置于液氮中并转移至-80℃冰箱冻存待测基因表达水平。
3.4血浆与心肌NE测定血样和心肌组织处理后,用高效液相色谱仪(LC10ATvp)分别测定血浆和心肌NE含量。
3.5心肌组织病理学观察将左室心肌组织固定于10%的甲醛中,经脱水、透明、包埋、切片(5 μm)等操作后行Masson染色。每张随机选取5个视野,用图像分析软件测量胶原组织面积,胶原组织面积占所测视野面积的百分比即为胶原容积分数(collagen volume fraction,CVF)。
3.6实时荧光定量PCR检测mRNA表达水平将心室肌组织匀浆后,用Trizol法抽提心肌总RNA。逆转录反应获得cDNA,实时荧光定量PCR(ABI 7900)测定心房钠尿因子(atrial natriuretic factor,ANF)、β-肌球蛋白重链(β-myosin heavy chain,β-MHC)、α-肌球蛋白重链(α-myosin heavy chain,α-MHC)、肌质网Ca2+-ATP酶(sarcoplasmic endoplasmic reticulum Ca2+-ATPase,SERCA2a)、I型胶原(collagen type I,Col-I)和III型胶原(collagen type III,Col-III) mRNA的表达量。扩增条件为预变性95℃1 min;95℃15 s,55℃15 s,72℃15 s,共40个循环。以β-actin作为内参照,计算目的基因的相对表达量(S组的倍数)。引物序列与产物大小见表1。

表1 各基因的引物序列Table 1.Primer sequences
3.7 Western blotting检测蛋白表达水平神经生长因子(nerve growth factor,NGF)及其受体(TrkA)和酪氨酸羟化酶(tyrosine hydroxylase,TH)的检测方法如下:取100 mg心肌组织,加入裂解液,冰上裂解1 h,提取细胞内蛋白,用BCA法进行蛋白定量。取各组蛋白样品进行SDS-聚丙烯酰胺凝胶电泳,转膜后用牛血清蛋白封闭,经I抗结合后洗膜,II抗结合,洗膜后采用增强型ECL化学发光法显色。以β-actin为内参照蛋白,对目的蛋白进行光密度分析并计算相对表达量(S组的倍数)。
4统计学处理
所有数据以均数±标准差(mean±SD)表示,部分HRV参数呈偏态分布,经自然对数转换(ln)呈正态分布后再进行比较。组间比较使用单因素方差分析,两两比较使用LSD检验。统计软件使用SPSS 15.0,以P<0.05为差异有统计学意义。
结果
1最终样本量
造模过程中,2只动物造模失败,1只死亡; 10周运动实验中,S组拒跑大鼠1只,H组死亡2只、拒跑1只,HE组死亡3只、拒跑2只。剔除上述大鼠后,最终样本量为26只,其中S组9只,H组9只,HE 组8只。
2心脏的结构与功能
与S组比较,H组BW、LVIDd、FS和LVEF降低(P<0.05),LVW、LVMI、LVAWDd、LVAWDs、LVPWDd和LVPWDs增加(P<0.05) ;与H组比较,HE 组LVW、LVMI、LVIDd、FS和LVEF升高(P<0.05),见表2。
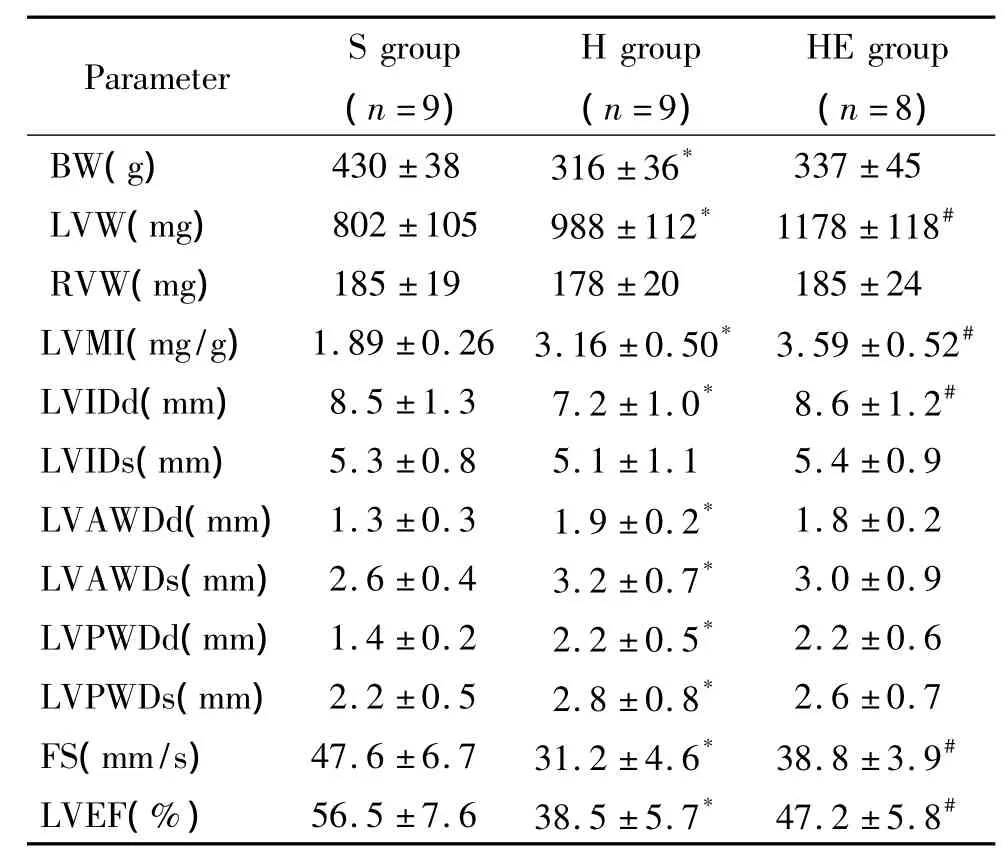
表2 心脏结构与功能的变化Table 2.Changes of cardiac structure and function(Mean±SD)
3心脏的组织病理学改变
心肌Masson染色显示:胶原纤维呈蓝色,心肌细胞呈红色。S组心肌纤维着色均匀,无胶原成分; H组心肌细胞减少,胶原成分显著增多,纤维化程度明显,CVF高于S组(P<0.05) ; HE组较H组心肌细胞增多且排列较为整齐,胶原纤维(即CVF)明显减少(P<0.05),见图1。
4血浆和心肌NE的变化
与S组比较,H组血浆和心肌NE含量升高(P<0.05) ;与H组比较,HE组血浆和心肌NE含量降低(P<0.05),见图2。
5 HRV的变化
与S组比较,H组TP和HFn降低,LFn和LF/HF升高(P<0.05) ;与H组比较,HE组TP和HFn升高,LFn和LF/HF降低(P<0.05),见表3。
6 mRNA表达水平的变化
与S组比较,H组α-MHC和SERCA2a mRNA降低,ANF、β-MHC、Col-I和Col-III mRNA升高(P<0.05) ;与H组比较,HE组α-MHC和SERCA2a mRNA升高,ANF、β-MHC、Col-I和Col-III mRNA降低(P<0.05),见图3。
7蛋白表达水平的变化
与S组比较,H组NGF、TrkA和TH蛋白表达量降低(P<0.05) ;与H组比较,HE组NGF、TrkA和TH蛋白表达量升高(P<0.05),见图4。

Figure 1.Myocardial Masson staining (×40) and changes of CVF in each group.Mean±SD.n=8~9.*P<0.05 vs S group;#P<0.05 vs H group.图1心肌Masson染色及各组CVF的变化
讨论
左室重塑是心衰发生发展的主要病理生理学机制[6],以心肌肥大和舒缩功能下降为主要标志。本研究中,与S组比较,H组LVIDd、FS和LVEF降低,LVW、LVMI、LVAWDd、LVAWDs、LVPWDd和LVPWDs增加,提示心衰后发生病理性心脏肥大,表现为心壁增厚、心腔缩小(即向心性肥大),心功能下降; ANF和β-MHC表达上调说明胚胎基因重新激活;收缩蛋白α-MHC和SERCA2a表达下调,提示心衰时肌球蛋白ATP酶活性降低,心肌收缩力下降。胶原过度沉积是左室重塑的另一特征[7],本研究中,H组心肌Col-I和Col-III mRNA表达上调,心肌胶原成分(CVF)明显增多,纤维化程度明显。研究表明,心肌纤维化时心室壁顺应性下降、舒张功能受限,同时可使心脏电稳定性降低,是造成心律失常和猝死的重要原因[8]。

Figure 2.Changes of plasma and myocardial NE.Mean±SD.n=8~9.*P<0.05 vs S group;#P<0.05 vs H group.图2血浆和心肌NE的变化
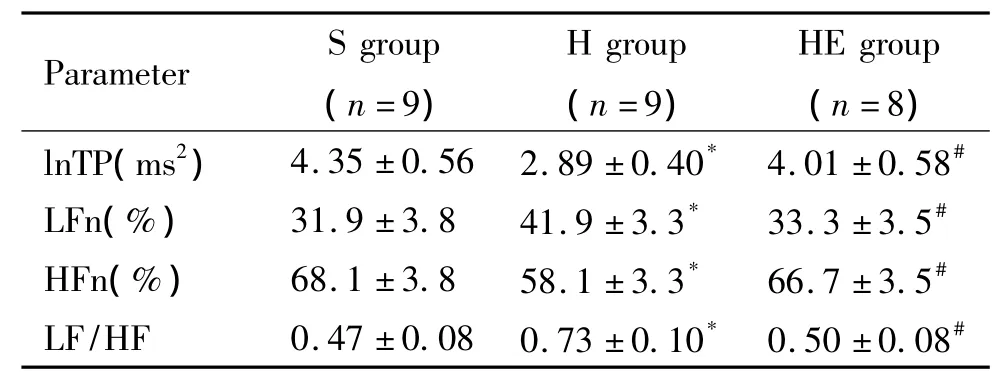
表3 HRV的变化Table 3.Changes of HRV(Mean±SD)

Figure 3.Changes of mRNA expression.Mean±SD.n=8~9.*P<0.05 vs S group;#P<0.05 vs H group.图3 mRNA表达的变化
与左室病理性重塑不同,运动训练诱导的心脏重塑是对运动应激的良性适应,但有氧运动对心衰时病理性心脏重塑的影响以及运动诱导的心脏生理性重塑在心衰运动康复中的作用鲜有关注。在本研究中,心衰大鼠经过10周跑台运动后,与H组比较,HE组左室重量(LVW、LVMI)增加、心腔内径(LVIDd)增大,室壁厚度无明显改变,即左室由运动康复前的“向心性肥大”转变为“离心性肥大”,其原因可能是有氧运动增加心脏前负荷(容量负荷)有关[9]。Col-I和Col-III表达下调伴CVF降低说明心肌纤维化程度减轻,心肌顺应性增加; ANP和β-MHC表达下调、α-MHC和SERCA2a表达上调、FS 和LVEF升高则提示胚胎基因异常激活得到抑制、心肌收缩力提高、心功能增强。上述结果说明,运动诱导的左室生理性重塑与病理性重塑在心衰大鼠运动康复过程中同时存在并相互抗衡,最终前者的良性作用逆转了后者的负面效应,表现为左室结构由病理性肥大向生理性肥大转变。因此,长期有氧运动通过抑制心衰时左室重塑改善心功能。

Figure 4.Changes of protein expression.Mean±SD.n=8~9.*P<0.05 vs S group;#P<0.05 vs H group.图4蛋白表达的变化
MI后除左室重塑外还发生了交感神经重塑。本研究中H组血浆和心肌NE含量、LF和LF/HF均高于S组,提示心衰时全身交感活性以及心脏局部交感活性均显著升高。研究证实,交感神经激活是心衰时神经调节的主要代偿方式,同时也是导致心室重塑和交感神经重塑重要原因,交感重塑使心肌细胞动作电位时程紊乱,电异质性增加,是引发MI后致命性室性心律失常的重要原因[3]。TH是交感神经递质NE合成过程中的一种关键酶,其表达量可以间接反映心脏交感神经分布。本研究中,H组TH蛋白表达量明显低于S组,说明心衰时心脏交感神经元的密度下降,即交感去神经支配。交感神经密度降低与心肌NE含量增加似乎矛盾,可能的解释包括: (1)心衰发生时交感神经再生与心肌肥大共存,但神经再生的速度滞后于心肌细胞的增长,因此交感密度相对下降,但释放到心肌间质的总NE量增加; (2)心肌NE含量是由交感神经末梢释放与再摄取的动态平衡决定的,位于交感神经突触前膜的去甲肾上腺转运蛋白(norepinephrine transporter,NET)可将神经元释放的NE再摄取到突触前膜中,调控NE浓度、终止神经冲动信号并维持受体对神经递质的敏感性。本课题组前期的研究证实[5],心衰时NET表达下调,摄取功能下降,因此心肌间质NE含量升高。交感神经生长和正常功能的维持与多种神经营养因子有关,其中NGF最为重要。NGF通过与其受体TrkA结合促进中枢和外周神经分化、生长、存活和再生[10]。关于心衰时心脏NGF和TrkA表达变化的报道并不一致(升高、降低或不变)[11-13],可能与实验动物、心衰建模方法以及心衰持续时间与严重程度有关。本研究发现,心衰大鼠NGF和TrkA蛋白表达显著降低,与Kaye等[12]的结果一致,可能与异常增高的NE水平有关[13]。NGF与TrkA表达降低影响交感神经的分化与再生功能,最终导致交感神经分布密度减少,自主调制紊乱。
对心脏交感神经重塑进行调控无疑是保护心功能、改善自主调制并延缓心衰进展的治疗关键。研究发现,有氧运动可改善健康及心血管疾病患者的自主神经功能[14],本研究亦发现,心衰大鼠运动后血浆NE、LF和LF/HF降低,提示全身交感激活受到抑制。但运动对心脏交感神经重塑的影响及机制鲜有关注。本研究发现,大鼠经过10周跑台训练后NGF、TrkA和TH蛋白表达量均显著升高,提示有氧运动可能通过上调NGF和TrkA促进交感神经分化、生长、存活和再生,增加心脏交感神经密度。动物实验证实[15],NGF可激活病理状态下心脏交感神经再生与功能修复,对降低致命性心血管事件发生率具有重要意义。饶有兴趣的是,HE组交感密度增加的同时心肌NE含量降低,提示心脏局部交感活性下降。我们前期的研究发现[5],有氧运动通过上调心脏交感神经元NET表达恢复了交感神经末梢NE释放量和心肌布局NE含量,从而改善心衰后交感神经功能紊乱状态。更为重要的是,有氧运动可能促使心衰后交感神经分布的异质性趋于正常,心肌电稳定性增加,心源性猝死发生率下降。因此,运动改善交感神经重塑不仅有利于心衰患者心功能的恢复,而且可降低MI后的死亡率。总之,NGF/TrkA介导的信号通路参与了运动对心衰大鼠交感重塑的调节作用,NGF/TrkA可能是运动防治心衰的干预靶点。
综上所述,MI后心衰大鼠出现左室重塑和交感神经重塑;有氧运动抑制左室重塑并使心脏由病理性肥大向生理性肥大转变,心功能提高,其机制与纤维化程度减轻,胚胎基因表达下调,收缩蛋白表达上调有关;有氧运动抑制交感神经重塑并改善自主神经功能,其机制可能与NGF与TrkA表达上调有关。
[参考文献]
[1]Griffiths A,Paracha N,Davies A,et al.The cost effectiveness of ivabradine in the treatment of chronic heart failure from the UK National Health Service perspective[J].Heart,2014,100(13) :1031-1036.
[2]Johnson FL.Pathophysiology and etiology of heart failure [J].Cardiol Clin,2014,32(1) :9-19.
[3]邓开伯.心脏交感神经重塑与围梗死期心律失常的关联[J].中国心脏起搏与心电生理杂志,2009,23(1) : 6-7.
[4]Ismail H,McFarlane JR,Dieberg G,et al.Exercise training program characteristics and magnitude of change in functional capacity of heart failure patients[J].Int J Cardiol,2014,171(1) :62-65.
[5]周义义,李晓霞.运动对慢性心力衰竭大鼠心脏交感神经功能的调节——去甲肾上腺素转运蛋白的作用[J].体育科学,2012,32(3) :67-73.
[6]沈鑫,马依彤,杨毅宁,等.不同年龄小鼠缺血性心力衰竭后心室重塑程度的比较[J].中国病理生理杂志,2013,29(6) :988-992.
[7]Segura AM,Frazier OH,Buja LM.Fibrosis and heart failure[J].Heart Fail Rev,2014,19(2) :173-185.
[8]韦联章.高血压患者伴发快速房性心律失常与左房室重塑关系的临床分析[J].内科,2014,9(2) :162-163,168.
[9]Lewis EJ,McKillop A,Banks L.The Morganroth hypothesis revisited: endurance exercise elicits eccentric hypertrophy of the heart[J].J Physiol,2012,590(12) : 2833-2834.
[10]Lam NT,Currie PD,Lieschke GJ,et al.Nerve growth factor stimulates cardiac regeneration via cardiomyocyte proliferation in experimental heart failure[J].PLoS One,2012,7(12) : e53210.
[11]曲秀芬,喜杨,于彦伟,等.心肌梗死后神经生长因子的动态表达及其与交感神经重构的关系[J].中华心血管病杂志,2004,32(12) :1135-1138.
[12]Kaye DM,Vaddadi G,Gruskin SL,et al.Reduced myocardial nerve growth factor expression in human and experimental heart failure[J].Circ Res,2000,86(7) : e80-e84.
[13]Xing J,Lu J,Li J.Nerve growth factor decreases in sympathetic and sensory nerves of rats with chronic heart failure[J].Neurochem Res,2014,39(8) :1564-1570.
[14]潘燕霞,王玮.运动训练改善心力衰竭大鼠动脉压力反射功能[J].中国病理生理杂志,2010,26(1) : 59-63.
[15]Wang HJ,Wang W,Cornish KG,et al.Cardiac sympathetic afferent denervation attenuates cardiac remodeling and improves cardiovascular dysfunction in rats with heart failure[J].Hypertension,2014,64(4) :745-755.
通讯作者△Tel: 0531-89655015; E-mail: lixiaoxia1963@126.com
*[基金项目]山东省自然科学基金资助项目(No.ZR2012HM074)
[收稿日期]2014-12-05
[文章编号]1000-4718(2015)06-0973-07
[中图分类号]R363; G804.2
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.003
