实验性精索静脉曲张对大鼠睾丸结构及内分泌功能变化的影响
2015-03-24贾晓鹏孙亚楠
贾晓鹏,苗 蕊,李 斌,孙亚楠
·论著·
实验性精索静脉曲张对大鼠睾丸结构及内分泌功能变化的影响
贾晓鹏,苗 蕊,李 斌,孙亚楠
目的 揭示精索静脉曲张导致男性不育的机制。方法 将SD(Sprayue-Dawley)三级雄性大鼠40只随机分为精索静脉曲张组、假手术组,每组20只。按Turner法建立精索静脉曲张动物模型,造模后12周将两组大鼠分别脱颈处死,摘取左侧睾丸,以透射电镜观察睾丸的超微结构;摘取两组大鼠的附睾分离出精子观察其形态;检测睾丸组织内雄激素结合蛋白、抑制素B,计算出免疫组化评分(IHS);检测睾丸组织内睾酮水平。结果 精索静脉曲张组与假手术组比较,支持细胞、间质细胞及精子细胞微观结构发生明显变化;睾丸组织雄激素结合蛋白IHS差异无统计学意义(P>0.05);抑制素B IHS及睾酮水平差异有统计学意义(P<0.05,P<0.01)。结论 精索静脉曲张通过影响大鼠睾丸间质细胞、支持细胞的结构改变其功能,通过影响生殖系统内分泌环境及性激素水平影响精子的成熟与发育使精子数量和形态发生改变,造成不育。
精索静脉曲张;超微结构;雄激素结合蛋白;抑制素B;睾酮;大鼠,Sprague-Dawley
精索静脉曲张是男科常见疾病,男性不育症患者中精索静脉曲张者占19%~41%[1]。精索静脉曲张导致不育的原因众多,但具体机制不明[2]。本课题通过研究精索静脉曲张对大鼠睾丸结构及内分泌功能的影响,探讨男性不育的机制。
1 材料与方法
1.1 动物与分组 选择40只健康的SD三级青春期雄性大鼠(购自河北医科大学实验动物中心),鼠龄40~60 d,体重240~280 g。在相同的饲养条件下饲养12周。将40只大鼠随机编号,双数组为精索静脉曲张组(20只),单数组为假手术组(20只)。
1.2 动物模型制备 动物模型按文献[3]的方法制备:腹腔内注射10%水合氯醛3.33 ml/kg麻醉。精索静脉曲张组:将大鼠固定于手术台上,取腹正中纵向切口,暴露腹腔,将左肾静脉及左肾上腺静脉、下腔静脉分别游离,将直径为0.8 mm的8#注射器针头放置于左肾上腺静脉和下腔静脉之间,在左肾静脉及下腔静脉交叉处用3-0丝线将针头和左肾静脉一并结扎,拔出针头,左肾静脉直径可缩小一半。0.9%氯化钠注射液冲洗腹腔后,将切口依次缝合;假手术组:步骤与静索静脉曲张组相同,不结扎左肾静脉。在腹腔内注射抗生素预防感染,青霉素剂量为20万单位/次、1/d,连用3 d。所有大鼠在术后第12周均脱颈处死,精索静脉曲张组解剖发现左侧精索静脉曲张,直径大于1 mm,双肾重量、体积无差别,表示动物模型制备成功[4]。
1.3 标本的采集及检测
1.3.1 睾丸病理切片制备:①取材和固定: 仔细剪除附睾及周围筋膜等附属组织,将睾丸平均切成两半,一半研磨、离心15 min,取上层液置于Eppendof管-20℃保存待测。另一半立即投放入含1%多聚甲醛及2%戊二醛混合液中固定6~24 h。固定后横切成厚1~2 mm薄片。②洗涤:倒出固定液,加入洗涤液(pH值7.4的PBS液)洗涤,再将标本固定2 h。固定液为1%四氧化锇酸液。③脱水与透明:梯度乙醇脱水,顺序放入85%乙醇,95%乙醇,100%乙醇,在浸蜡前除去酒精,用二甲苯进行媒浸,该过程可使组织透明,将透明后的组织投入环氧树脂中包埋,最后切片,切片厚度4 μm,于60℃温箱中烘干。用醋酸双氧铀及枸橼酸铅染色,用HITACHI-H7500型透射电子显微镜观察标本。
1.3.2 精液标本的采集和检测:摘取两组大鼠的附睾后,将附睾游离出,分离出其头部、体部、尾部,漂洗附睾,切取附睾尾部,将切取的尾部组织纵向做3个切口,放入离心管内,将PBS液加到2 ml,将盛有两组标本的离心管分别放入水浴箱内,水温为37℃,精子可自由游出,20 min后,取出离心管。将上层精子悬液用微量移液器吸取10 μl,滴在精子计数板上。将可调节加样器吸取的40 μl精子悬液滴在载玻片上,自然晾干,固定10 min,再自然晾干,用1%伊红染液染色1.5 h,清水冲洗载玻片,自然晾干。用光学显微镜观察精子的形态,包括4个角及正中部5个视野。
1.3.3 检测睾丸组织内雄激素结合蛋白(ABP):将厚度4 μm的组织乙醇脱水,中性树脂封片。随机选取5个视野,阳性对照为表达ABP阳性的生精上皮,阴性对照为PBS代替一抗,在细胞质或细胞膜内见到黄色或棕黄色颗粒者为阳性细胞。参考Soslow等[4]的方法依照细胞着色密度(A)和着色强度(B)建立以下半定量评分方法:依阳性细胞的密度:无阳性细胞为0分;阳性细胞1%~10%为1分;10%~50%为2分;50%~80%为3分;80%~100%为4分。依阳性细胞的着色强度:阴性,0分;轻度着色(浅棕黄色),1分;中度着色(棕黄色),2分;强染色(深棕黄色),3分。着色密度和强度之积作为结果判定的最后得分[免疫组化评分(IHS)=A×B]。
1.3.4 测定睾丸组织内抑制素B(Inh B)、睾酮:Inh B测定方法同“1.3.3”;使用BECKMAN COULTER DXⅠ 800全自动免疫分析仪测定睾丸组织内睾酮水平。
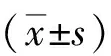
2 结果
2.1 睾丸组织镜下观察结果
2.1.1 支持细胞:假手术组表现为支持细胞形态不规则,基部跟基膜紧贴,顶部突向腔面,核大形态不规则,核膜有向内的凹陷,胞质基质致密,有大量的线粒体及滑面内质网,Sertoli-Sertoli细胞连接连续未断裂。精索静脉曲张组表现为支持细胞基底膜发生改变、水肿,基膜内可见大量的肌样细胞,Sertoli-Sertoli细胞间连接普遍断裂,胞质内线粒体及滑面内质网显著减少,胞质内出现大量溶酶体颗粒。见图1、2。
2.1.2 间质细胞:假手术组表现为间质细胞表面细长微绒毛存在,弥漫均匀的胞质内染色质内有大量的线粒体、高尔基复合体、滑面内质网及少量粗面内质网,细胞核清晰并有较大的核仁。精索静脉曲张组表现为间质细胞出现凋亡,出现空泡样变性,细胞核内核仁不清,染色质出现成块凝集,并核周积聚,胞质内有大量溶酶体颗粒;细胞表面微绒毛数量、线粒体、滑面内质网显著减少。见图3、4。
2.1.3 精子细胞:假手术组表现为精子细胞核细长,头部含极少量的细胞质和细胞核以及特化的高尔基体(顶体)染色质正常;精索静脉曲张组表现为精子细胞核畸形,核内有大量空泡、核膜、顶体消失,染色质浓缩成块状。见图5、6。
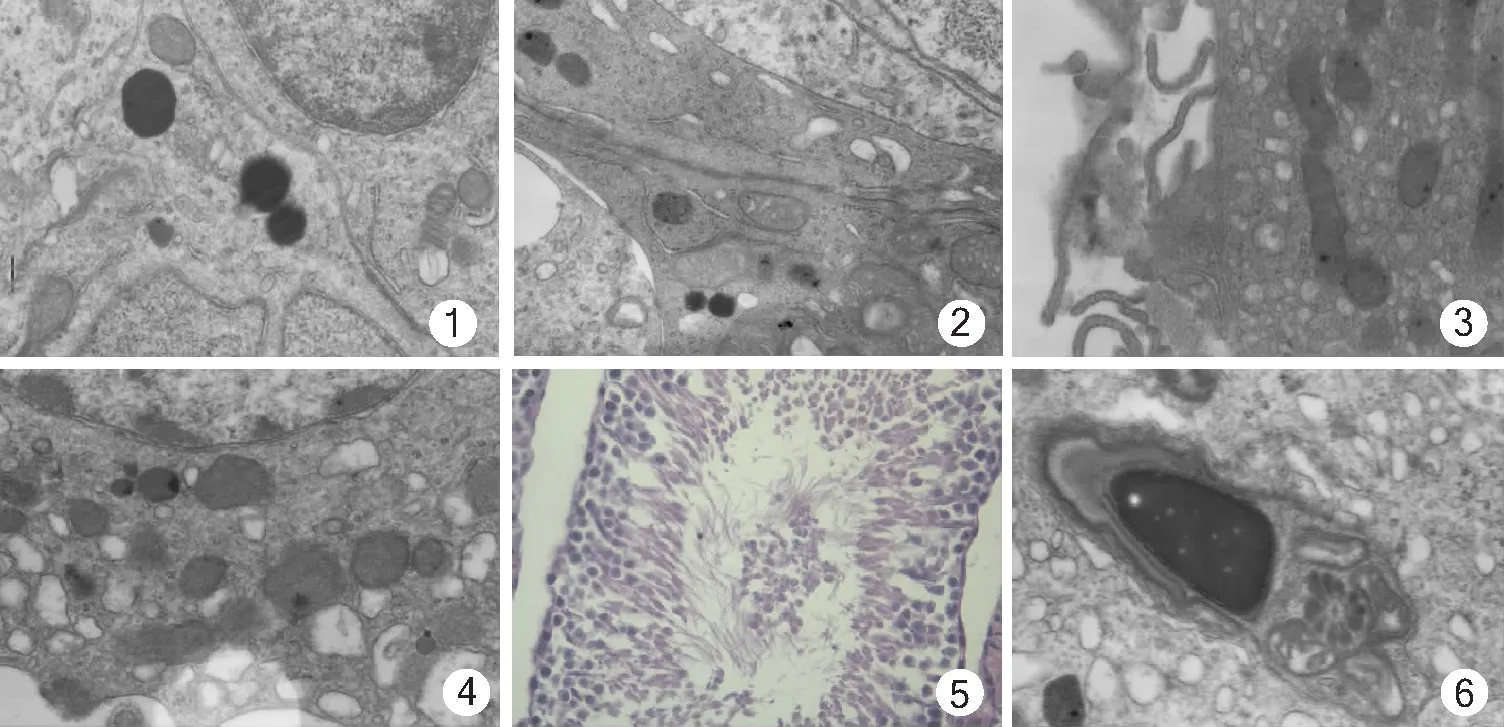
图1 假手术组大鼠睾丸支持细胞电镜观察结果(×15 000);图2 精索静脉曲张组大鼠睾丸支持细胞电镜观察结果(×15 000);图3 假手术组大鼠睾丸间质细胞电镜观察结果(20 000);图4 精索静脉曲张组大鼠睾丸间质细胞电镜观察结果(×20 000);图5 假手术组大鼠精子细胞光镜观察结果(DAB×400);图6 精索静脉曲张组大鼠精子细胞电镜观察结果(×20 000)
2.2 睾丸组织ABP IHS比较 假手术组、精索静脉曲张组大鼠睾丸组织ABP HIS中位数(四分位数间距)分别为6(4.5)、6(4.25),差异无统计学意义(Z=-1.078,P=0.281)。
2.3 睾丸组织内Inh B比较 假手术组、精索静脉曲张组大鼠睾丸组织Inh B HIS中位数(四分位数间距)分别为7.5(4.5)、5.0(2.0),差异有统计学意义(Z=-2.114,P=0.035)。
2.4 睾丸组织睾酮浓度比较 假手术组、精索静脉曲张组大鼠睾丸组织睾酮浓度分别为(109.10±6.37)、(94.79±3.31)nmol/L,差异具有统计学意义(t=4.52,P<0.001)。
3 讨论
精索静脉曲张是指精索内蔓状静脉丛的异常伸长、扩张和迂曲[5]。在男性不育症的诸多病因中,精索静脉曲张位居首位,其对男性生育能力的影响越来越受到重视[6-7]。足够数量的正常形态精子是受孕的基础,睾丸支持细胞对生精细胞的作用除直接的营养支持、维持局部免疫豁免的作用外,更多的是通过各种因子的分泌维持生精细胞的发育。睾丸间质细胞的主要功能是睾酮的合成与分泌及生精的发生,因此对睾丸间质细胞功能障碍的研究已成为男性不育的一个重要研究领域[8]。Venkatesh等[9]研究表明,睾丸支持细胞和间质细胞的损害是导致精子异常的重要原因。
本研究发现,精索静脉曲张大鼠精子密度、形态均发生变化,精子畸形率明显增加。精子畸形特别是顶体结构的改变会严重影响大鼠生育能力,因为精子与卵子相遇前,精子在子宫和输卵管处顶体获能后才有迅速运动与受精的能力。精索静脉曲张导致精子数量减少和形态改变的可能机制除了造成睾丸间质细胞、支持细胞的损害使精子产生减少与成熟障碍外,还破坏了血-生精小管屏障,触发了免疫机制,精子、精浆在体内产生大量的抗精子抗体,影响正常精子的生成及成熟,并加速生精细胞的凋亡,因此精子密度明显降低,畸形率明显增加,从而影响男性的生育能力。
本研究通过对精索静脉曲张大鼠睾丸超微结构的研究发现,精索静脉曲张可导致睾丸支持细胞、间质细胞的改变。在众多因子中,ABP与Inh B对于睾丸生精功能的维持和调节作用显著。ABP是一种分子量为85 kd的异二聚体糖蛋白,与雄激素共同参与性功能的产生维持作用[10];Inh是一种糖蛋白二聚体,有A和B两种亚单位,亚单位A与两种亚单位B通过二硫键链接,分别形成抑制素Inh A及Inh B,其中Inh B是主要作用形式。在男性,睾丸支持细胞分泌抑制素,它的主要作用是通过负反馈调节下丘脑-垂体-性腺轴使促卵泡激素(FSH)分泌减少,从而使睾丸间质细胞分泌睾酮减少,同时也可通过cAMP途径对间质细胞功能起调节作用[11-12]。本研究结果显示,精索静脉曲张组睾丸组织Inh B浓度较假手术组明显降低,说明精索静脉曲张能引起睾丸支持细胞Inh B表达减少,进而导致精子的发育、成熟障碍,最终引起生精功能低下。
本研究同样证明,造模后12周,精索静脉曲张组大鼠睾丸组织睾酮水平较假手术组明显下降,其机制为调节作用导致睾丸间质细胞内源性睾酮分泌减少,影响精子的发育和成熟,最终引起不育。睾丸细胞一旦出现损伤必然造成睾酮分泌下降,在睾丸细胞损伤较轻的情况下,FSH和黄体生成素(LH)分泌增加,会增强对间质细胞的作用,使血液中的睾酮恢复到正常水平[13]。有研究表明,精索静脉曲张可引起睾丸间质细胞、支持细胞的功能下降,使外周血中的性激素水平下降,反馈至下丘脑-垂体-睾丸轴,使血液促性腺激素分泌水平升高,从而影响睾丸生精作用的内分泌环境而致生育力下降[14-15]。
综上所述,精索静脉曲张通过影响睾丸间质细胞、支持细胞的结构,造成其功能的改变,影响生殖系统内分泌环境和性激素的水平,以及精子的成熟与发育,使精子数量和形态发生改变,造成不育。另外,精索静脉曲张本身也能引起精子数量的减少及畸形的增加。因此,本实验是从睾丸的超微结构及内分泌等方面揭示了精索静脉曲张导致男性不育的机制,为临床治疗精索静脉曲张提供了可靠的理论依据。
[1] Lui W Y, Mruk D, Lee W M,etal. Sertoli cell tight junction dynamics: their regulation during spermatogenesis[J].Biol Reprod, 2003,68(4):1087-1097.
[2] Hurtado B, Munoz X, Recarte Pelz P,etal. Expression of the vitamin K-dependent proteins GAS6 and protein S and the TAM receptor tyrosine kinases in human atherosclerotic carotid plaques[J].Thromb Haemost, 2011,105(5):873-882.
[3] Turner T T. The study of varicocele through the use of animal models[J].Hum Reproduction Update, 2001,7(1):78-84.
[4] Soslow R A, Dannenberg A J, Rush D,etal. Cox-2 is expressed in human pulmonary, colonic, and mammary tumors[J].Cancer, 2000,89(21):2637-2645.
[5] 朱宝安,李先佳.精索静脉曲张对大鼠睾丸间质细胞超微结构及凋亡的影响[J].武汉大学学报:医学版,2015,36(1)32-35.
[6] Adams W J, Zhang Y, Cloutier J,etal. Functional vascular endothelium derived from human induced pluripotent stem cells[J].Stem Cell Reports, 2013,1(2):105-113.
[7] Felden F, Leheup B, Fremont S,etal. The plasma membrane of epididymal epithelial cells has a specific receptor which binds to androgen-binding protein and sex sreroid-binding protein[J].J Steroid Biochem Mol Biol, 1992,42(3-4):279-285.
[8] 苗蕊,贾晓鹏,李斌,等.精索静脉曲张对大鼠睾丸内分泌功能的影响[J].解放军医药杂志,2015,27(5):29-32.
[9] Venkatesh S, Shamsi M B, Dudeja S,etal. Reactive oxygen species measurement in neat and washed semen: comparative analysis and its significance in male infertility assessment[J].Arch Gynecol Obstet, 2011,283(1): 121-126.
[10]Atanassova N, Koeva Y, Bakalska M,etal. Loss and recovery of androgen receptor protein expression in the adult rat testis following androgen withdrawal by ethane dimethanesulfonate[J].Folia Histochem Cytobiol, 2006,44(2):81-86.
[11]Green S, Fishel S. Morphology comparison of individually selected hyperactivated and nonhyperactivated human spermatozoa[J].Hum Reprod, 1999,14(1):123-130.
[12]孟庆杰,邹成安,周玉霞.正常男性与不育男性的精子运动参数CASA分析[J].中国男科学杂志,2002,16(2):125-126.
[13]Comhaire F, Zalata A, Mahmoud A,etal. Patophysiological effect of varicocele treatment[J].Urologe A, 1998,37(3):251-253.
[14]Wang Y Q, Dai M, Zhong J C,etal. Paeonol inhibits oxidized low density lipoprotein-induced monocyte adhesion to vascular endothelial cells by inhibiting the mitogen activated protein kinase pathway[J].Biol Pharm Bull,2012,35(5):767-772.
[15]Surmacki P, Sulik M, Seremak B. Morphometric studies of Leydig cells in chinchillas (Chinchilla lanigera) during high and low fertility seasons[J].Folia Biol (Krakow), 2011,59(3-4):195-201.
Effect of Experimental Varicocele on the Structure and Endocrinic Function of Testis in Rats
JIA Xiao-peng1, MIAO Rui2, LI Bin3, SUN Ya-nan2
(1. Department of Urinary Surgery, the Third Hospital of Hebei Medical University, Shijiazhuang 050000, China; 2. Department of Obstetrics and Gynecology, Bethune International Peace Hospital of PLA, Shijiazhuang 050082, China; 3. Department of Urinary Surgery, Tangshan Workers' Hospital, Tangshan, Hebei 063000, China)
Objective To study the mechanisms of male infertility caused by varicocele. Methods The 40 grade Ⅲ Sprayue-Dawley (SD) male mice were randomly divided into varicocele group (n=20) and sham operation group (SH group,n=20). Turner method was used to establish animal varicocele models. The models were executed by breaking their necks 12 weeks after establishment, and the left testises were obtained to observe testis ultrastructure under transmission electron microscope. The epididymides of the two groups were obtained to isolate the sperm for observing its form, and the levels of testicular androgen binding protein (ABP) and inhibin-B (INH-B) were detected, and the immunohistochemical score (IHS) was calculated, and the testosterone level in testis tissue was also detected. Results Compared with those in SH group, in varicocele group, the microstructures of sertoli, stromal and sperm cells changed significantly; the difference of IHS value of ABP was not statistically significant in the two groups (P>0.05); the differences of IHS value of INH-B and testosterone level were statistically significant in the two groups (P<0.05,P<0.01). Conclusion Varicocele can change the cell functions by affecting sertoli and stromal microstructures in male mice. Furthermore, it can affect spermatic mature and development by changing reproductive and endocrine environment and sex hormone levels, and then sperm counts and morphological will be changed, eventually leading to infertility.
Varicocele; Ultrastructure; Androgen binding protein; Inhibin B; Testosterone; Rat, Sprague-Dawley
河北省人口和计划生育委员2012年科研计划课题(2012-A09)
050000 石家庄,河北医科大学第三医院泌尿外科(贾晓鹏);050082 石家庄,解放军白求恩国际和平医院妇产科(苗蕊、孙亚楠);063000 河北 唐山,唐山市工人医院泌尿外科(李斌)
R698.2;R-332
A
2095-140X(2015)08-0056-04
10.3969/j.issn.2095-140X.2015.08.014
2015-05-04 修回时间:2015-05-26)
